金雀异黄酮抑制OPN-FAK信号通路对非小细胞肺癌迁移和侵袭的影响
张 田, 任 丹, 李 杰
(1.陕西省咸阳市第一人民医院, 陕西 咸阳 712000 2.湖北省第三人民医院肿瘤科, 湖北 武汉 430030)
据统计肺癌是中国乃至全世界发病率、死亡率最高的癌种,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占85%,大多数患者就诊时已处于中晚期[1]。NSCLC的发病机制是一个多因素引发的复杂过程,但就目前治疗方案,NSCLC的5年生存率为16%[2]。因此需要深入探索NSCLC机制,以寻找高效治疗药物。金雀异黄酮(genistein,GS)属于异黄酮类,是一种存在于大豆中的天然植物雌激素,具有多种生物学作用,例如抗氧化、抗增殖,其作为抗肿瘤分子在各种癌症中也发挥着关键作用[3]。如GS通过调节黏着斑激酶(Focal adhesion kinase,FAK)蛋白抑制宫颈癌HeLa细胞的迁移和侵袭,但其在NSCLC的研究中甚少报道[4]。骨桥蛋白(Osteopontin,OPN)是一种磷酸化的糖蛋白,参与调节细胞黏附、迁移和侵袭。研究表明OPN水平在许多肿瘤如胰腺癌、结肠癌、NSCLC表达异常,可能与肿瘤进展及预后不良有关[5]。据报道FAK信号通路的激活对于OPN调节细胞迁移、侵袭至关重要[6]。基于以上发现,本研究推测GS可能通过抑制OPN/FAK信号通路参与NSCLC的迁移和侵袭。
1 材料与方法
1.1细胞来源:四种NSCLC细胞系(H596、H520、A549、H1703)及正常人肺上皮细胞(BEAS-2B)均购自美国典型培养物保藏中心。将细胞置于DMEM培养基中,于5% CO2和37℃的培养箱中培养细胞。
1.2主要材料、仪器:R&D Systems提供重组骨桥蛋白(rOPN);西安泽朗生物科技有限公司提供GS;Corning公司提供Transwell小室;BD Biosciences提供Matrigel溶胶、AnnexinV-FITC/PI细胞凋亡检测试剂盒;Invitrogen公司提供TRIzol试剂;碧云天生物科技有限公司提供结晶紫染色液、BCA测定试剂盒;EMD Millipore公司提供PVDF膜;Sigma-Aldrich提供MTT试剂;美国思拓凡公司提供DMEM培养基,Abcam公司提供OPN、p-FAK、FAK一抗。Olympus公司提供光学显微镜;美国Thermo公司提供CO2培养箱。
1.3qRT-PCR检测四种肺癌细胞系及BEAS-2B细胞中OPN、FAK mRNA表达水平:使用TRIzol试剂从H596、H520、A549、H1703、BEAS-2B细胞中提取总RNA,并使用逆转录试剂盒逆转录为cDNA。用于逆转录定量聚合酶链反应的引物序列见表1。参照实时PCR系统说明书操作步骤进行定量PCR反应。以GAPDH为内部对照,2-ΔΔCt法分析OPN、FAK mRNA相对表达量。

表1 qRT-PCR引物序列
1.4细胞分组及处理:将A549细胞分别接种在不同孔板中,设置分组为对照组、GS低浓度(GS-L)组、GS中浓度(GS-M)组、GS高浓度(GS-H)组、rOPN组、GS-H+rOPN组。对照组不做任何处理;GS-L组以10μmoL/L GS处理细胞48h;GS-M组以20μmoL/L GS处理细胞48h;GS-H组以40μmoL/L GS处理细胞48h[7];GS-H+rOPN组同时以15ng/mL rOPN、40μmoL/L GS处理细胞48h;rOPN组以15ng/mL rOPN处理细胞48h[8]。
1.5MTT法检测细胞增殖率:将A549细胞以每孔2×103个细胞的密度接种在96孔板中。按照上述1.4分组处理细胞后,向每个孔中加入20μL的5mg/mL MTT溶液。孵育4h后,去除孔中的上清液,加入100μL DMSO溶液使晶体完全溶解。通过酶标仪测量490nm处的光密度(OD)值,计算增殖率。
1.6流式细胞术检测细胞凋亡:使用胰蛋白酶消化A549细胞,用冰冷的磷酸盐缓冲液洗涤两次,并以1×106个细胞/mL的浓度重悬于缓冲液中。取100μL溶液转移到5mL培养管中,然后加入5μL PI和5μL FITC Annexin V。避光条件下室温孵育15min后,将400μL Binding Buffer添加到每管,并通过流式细胞仪分析凋亡变化。
1.7qRT-PCR检测A549细胞中OPN、FAK mRNA表达水平:操作步骤同上述1.3。
1.8划痕试验检测细胞迁移率:将A549细胞以每孔6×105个细胞密度接种在6孔板中。用无菌移液管尖端进行划痕,然后洗涤、去除脱落的细胞。然后将细胞按照上述1.4分组处理细胞,并在光学显微镜下于0、24h拍照。通过监测划痕宽度确定细胞迁移率。
1.9Transwell实验检测细胞迁移、侵袭实验:对于迁移测定,将A549细胞(5×104的细胞密度)混合在100μL的无血清培养基中,并接种到上室中;将600μL含5% FBS培养基接种在下室中。而侵袭测定中,上室首先用Matrigel溶胶在37℃、5% CO2的培养箱中涂抹,使其凝固。然后将细胞接种到上室中,并将完全培养基添加到下室中。迁移、侵袭测定实验均在培养箱中培养48h后,用棉签去除上室细胞,将下室细胞于4%多聚甲醛中室温固定30min,并用1%结晶紫染色液染色过夜,通过计数染色细胞定量细胞迁移、侵袭数目。
1.10Western blot检测相关蛋白表达水平:使用含有蛋白酶的细胞裂解物洗涤细胞并在冰上裂解。每个样品的蛋白质浓度由BCA蛋白质测定试剂盒确定。在10% SDS-PAGE上分离蛋白质样品并转移到PVDF膜上。用5%脱脂牛奶封闭后,用相应的抗体对膜进行印迹,并使用ECL蛋白质印迹检测试剂在Tanon成像系统上进行可视化蛋白,以GAPDH为内参,采用Quantity One软件对蛋白条带进行定量,其中一抗分别为1∶1000 OPN、1∶1000 FAK、1∶2000 GAPDH。
2 结 果
2.1四种肺癌细胞系及BEAS-2B细胞中OPN、FAK mRNA表达水平:四种肺癌细胞系(H596、H520、A549、H1703)中OPN、FAK mRNA表达水平较BEAS-2B细胞均显著增加(P<0.05),其中以A549细胞中OPN、FAK mRNA表达水平的变化最为显著,因此用于后续研究,见表2。

表2 细胞中OPN FAK mRNA表达水平比较
2.2比较各组A549细胞中增殖率的变化:与对照组相比,GS-L组、GS-M组、GS-H组A549细胞增殖率显著降低,rOPN组显著增加(P<0.05);与GS-H组相比,GS-H+rOPN组A549细胞增殖率显著增加(P<0.05),与rOPN组相比,GS-H+rOPN组A549细胞增殖率显著降低(P<0.05),见表3。

表3 A549细胞中增殖率变化
2.3比较各组A549细胞中凋亡率的变化:与对照组相比,GS-L组、GS-M组、GS-H组A549细胞凋亡率显著增加,rOPN组显著降低(P<0.05);与GS-H组相比,GS-H+rOPN组A549细胞凋亡率显著降低(P<0.05),与rOPN组相比,GS-H+rOPN组A549细胞凋亡率显著增加(P<0.05),见表4、图1。

图1 观察A549细胞凋亡变化

表4 A549细胞中增殖率变化
2.4比较各组A549细胞中OPN、FAK mRNA的表达水平:与对照组相比,GS-L组、GS-M组、GS-H组A549细胞OPN、FAK mRNA表达水平显著降低,rOPN组显著增加(P<0.05);与GS-H组相比,GS-H+rOPN组A549细胞OPN、FAK mRNA表达水平显著增加(P<0.05),与rOPN组相比,GS-H+rOPN组A549细胞OPN、FAK mRNA表达水平显著降低(P<0.05),见表5。

表5 A549细胞中OPN FAK mRNA表达水平比较
2.5比较各组A549细胞中的迁移率变化:与对照组相比,GS-L组、GS-M组、GS-H组A549细胞迁移率显著降低,rOPN组显著增加(P<0.05);与GS-H组相比,GS-H+rOPN组A549细胞迁移率显著增加(P<0.05),与rOPN组相比,GS-H+rOPN组A549细胞迁移率显著降低(P<0.05),见图2、表6。

图2 划痕实验检测迁移率变化

表6 A549细胞中迁移率的比较
2.6比较各组A549细胞中的迁移、侵袭数变化:GS-L组、GS-M组、GS-H组侵袭、迁移数较对照组显著降低(P<0.05);rOPN组侵袭、迁移数较对照组显著增加(P<0.05);GS-H+rOPN组侵袭、迁移数较GS-H组显著增加,但较rOPN组显著降低(P<0.05),见图3、表7。
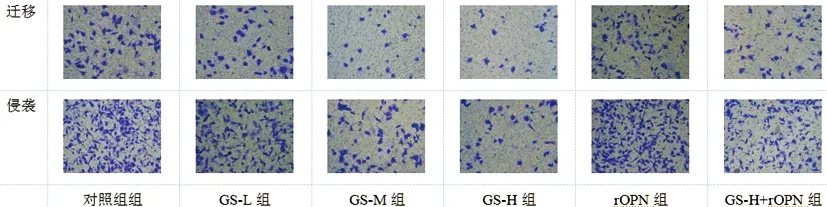
图3 A549细胞侵袭、迁移变化

表7 A549细胞中侵袭迁移细胞数的比较
2.7比较各组A549细胞中OPN/FAK信号通路蛋白表达:GS-L组、GS-M组、GS-H组OPN、p-FAK/FAK较对照组显著降低(P<0.05);rOPN组OPN、p-FAK/FAK较对照组显著增加;GS-H+rOPN组OPN、p-FAK/FAK较GS-H组显著增加,但较rOPN组显著降低(P<0.05),见图4、表8。
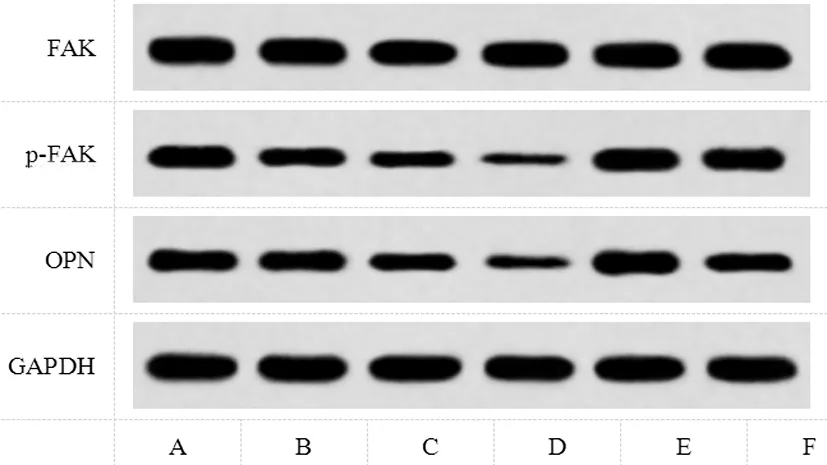
图4 A549细胞中OPN、p-FAK、FAK表达(Western blot图)

表8 A549细胞中OPN p-FAK/FAK比较
3 讨 论
肺癌是癌症死亡的最常见原因,尽管对NSCLC的治疗方法层出不穷,但肺癌患者的预后在过去几年中并未发生显著变化[9]。因此正确理解参与癌症发病机制的细胞信号通路,对于寻求有效药物改善NSCLC治疗效果至关重要。
GS属于类黄酮家族,是一种天然存在的、来自豆类的植物雌激素,具有与哺乳动物雌激素相似的化学结构,可以预防骨质疏松症、降低心血管疾病发病风险、缓解绝经后症状,抑制炎症反应。除此之外,GS还具有广泛的抗癌特性如在卵巢癌研究中[10],提供抑制促炎生物标志物水平发挥抗癌作用,成为治疗卵巢癌的潜在候选药物。基于以上文献报道,本研究猜测GS在NSCLC发展中也可能具有抗癌作用。研究结果表明GS可以抑制A549细胞增殖、迁移及侵袭,诱导其凋亡,呈现浓度依赖性,与Yu等[11]研究结果相吻合,表明GS可抑制A549细胞的恶性行为,表现出抗癌作用。
据报道OPN是一种分泌性细胞外基质糖基化磷蛋白,参与骨重塑中的骨基质矿化和重吸收过程,OPN高表达与几种肿瘤类型的癌症进展均有关,包括乳腺癌、肝癌、卵巢癌和结直肠癌[12]。推测肺癌的发生可能也与OPN过表达有关,本研究结果显示,四种NSCLC细胞系(H596、H520、A549、H1703)中OPN、FAK mRNA表达水平较BEAS-2B细胞均显著增加,表明NSCLC发生可能与OPN、FAK过表达有关。进一步的相关研究表明OPN在NSCLC中上调,且在NSCLC转移中发挥作用[13];在NSCLC-A549细胞研究中,OPN可抑制FAK磷酸化水平,可显著抑制OPN诱导的细胞侵袭[14]。但经不同浓度的GS处理A549细胞后,OPN、FAK基因和蛋白表达水平显著下调,猜想GS可以抑制OPN/FAK信号通路进而阻止A549细胞增殖、迁移和侵袭,诱导其凋亡。为验证上述猜想,实验引入OPN激活剂-rOPN进行回复验证,结果发现rOPN逆转了GS-H对A549细胞的增殖抑制和凋亡促进作用,表明GS通过抑制OPN/FAK信号通路降低A549细胞的迁移、侵袭及增殖能力,促进其凋亡。
综上所述,GS可以促进NSCLC-A549细胞凋亡,抑制其增殖、迁移和侵袭,可能与抑制OPN/FAK信号通路有关,为NSCLC治疗提供潜在药物。

