腺苷A2a受体激动剂对脓毒症急性肾损伤中内质网应激的调节作用
王静静, 巴音查汗·博然衣, 郭峻氚
(新疆维吾尔自治区人民医院重症医学科, 新疆 乌鲁木齐 830000)
脓毒症是一种复杂的临床综合征,由宿主对感染的反应失调引起,会引起全身炎症反应,并导致广泛的组织损伤和多器官功能障碍[1]。急性肾损伤(acute kidney injury,AKI)是脓毒症进展过程中最常见和最严重的并发症之一,据统计,高达60%的脓毒症病例并发AKI,这不仅易发展为慢性肾脏病,并大大增加了患者的死亡风险[2]。然而,脓毒症AKI致病机制复杂,发生发展涉及多种因素,目前尚无有效预防或治疗药物,因此,寻求该疾病的有效治疗手段十分关键。腺苷是一种内源性核苷,通过G蛋白偶联腺苷受体发出信号来控制细胞功能。目前已确定腺苷受体四种亚型:A1、A2a、A2b、A3,不同受体在各种病理生理条件下发挥重要作用。其中,腺苷A2a受体对腺苷具有很高的亲和力,可在肥大细胞、单核细胞、巨噬细胞、嗜酸性粒细胞、T细胞和血小板上表达,先前已有研究表明,当该受体被激活后可以抑制T细胞增殖和促炎因子的产生,有助于抗炎因子的合成,从而在多种炎症性疾病中起着关键的调节功能,因而在脓毒症治疗中具有很大潜力。但腺苷A2a受体在脓毒症中的研究尚处于临床前研究阶段,关于脓毒症相关AKI的研究报道也很少。CGS21680是腺苷A2a受体的高效激动剂,已被证实能够抑制多种炎性细胞的聚集及其介质释放[3]。基于此,本研究通过构建脓毒症诱导AKI大鼠模型,探讨腺苷A2a受体激动剂CGS21680能否减轻大鼠肾损伤,并对作用机制进行了初步探究。现报道如下。
1 材料与方法
1.1实验大鼠:40只健康SD大鼠,雄性,体质量180g~230g,购于新疆医科大学实验动物中心。大鼠在动物实验中心饲养,温度控制在23℃~25℃,相对湿度为55%,12h光暗循环,自由饮食、饮水,适应性饲养一周后开始实验。
1.2主要试剂:腺苷A2a受体激动剂CGS21680(美国Sigma Aldrich公司),水合氯醛(北京康瑞纳生物公司),封闭山羊血清原液(上海酶研生物科技公司),SCr、BUN、KIM-1和NGAL检测试剂盒(南京建成生物工程研究所),HE染色液和PAS染色液(北京凯诗源生物公司),TUNEL细胞凋亡染色试剂盒、DAPI染料、RIPA裂解液及ECL试剂(上海碧云天生物研究所),DAB显色试剂盒(北京普非生物科技公司),BCA蛋白检测试剂盒(北京康为世纪公司),辣根过氧化物酶标记的山羊抗兔IgG与兔抗GRP78、CHOP、MCP-1抗体(英国Abcam公司),兔抗GAPDH、XBP1、PERK、p-eIF2α及eIF2α抗体(美国Santa Cruz 公司)。
1.3方 法
1.3.1动物分组、造模及给药:将40只SD大鼠按数字随机表法分为对照组、腺苷A2a受体激动剂(CGS21680)组、模型(AKI)组、腺苷A2a受体激动剂干预(CGS21680+AKI)组,每组10只。除对照组外,其余3组大鼠均建立AKI模型,术前1h,CGS21680组和CGS21680+AKI组腹腔注射CGS21680(2.1mg/kg),对照组和AKI组腹腔注射等量生理盐水。AKI模型制备参考文献[4]方法操作,对照组大鼠仅开腹分离,不结扎、不穿孔。
1.3.2血清生化指标测定:1周后麻醉各组大鼠,尾静脉取血,室温静置2h,置于低温离心机通过3000 r/min离心15min,收集上清液,保存于-20℃备用。全自动生化分析仪测定血清SCr和BUN水平,ELISA法检测血清KIM-1和NGAL水平,实验均严格根据试剂盒说明书步骤操作。
1.3.3HE染色:各组大鼠采血结束后,解剖摘取肾脏组织,生理盐水清洗干净,4%多聚甲醛浸泡固定过夜。修剪固定好的组织,常规石蜡包埋,脱水与透明,切成5μm厚的组织切片,进行HE染色。染色后,中性树胶封片,通过光学显微镜观察肾脏病理变化并采集图像。
1.3.4PAS染色:取制备的各组大鼠肾组织石蜡切片进行脱蜡水化,置于阿利新蓝液中浸泡10min,流水冲洗,加入过碘酸处理5min,雪夫希夫染色10min,流水再次冲洗,苏木素复染,1%酸性乙醇分化,加入氨水返蓝,流水冲洗,脱水与透明,中性树胶封片,在光学显微镜下观察肾脏病理变化并采集图像。
1.3.5TUNEL染色:各组大鼠肾组织石蜡切片经过脱蜡水化后,室温下加入20μg/mL蛋白酶K作用15min, PBS冲洗,将蛋白酶K清洗干净。吸取适量TUNEL工作液滴于切片上,置于37℃湿盒内染色1h。室温避光环境下,滴加DAPI染核10min,脱水与透明。用抗荧光淬灭封片液封片,通过荧光显微镜观察并采集图像,镜下TUNEL阳性即凋亡细胞呈绿色荧光,随机选择6个视野,统计该视野下TUNEL阳性数目与总细胞数目,两者之比记为TUNEL阳性细胞率(%)。
1.3.6免疫组化染色:各组大鼠肾组织石蜡切片经脱蜡水化、柠檬酸盐缓冲液加热修复,3%H2O2孵育10min,以5%山羊血清作封闭液室温处理2h。将切片分别与兔抗GRP78、CHOP、MCP-1多克隆抗体(均按1∶500稀释)放于4℃冰箱内共孵育过夜。次日,PBS冲洗,加入辣根过氧化物酶标记的山羊抗兔IgG(按1∶1000稀释),室温下再孵育1h,PBS冲洗后,根据DAB试剂盒显色,苏木精复染,滴加中性树胶进行封片。在光学显微镜下观察并采集图像,镜下胞质有黄棕色至棕色颗粒沉积即为阳性,随机选择6个视野,Image J软件测量蛋白阳性表达面积占比。
1.3.7Western blot法:RIPA裂解液提取各组大鼠肾组织总蛋白,BCA法测定样品浓度。以蛋白质量为50μg计算各蛋白体积,加入缓冲液后加热煮沸,使蛋白变性。配置10%聚丙烯酰胺凝胶,将变性后的蛋白上样至胶孔,固定电泳装置,恒压电泳分离蛋白并转至PVDF膜。加入5%山羊血清室温封闭1h,将印迹与稀释后的一抗XBP1、PERK、p-eIF2α、eIF2α、MCP-1(1∶1000)置于4℃摇床共孵育过夜。TBST洗膜,加入对应稀释的二抗(1∶5000),室温下孵育1h,TBST再次清洗,ECL显影,凝胶成像仪进行可视化,以GAPDH作为内参蛋白,Image J软件分析条带灰度值,蛋白相对表达量以目的蛋白与内参蛋白的灰度值之比来表示。
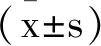
2 结 果
2.1各组大鼠血清生化指标水平比较:与对照组比较,CGS21680组大鼠血清SCr、BUN、KIM-1及NGAL水平未发生统计学变化(P>0.05),AKI组SCr、BUN、KIM-1及NGAL水平均较对照组显著升高(P<0.05)。与AKI组比较,CGS21680+AKI组SCr、BUN、KIM-1及NGAL水平均显著降低(P<0.05),见表1。

表1 各组大鼠血清SCr BUN KIM-1及NGAL水平比较
2.2各组大鼠肾组织病理学变化观察:HE染色与PAS染色结果显示,对照组和CGS21680组的大鼠肾组织未见病理学改变,组织结构完整。AKI组大鼠肾小管扩张、变性,肾间质加宽,肾小球水肿,基底膜明显增厚,有核细胞数目增加。CGS21680+AKI组大鼠肾损伤程度较AKI组明显减轻。见图1和图2。

图1 各组大鼠肾组织病理形态学变化观察(HE,×100)

图2 各组大鼠肾组织病理形态学变化观察(PAS,×100)
2.3各组大鼠肾组织内细胞凋亡比较:TUNEL染色统计结果显示,对照组和CGS21680组的大鼠肾组织内TUNEL阳性率之间差异无统计学意义(P>0.05),AKI组TUNEL阳性率显著高于对照组(P<0.05)。CGS21680+AKI组TUNEL阳性率则又显著低于AKI组(P<0.05)。见图3。

图3 各组大鼠肾组织细胞凋亡检测(TUNEL,×100)
2.4各组大鼠肾组织内质网应激水平变化比较:免疫组化染色结果显示,GRP78与CHO阳性表达主要分布于细胞浆,与对照组比较,CGS21680组大鼠肾组织GRP78、CHOP阳性表达比例未发生统计学变化(P>0.05),AKI组GRP78、CHOP阳性表达比例均显著高于对照组(P<0.05)。与AKI组比较,CGS21680+AKI组GRP78、CHOP阳性表达比例均显著降低(P<0.05)。见图4。

图4 各组大鼠肾组织GRP78与CHOP阳性表达检测(免疫组化,×100)
Western blot测定结果显示,与对照组比较,CGS21680组大鼠肾组织XBP1、PERK蛋白相对表达量及eIF2α/p-eIF2α比值未发生统计学变化(P>0.05),AKI组XBP1、PERK蛋白相对表达量及eIF2α/p-eIF2α比值均显著上调(P<0.05)。与AKI组比较,CGS21680+AKI组XBP1、PERK蛋白相对表达量及eIF2α/p-eIF2α比值显著下调(P<0.05)。见图5。

图5 各组大鼠肾组织XBP1、PERK、p-eIF2α及eIF2α蛋白表达水平比较
2.5各组大鼠肾组织MCP-1表达比较:免疫组化染色结果显示,MCP-1阳性表达主要分布于细胞浆,与对照组比较,CGS21680组大鼠肾组织MCP-1阳性表达比例未发生统计学变化(P>0.05),AKI组MCP-1阳性表达比例均显著上调(P<0.05)。与AKI组比较,CGS21680+AKI组MCP-1阳性表达比例均显著下调(P<0.05)。见图6。
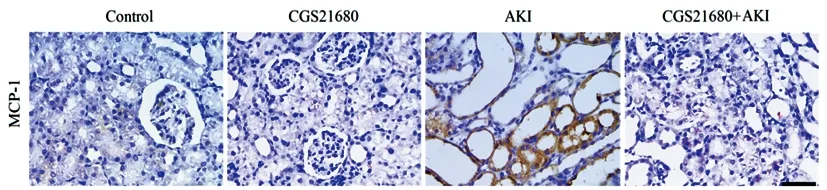
图6 各组大鼠肾组织MCP-1阳性表达检测(免疫组化,×100)
Western blot测定结果显示,与对照组比较,CGS21680组大鼠肾组织MCP-1蛋白相对表达量未发生统计学变化(P>0.05),AKI组MCP-1蛋白相对表达量显著上调(P<0.05)。与AKI组比较,CGS21680+AKI组MCP-1蛋白相对表达量显著下调(P<0.05)。见图7。

图7 各组大鼠肾组织MCP-1蛋白表达检测
3 讨 论
目前,腺苷A2a受体激动剂作为一种新型炎症调节剂,在多种疾病中抗炎效果十分突出,在自身免疫性疾病、心血管疾病和癌症中均发挥作用。研究表明,在大鼠胫骨骨折模型中局部植入含有腺苷A2a受体激动剂CGS21680的纤维蛋白凝胶后,降低了骨折大鼠血液和骨折区域的IL-6水平,调节Treg/Th17细胞趋于平衡,从而促进骨折愈合;在脑缺血模型沙鼠给予腺苷A2a受体激动剂聚脱氧核糖核苷酸(polydeoxyribonucleotide,PDRN)处理后,抑制了促炎细胞因子的分泌和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号途径的激活,改善神经元细胞存活,并防止脑缺血动物模型中短期记忆的下降;此外,腺苷A2a受体激动剂CGS21680可减轻缺血再灌注介导的组织损伤,并改善同种异体原位肝移植的功能恢复,提高移植动物模型的存活率[5,6]。本研究结果显示,腺苷A2a受体激动剂CGS21680处理下的脓毒症AKI大鼠肾组织损伤明显减轻,血清中肾功能损害相关指标SCr、BUN、KIM-1、NGAL水平均降低,肾组织内细胞凋亡减少。由此说明,腺苷A2a受体激动剂CGS21680对脓毒症诱导的AKI大鼠发挥保护作用。
在病理条件下,细胞可能会失去蛋白质平衡,导致内质网中未折叠和错误折叠的蛋白质积累,从而触发未折叠蛋白质反应或内质网应激。在轻度内质网应激下,细胞激活未折叠蛋白质反应以恢复蛋白质平衡,促进细胞存活并增强细胞承受应激的能力。然而,一旦内质网应激过度,未折叠蛋白质反应的适应能力就会不堪重负,导致细胞凋亡程序启动,来消除不可逆的受损细胞,进而造成组织损伤。多项研究证实,内质网应激参与脓毒症过程并导致肾组织损伤,内质网应激标志物GRP78和CHOP在脓毒症AKI肾组织中表达升高,并后续诱导肾小管上皮细胞凋亡[7]。提示内质网应激是脓毒症AKI临床防治的潜在新靶点。XBP1是一种独特的碱性区域亮氨酸拉链转录因子,其活性形式是由内质网平衡破坏和未折叠蛋白反应激活时的非常规剪接反应产生的,也是内质网应激诱导蛋白表达的关键引发剂[8]。PERK是一种位于内质网上的I型跨膜蛋白,在ER应激条件下,PERK在与腔内伴侣GRP78解离后激活,激活的PERK通过使起始因子eIF2α失活来抑制蛋白质向内质网的翻译,导致蛋白质合成减少,这种抑制作用有助于通过减少错误折叠或未折叠蛋白质进一步流入内质网来抑制内质网应激[9]。本研究结果显示,经过腺苷A2a受体激动剂CGS21680处理的脓毒症AKI大鼠肾组织中GRP78和CHOP蛋白表达下降,同时,肾组织内XBP1、PERK蛋白表达及eIF2α/p-eIF2α比值也下调。这一研究结果说明了腺苷A2a受体激动剂CGS21680能够抑制脓毒症AKI模型大鼠机体内质网应激,发挥肾组织保护作用。
单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)也称为趋化因子配体2,通过将单核细胞、巨噬细胞等募集到损伤组织或感染部位发挥促炎作用。已有研究表明,MCP-1在脓毒症AKI患者血清中明显偏高,不仅与疾病严重程度显著相关,还与机体炎症反应和免疫反应密切相关,因而在脓毒症AKI病理机制中至关重要,推测其可能成为脓毒症AKI诊疗的靶点[10]。本研究发现,脓毒症AKI大鼠肾组织中MCP-1表达也升高,而经过腺苷A2a受体激动剂CGS21680处理的脓毒症AKI大鼠肾组织中MCP-1表达明显降低,由此提示,腺苷A2a受体激动剂CGS21680对脓毒症AKI模型大鼠的保护作用是通过降低MCP-1表达水平实现的,这可能是腺苷A2a受体激动剂的作用机制之一。
综上所述,腺苷A2a受体激动剂CGS21680能够显著减轻脓毒症AKI模型大鼠的肾损伤,机制可能与其抑制内质网过度应激、降低MCP-1表达水平有关。但腺苷A2a受体调节炎症反应的药理作用多样,是否涉及其他作用机制仍需进一步进行探讨,以期为该药物的临床应用研究奠定基础。

