基于ACR TI-RADS对甲状腺髓样癌的诊断价值及诊断方法改良
张孜玮 游振辉 林 宁
(1 福建省立医院 超声科,福建 福州 350001;2 福建省立医院基本外科,福建 福州 350001)
甲状腺癌在中国女性人群中发病率居恶性肿瘤第4位[1]。甲状腺髓样癌(MTC)发病率较低,占甲状腺癌的5%~10%[2]。MTC预后较差,文献报道其10年生存率为69%~89%[3],早期易出现淋巴结转移或远处转移[4],术后复发率高。国内外不少机构各自发布了不同的指南,其中TI-RADS应用较为广泛。ACR TI-RADS是基于ACR所支持的一种分类系统,目的是建立甲状腺结节危险分层系统。MTC患病率与PTC相比偏低,过少的研究对象限制了对其研究的深入。既往关于MTC超声研究多集中描述MTC的超声发现或比较MTC与良性结节的差异,ACR TI-RADS对MTC诊断的应用价值研究较少。本研究以2017年ACR发布的TI-RADS指南为分类标准[5]来研究ACR TI-RADS对MTC的诊断效能。除对ACR TI-RADS所依据的各项超声特征逐一分析外,还对患者的年龄、性别、结节直径、位置以及内部血流丰富度进行分析。
1 材料与方法
1.1 一般资料 选择2012—2018年在我院超声检查并经病理确诊MTC的患者80例,PTC结节179例,良性结节224例(腺瘤73例,结节性甲状腺肿151例)进行回顾性分析,研究ACR-TIRADS对MTC的诊断效能及改良诊断法。所有患者均知情同意,患者均签署知情同意书,本研究已获得我院伦理委员会的批准。选择2018—2019年在我院超声检查并经病理确诊MTC的患者14例,PTC结节95例,良性结节89例(腺瘤28例,结节性甲状腺肿61例)作为验证组验证改良法效果。纳入标准:所有患者满足下列条件,包括:①有明确病理结果。②超声及临床资料齐全。③多发结节者选取最大结节或可疑恶性结节。排除标准:①超声数据不完整。②病理资料不全。③有头颈部放疗史或结节射频治疗史。
1.2 仪器和方法 使用Philips IU22彩色多普勒超声诊断仪器,线阵探头,探头频率为6~13 MHz,调节仪器的频率、增益及深度清晰显示结节。患者去枕仰卧,头略后仰。行常规超声扫查并记录结节位置、直径、边界、形态、回声、纵横比、钙化等启动彩色多普勒超声观察其内部及周边的血流分布。
1.3 声像图分析 ①性质。囊性:囊性或几乎完全囊性。海绵状:存在小囊肿,类似于海绵样液体填满空间。囊实性:结合了囊性与实性中的2个特征,无论实性与囊性成分的比例。实性:实性或几乎完全实性。②回声。极低回声(低于颈前肌)、低回声(低于甲状腺实质)、等回声(近似甲状腺实质)、高回声(高于甲状腺实质)、无回声(囊性或几乎囊性)。③形态。分为卵圆形生长<1和直立性生长≥1。④边缘。光滑(边缘清晰)、不清(难以辨认与周围的界限)、不规则或分叶(毛刺、锯齿或分叶状)、甲状腺外扩展[向周围软组织和(或)血管侵犯]。⑤钙化强回声。无或大彗尾(后方彗尾深度>1 mm)、粗钙化(直径≥2 mm,常伴声影)、边缘/环状钙化(沿周边分布的较大钙化)、微钙化(直径<2 mm,后无声影)。⑥内部血流信号比周围正常甲状腺组织多为血流信号丰富(Alder分级:Ⅱ~Ⅲ级),反之不丰富(Alder分级:0~Ⅰ级)。⑦位置。位于甲状腺侧叶靠上部1/3处为上方,靠下部1/3处为下方,余为中部。⑧直径。结节上下径、前后径、左右径中最大径,单位为mm。
1.4 统计学方法 应用SPSS 19.0软件包进行统计学分析。计数资料以率表示,计量资料以()表示,单因素分析采用χ2检验及精确概率Fisher检验;多因素分析采用二元Logistic多因素回归分析。采用组内发生率比值计算特征组内权重,采用加权最小二乘法计算多因素间权重比例。以P<0.05为差异有统计学意义。
2 结果
2.1 ACR TI-RADS分级结果 483例病例依据ACR TI-RADS分级情况见表1。将MTC组与PTC组、良性组做交叉表加权卡方检验,Fisher精确检验χ2=12.566,P=0.014。见表1。

表1 各组病例的ACR TI-RADS分级[n(%)]
2.2 ACR TI-RADS得分对MTC诊断的ROC分析 MTC在ACR TI-RADS评分系统下的平均得分为(6.65±3.098)分,高于良性组(3.48±2.593)分,低于PTC组(8.50±2.209)分,行t检验,P<0.05。排除PTC组病例后,将MTC组和良性组作为总分析样本,以ACR TI-RADS得分为检验变量做MTC诊断的ROC曲线见图1,ACR TI-RADS得分曲线下面积为0.785(95CI%,0.727-0.843),以4.5分作为最佳截断值时,MTC诊断的灵敏度(72.5%)、特异度(67.9%)、准确率(69.1%)均较低。

图1 ACR得分对MTC诊断的ROC曲线
2.3 ACR TI-RADS 1~4级结节超声特征差异 分析组排除ACR TI-RADS分级为5级的病例后,剩余病例254例,其中MTC组39例,PTC组23例,良性组192例,将PTC组和良性组合并为非MTC组。良性组直径(27.45±14.21)mm,PTC组(13.65±10.55)mm,非MTC组(25.98±14.49)mm,MTC组(19.04±16.94)mm。采用近似4分法对直径分类,将其按照10 mm、25 mm、35 mm三个节点分组。分析组1~4级病例超声特征见表2。

表2 ACR TI-RADS 1~4级甲状腺结节超声特征[n(%)]
2.4 ACR TI-RADS 1~4级MTC超声特征诊断分析 对每个超声特征进行二元Logistic回归分析,以结节是否为MTC为因变量,各超声特征为自变量或哑变量,模式系数综合校验P=0.000,模式准确预测率为90.6%。其中血流丰富度OR=32.935(P=0.000),回声OR为3.837(P=0.049),位置OR=0.322(P=0.006),直径OR=0.414(P=0.012),成分P=0.366;形状P=0.999;边缘P=0.163;钙化P=0.856。
2.5 ACR TI-RADS 1~4级超声特征组内权重和组间权重系数 通过“组内发生率”和“组内发生率比值(incidence ratio,IR)”区别各超声特征组内不同特征的评分权重,如“低回声”的MTC组内发生率即MTC组内低回声的结节个数/MTC的总个数×100%,组内发生率比值=MTC组内发生率/非MTC组内发生率×100%。对ACR TI-RADS 1~4级病例重新计算组内权重并以内部血流丰富度为基准,采用加权最小二乘法进行权重估计获得组间权重系数。根据组内发生率比值和组间权重系数换算归一化权重系数,按近似简化原则对权重系数优化。见表3。
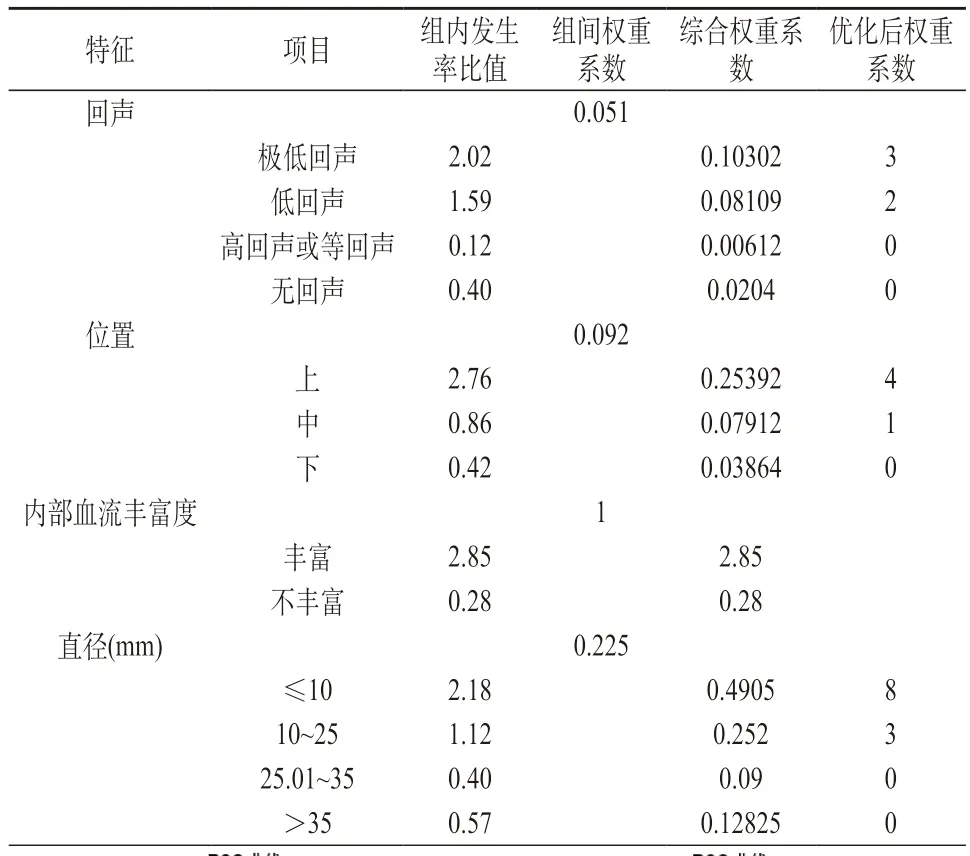
表3 改良评分模式的超声特征权重赋分
2.6 基于ACR TI-RADS的补充评分模式构建 由于内部血流丰富度对MTC的诊断结果影响大,为避免造成各超声特征赋分差距过大,不直接对血流丰富度赋分。将直径按≤10 mm得8分、10~25 mm得3分、>25 mm得0分,位置按上部得4分、中部得1分、下部得0分,回声按极低回声得3分、低回声得2分、高回声等回声无回声均得0分,相应赋分求和后根据血流丰富与否分别做ROC曲线。当内部血流丰富时,ROC曲线见图2,AUC为0.806,95%CI为[0.714,0.899],最佳截断点4.5分,此时灵敏度77.4%,特异度76.7%,MTC诊断准确率76.9%。当内部血流不丰富时,ROC曲线见图3,AUC为0.813,95%CI为[0.659,0.966],最佳截断点8.5分,此时灵敏度87.5%,特异度77.4%,MTC诊断准确率77.9%。
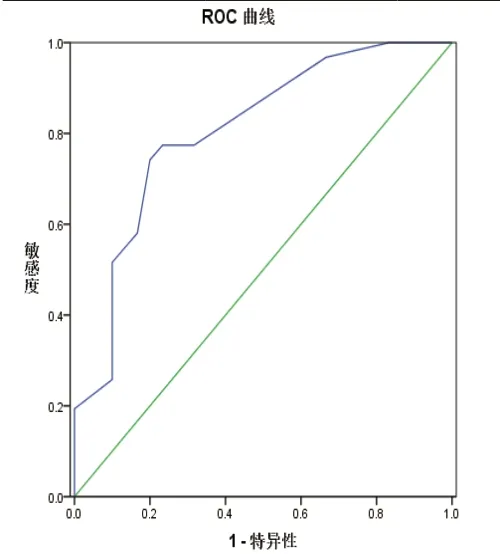
图2 内部血流丰富时的ROC曲线

图3 内部血流不丰富时的ROC曲线
合计ACR TI-RADS分级为1~4级时,采用改良法诊断MTC的达到灵敏度79.5%,准确率77.6%。加上第一轮用ACR TI-RADS诊断的5级病例229例中有良性组32例、PTC组156例、MTC组41例,两轮合计MTC诊断灵敏度90.0%,准确率75.0%,诊断恶性结节占总量的93.1%。
验证组采用改良法诊断的198例中,内部血流丰富时MTC诊断灵敏度66.7%,特异度82.8%,内部血流不丰富时MTC诊断灵敏度100%,特异度84.4%,合计诊断灵敏度77.8%,准确率83.8%,加上第一轮用ACR TI-RADS诊断的5级病例111例中有良性组15例、PTC组91例、MTC组5例,两轮合计MTC诊断灵敏度85.7%,准确率71.8%,诊断恶性结节占总量的95.4%。见表4。

表4 改良诊断方法诊断MTC的效果[n(%)]
3 讨 论
3.1 1~4级MTC的超声特征分析 研究发现MTC与内部血流丰富的超声特征明显相关。这可能是MTC似其他恶性肿瘤能分泌血管生成因子,刺激肿瘤及周围组织生成异常新生血管以滋养肿瘤[6]。多数良性结节则表现为周边环绕少许血流信号,也有部分周边血流丰富呈抱球状,而内部血流丰富相对少见。故内部血流丰富对于1~4级的可疑结节是较好的诊断MTC指标。MTC直径(19.04±16.94)mm较PTC(13.65±10.55)mm大,但较良性组(27.45±14.21)mm小。可能是较大的MTC已成长到后期,具备了其他典型的恶性结节特征易被诊断,因此1~4级中的MTC往往直径偏小。也有文献报道甲状腺癌的血流分布与体积相关[7],故内部血流不丰富的MTC大多(87.5%)直径在7 mm以下,病理可见因其成长较早,内部血管也较小。对于血流不丰富的MTC,结节直径的诊断尤为重要。
回声上MTC(87.2%)与PTC(82.6%)均以极低回声和低回声为主,显著高于良性组(50.0%),MTC极低回声(10.3%)患者比例较PTC(4.3%)高,该特征对于1~4级的结节是诊断MTC的有效特征。因MTC多为较一致的癌细胞,间质少,故细胞间声阻抗差异小。本研究发现MTC多位于甲状腺的中上部(84.6%),特别是位于上部的比例(43.6%)显著高于1~4级的PTC(17.4%)和良性结节(15.6%),这可能是MTC起源于滤泡旁C细胞,而C细胞以甲状腺中、上部分布最为密集[8]。而PTC及良性结节起源于甲状腺滤泡细胞,分布没有规律。
3.2 改良法的应用价值 MTC恶性程度较高,根治性手术是MTC治愈的唯一机会[9]。晚期MTC即使是广泛手术也无法治愈和延长生存期,故早期诊断对MTC患者的预后很重要。FNA是术前鉴别甲状腺结节良恶性最准确、最有效的初筛方法[10],但对所有结节行穿刺活检不具可行性。MTC在实性、低回声、纵横比≤1等特征上的比例介于良性组与PTC组之间,因此在诊断MTC的实践中按照ACR TI-RADS分类,高度可疑恶性的结节最大可能是PTC[11],以PTC典型特征比例制定分级标准判断时易漏诊MTC。尽管ACR TI-RADS 5级对于MTC的阳性检测率仅约为50%,但由于MTC在甲状腺癌中的占比仅有5%~10%,故ACR TI-RADS对分类为5级的结节总体诊断准确率很高。对于ACR TI-RADS 5级的结节,不论是PTC还是MTC按照ACR TI-RADS指南建议处理即可。即使不做FNA,临床也可以通过检查降钙素及CEA来检出MTC。因此对于ACR TI-RADS分级为5级的结节无须建立新的诊断模式来筛选MTC。在ACR TI-RADS 1~4级结节中,典型PTC和接近典型PTC超声特征的MTC已被排除,剩余的PTC数量少且恶性特征不典型,剩余的MTC声像酷似腺瘤,国内也有类似报道[12-13]。对于这些结节,可以采用改良诊断模型进行二次诊断,并与ACR TI-RADS的5级诊断结合,从而有效提高MTC的检出率。
采用改良法后,MTC检测灵敏度(90.0%)比直接按ACR TI-RADS分级4级及以上诊断MTC的灵敏度(87.5%)略高的同时,良性结节误诊率(30.4%)较前(50.0%)大幅降低。对比直接采用ACR TI-RADS总分4.5分作为截断值的MTC判断标准(灵敏度72.5%),避免了对ACR TI-RADS的直接改动,在不影响占恶性结节多数的PTC诊断效能的同时提高了MTC的检测灵敏度。改良法对恶性结节总体的检测灵敏度93.1%,特异度69.6%,阳性预测值78.0%,阴性预测值89.7%,准确率82.8%,说明其对包括PTC、MTC在内的甲状腺恶性结节诊断均有较好效果。改良法在ACR TI-RADS分级诊断的基础上,仅对诊断结果为1~4级的结节进行3个超声特征的赋分并求和,根据内部血流是否丰富,分别按≥5分和≥9分进行MTC异常诊断,可以作为ACR TI-RADS的补充适于在临床作为早期筛查的一种简便方法。尽管改良法相当比例的良性结节可能被误诊,但考虑到较高的MTC检测灵敏度(90.0%)仍有统计学意义。为避免良性结节被过度穿刺活检,此时需要结合降钙素及CEA检测以协诊。
3.3 结论 ACR TI-RADS诊断MTC中具有一定的临床价值,但与其对PTC的诊断效果相比,其对MTC的诊断灵敏度偏低;通过基于ACR TI-RADS 5级和对ACR TI-RADS 4级及以下的结节采用补充评分模式进行诊断,改良法在保证较高特异度的前提下,有效提高了MTC诊断的灵敏度,并有效减少漏诊率,不失为一种较好的MTC早期诊断改良方法。本研究存在的不足:①样本量较少,特别是良性结节和PTC纳入的数量偏少,可能一定程度上减低了研究效能。②只对MTC和良性结节,MTC和PTC纳入分析,没有对非MTC的其他恶性结节如滤泡癌等开展研究,今后需要更细致分组减少选择性偏倚。③超声特征中未纳入声晕、后方回声衰减、甲状腺被膜是否受侵犯、边缘钙化是否中断等特征。期望今后加入其他特征参与评分提高改良评分模式的诊断准确性。

