恶性肿瘤合并静脉血栓栓塞症患者PAI-1 4G/5G基因多态性及药物预防*
夏春勇,丁玲,贺小艳,黄莉娟,常秋红,秦丽娟,曹珍铭,刘洁
(重庆大学附属江津医院药学部,重庆 402260)
静脉血栓栓塞症(venous thromboembolism,VTE)是一类静脉回流障碍性疾病,发病是因血液在静脉内不正常地凝结,使血管完全或不完全阻塞所导致。流行病学研究发现,恶性肿瘤患者为VTE发生的高危人群,恶性肿瘤患者VTE发生相较于非肿瘤患者高4~7倍,发病率为4%~20%[1]。近年来,随着我国精准医疗的发展,相关研究已证实VTE的发生、发展受纤溶酶原激活剂抑制物-1(plasminogen activetor inhibitor-1,PAI-1)基因4G/5G的多态性影响,PAI-1基因多态性会引起血浆中纤维蛋白溶解异常进而导致VTE的形成[2]。但现有的关于PAI-1基因多态性与静脉血栓的相关性研究在肿瘤患者群体中的研究较少且无药物预防策略[2-6]。因此,为减少肿瘤患者VTE的发生,同时提高肿瘤患者的生存率,本课题通过选择遗传因子PAI-1基因多态性作为切入点,研究其与肿瘤患者VTE的相关性,同时对PAI-1基因指导VTE预防效果加以验证,旨在为临床VTE的诊断、预防和治疗提供理论依据。
1 资料与方法
1.1研究对象 基因差异性比较对象为我院于2019年8月—2020年12月收治的148例恶性肿瘤患者;基因干预研究对象为2021年5—12月新收治的60例恶性肿瘤患者,患者在入组前均获取知情同意并签署知情同意书。本研究方案经重庆市江津区中心医院伦理委员会批准(伦理批件号:KY2020003)。基因差异性比较纳入标准:符合恶性肿瘤诊断标准。基因干预研究纳入标准:①符合恶性肿瘤诊断标准;②入院时非VTE患者。排除标准:①病历资料不全;②伴有血栓疾病史的患者;③入院前服用过抗血小板、抗凝药物的患者;④凝血功能异常的患者。
1.2主要检测试剂与设备 PAI-1基因测序反应通用试剂盒(批号:20191216027,20200611027,20210816027,济南广音医疗科技有限公司生产);多通道荧光定量分析仪(型号:Fascan 48S,西安天隆科技有限公司生产)。
1.3药物 达肝素钠注射液,每支0.2 mL:5 000 IU,批号:F409201106,河北常山生化药业股份有限公司生产;低分子肝素钙注射液,每支0.4 mL:4100 IU,批号:F402210504,河北常山生化药业股份有限公司生产;依诺肝素钠注射液,每支0.4 mL:40 mg,批号:A1E707V,南京健友生化制药股份有限公司生产。
1.4方法
1.4.1患者临床资料收集 通过我院医院信息系统查阅和收集入组患者病历资料,记录患者年龄、性别、体质量、吸烟史、饮酒史、血栓家族史、糖尿病史、高血压史、冠心病史等。
1.4.2VTE诊断标准 深静脉血栓(deep venousth-rombosis,DVT)与浅表血栓性静脉炎诊断均依据静脉超声图像或计算机断层扫描(CT)静脉血管造影判断;肺栓塞(pulmonary embolism,PE)诊断通过CT肺血管造影或肺通气灌注扫描证实。
1.4.3患者分组 基因差异性比较通过我院医院信息系统查阅病历,根据患者是否发生VTE分为静脉血栓组和非静脉血栓对照组。基因干预研究采用单盲、随机数字表法将新收治的非VTE的肿瘤患者分为基因指导组和非基因指导组各30例。
1.4.4PAI-1 4G/5G基因多态性检测 采集肿瘤患者外周静脉血2 mL,送至药学部药物基因检测实验室。具体检测方法为:①用移液枪取样本萃取液1 mL,加入到一支新的离心管(1.5 mL)中;②将含有患者外周静脉血的EDTA抗凝管上下颠倒10次;③用移液枪吸取200 μL血样加入样本萃取液中充分混匀;④静置10 min后,将离心管放入小型离心机中(12 000 r·min-1,7 500×g)离心3 min,之后取出离心管,可观察到管底部有1 mm×1 mm×1 mm的白细胞富集团;⑤用移液枪吸走并打掉离心管内上层透明的红色液体;⑥向离心管中加入细胞保存液400 μL,振荡混匀;⑦用移液枪取白细胞样本液2 μL,加入到PAI-1基因检测探针中,离心20 s;⑦将检测探针放入多通道荧光定量分析仪完成上机检测。
1.4.5评价标准与干预措施制定 基因指导组根据PAI-1 4G/5G基因检测结果并结合D-二聚体生化指标来评价是否为VTE高风险人群,采取的VTE预防措施参照《肿瘤相关静脉血栓栓塞症预防与治疗指南(2019版)》制定[1]。非基因指导组无基因筛查未采取VTE预防措施。
1.4.6统计指标 化疗期间及化疗后15 d内进行随访,观察患者是否为静脉血栓栓塞事件(深静脉血栓、浅表血栓性静脉炎、肺栓塞),统计例数和发生率。

2 结果
2.1基因差异性研究
2.1.1一般资料 基因差异性比较共纳入肿瘤患者148例,其中发生VTE肿瘤患者30例,未发生VTE肿瘤患者118例。两组经一般资料比较,各项基线信息均差异统计学意义。见表1。

表1 两组患者的基线信息比较
2.1.2PAI-1 4G/5G基因检测结果 148例进行PAI-1 4G/5G基因检测的患者,经基因检测结果为:静脉血栓组(30例)中,PAI-1野生型基因 5G/5G4例(13.3%),杂合子型基因4G/5G11例(36.7%),纯合子型基因4G/4G15例(50%),等位基因4G出现的频率为68.3%,等位基因5G出现的频率为31.7%;非静脉血栓对照组(118例)中,PAI-1野生型基因 5G/5G57例(48.3%),杂合子型基因4G/5G 51例(43.2%),纯合子型基因4G/4G10例(8.5%),等位基因4G出现的频率为30.1%,等位基因5G出现的频率为69.9%。静脉血栓组与非静脉血栓对照组基因分布频率比较,基因型和等位基因差异均有统计学意义(P<0.05),见表2。
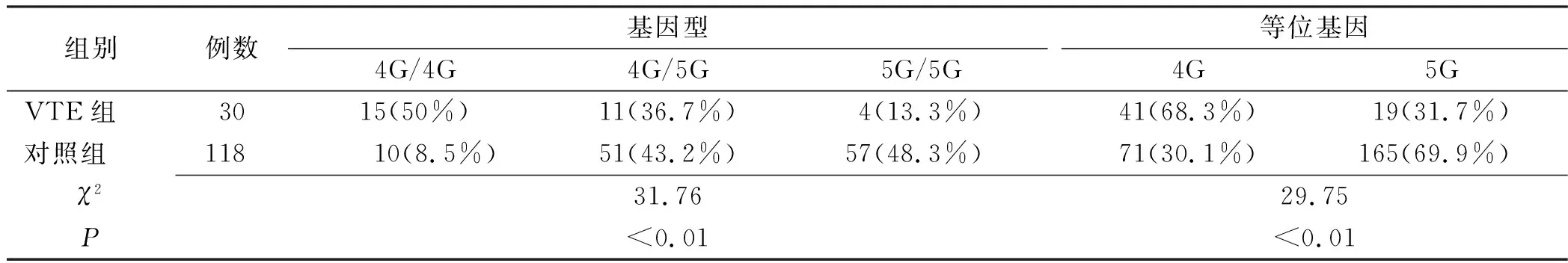
表2 PAI-1等位基因分布频率比较
2.1.3Hardy-Weinberg遗传平衡检验 静脉血栓组与非静脉血栓对照组的3种基因型分布频率,经统计检验,预测例数和实际例数之间的差异无统计学意义(P>0.05),符合Hardy-Weinberg遗传平衡,表明所选取的样本具有群体代表性。见表3。
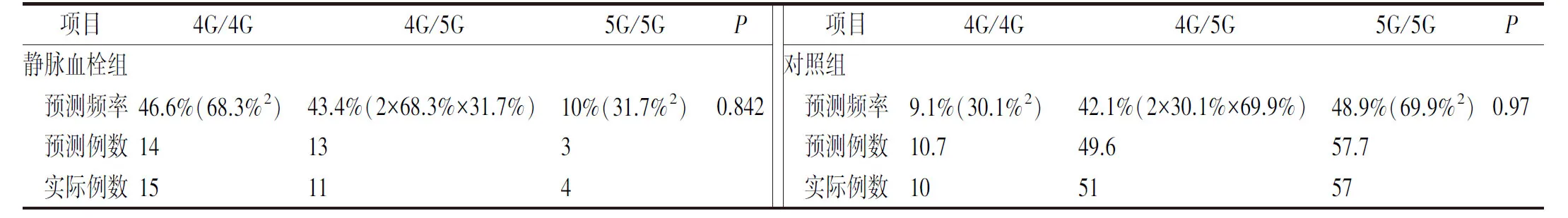
表3 静脉血栓组和对照组PAI-1基因型 Hardy-Weinberg 遗传平衡检验
2.2基因干预研究
2.2.1基因指导用药情况 在基因干预研究中,共纳入60例入院诊断为非VTE的肿瘤患者,随机数字表法分为:基因指导组(30例)和非基因指导组(30例)。一般资料比较与“2.1.1”项相同。经比较,两组肿瘤患者基线水平一致。基因指导组均经PAI-1 4G/5G基因检测,其结果为:突变纯合子(4G4G)6例,突变杂合子(4G5G)17例,野生型(5G5G)7例。根据PAI-1基因检测结果采取的VTE预防措施:突变纯合子(4G4G)给予肝素抗凝,突变杂合子(4G5G)中若入院D-二聚体高于正常值范围给予肝素抗凝,其余情况不采取VTE预防措施。基因指导组中满足上述干预情况的研究对象合计8例,分别为突变纯合子(4G4G)6例,突变杂合子(4G5G)且D-二聚体高于正常值范围2例。见表4。

表4 基因检测指导肿瘤患者个体化用药
2.2.2静脉血栓栓塞事件比较 基因指导组经PAI-1基因检测并根据基因检测和D-二聚体结果对患者进行VTE预防后,发生静脉血栓栓塞事件0例。非基因指导组中发生静脉血栓栓塞事件4例(均为深静脉血栓),发生率为13.33%。基因指导组静脉血栓栓塞事件发生率明显低于非基因指导组,差异均有统计学意义(P<0.05)。
3 讨论
3.1PAI-1 4G/5G基因多态性 PAI-1是纤溶系统的主要生理抑制剂,其含量和活性增加可降低纤溶活性,促进血栓的形成和发展。研究表明,PAI-1基因启动子区-675位的4G/5G多态性与PAI-1表达水平密切相关[7]。PAI-1 4G/5G基因多态性是一种单核苷酸多态性,位于人类的基因启动子区-675位,包括23个外显子和22个内含子,在该基因位点处由于鸟嘌呤的插入或缺失导致PAI-1基因多态性,包括突变纯合子4G/4G,突变杂合子4G/5G以及野生型5G/5G[8]。在PAI-1基因相关研究中[9-10],PAI-1基因中的4G等位基因能够通过上调PAI-1基因表达从而引起血浆PAI-1浓度升高,使患者处于髙凝状态,表现出血栓倾向。本课题第一部分基因差异性研究中,静脉血栓栓塞组等位基因4G出现的频率为68.3%,相较于非静脉血栓栓塞组的等位基因4G出现频率30.1%,明显升高,差异有统计学意义。除等位基因4G与VTE风险增加有关外,文献研究中提到,突变纯合子也会导致VTE风险增加[11]。本研究静脉血栓栓塞组中突变纯合子4G/4G分布频率为50%,也远高于对照组的8.5%。综上所述,本研究PAI-1 4G/5G基因与VTE的相关性结论和文献研究一致,且可适用于恶性肿瘤患者。此外,本研究显示,静脉血栓栓塞组与对照组的 4G/5G基因多态性和基因频率均合Hardy-Weinberg遗传平衡,所选样本具有群体代表性。
3.2PAI-1 4G/5G基因检测在肿瘤患者VTE预防中的价值 VTE是继心肌梗死和脑卒中之后的第三大心血管死亡原因,每年全球因VTE死亡的人数超过300万[12-13]。 肿瘤是VTE发生的高危险因素。相关研究表明,恶性肿瘤患者VTE发生相较于非肿瘤患者高4~7倍,其发病率为4%~20%[1]。尽管VTE在肿瘤患者中的发病率高,但事实上肿瘤患者住院期间接受血栓预防实施率却很低[14]。究其原因,目前临床上在用的血栓风险评估量表(如:caprini模型)较为复杂,临床上缺少一种快速、准确且行之有效的VTE高危人群筛选手段。因此,为找到一种更佳的筛查方法,本课题第二部分采取基因干预研究,基因干预组首先通过PAI-1基因检测结果并结合D-二聚体评估该患者是否为VTE高风险人群。针对VTE高风险人群,采取抗凝预防。最终结果表明,基因干预组静脉血栓栓塞事件发生率明显低于非基因干预对照组。
综上所述,对于肿瘤患者可通过PAI-1 4G/5G基因筛查并结合D-二聚体识别出VTE高风险人群,以便尽早采取VTE预防措施,减少肿瘤患者VTE的发生,大大提高肿瘤患者的生活质量。本研究不足之处:由于纳入的样本量较少,缺乏对不同肿瘤类型及转移做更深入的研究,PAI-1 4G/5G基因筛查作为肿瘤患者VTE高危人群的筛查手段有待进一步研究验证。

