美罗培南在血液肿瘤患者中的PK/PD研究及PPK模型构建*
罗攀,唐原君,姚敏,王琴琴,宋献民,高君伟
(1.上海交通大学医学院附属第一人民医院临床药学科,上海 200080;2.华中科技大学同济医学院附属同济医院药学部,武汉 430030;3.上海交通大学医学院附属第一人民医院血液科,上海 200080)
血液肿瘤患者通常合并免疫力低下及粒细胞缺乏,较一般人群更易发生感染,且感染后疾病进展迅速,病死率高。对于这些患者的抗菌治疗往往需要及时、足量给予。美罗培南由于组织穿透力强、抗菌谱广、对超广谱β内酰胺酶稳定等特点成为血液肿瘤尤其是伴粒缺发热患者经验性治疗的首选药物[1]。
美罗培南属于时间依赖性抗菌药物,游离药物浓度高于病原体最低抑菌浓度(minimum inhibitory concentration,MIC)的时间(%fT>MIC)决定了其抗菌效果,可作为其临床和微生物学疗效的药动学/药效学(pharmacokinetics/pharmacodynamics,PK/PD)靶指数[2]。研究表明要取得良好的抗菌效果,美罗培南的%fT>MIC期望值应达到给药间隔的40%(40%fT>MIC)以上,对于危重症患者或免疫功能不全患者要求更高,期望达到100%覆盖甚至更高的要求[3]。目前,研究常用PK/PD靶指数预设靶标的目标获得概率(probability of target attainment,PTA)来判断给药方案的有效性并以此进行方案优化。前期有研究表明,血液肿瘤患者中美罗培南的清除受疾病状况影响,且需要更高的剂量并维持更长输注时间才能达到较好的PTA[4-5]。因此,本研究将探讨本单位血液肿瘤患者使用美罗培南传统输注策略(1 g,q8h,静脉滴注0.5 h)能否获得可接受的PTA,同时考察影响美罗培南药动学参数的协变量,构建群体药动学(population pharmacokinetics,PPK)模型,以期为制定合理的美罗培南输注方案提供参考。
1 资料与方法
1.1临床资料 纳入上海交通大学医院附属第一人民医院2020年12月—2021年6月期间使用美罗培南(1 g,q8h,静脉滴注0.5 h)的血液肿瘤患者,对其进行药物浓度监测(therapeutic drug monitoring,TDM)。收集患者的人口学信息、确诊疾病类型、美罗培南用药指征、TDM当天实验室指标、美罗培南抗菌效果等指标。同时收集血液科2020年1—8月份检出致病菌情况。本研究获上海交通大学医学院附属第一人民医院人体试验伦理审查委员会批准(编号:院伦快[2018]99号)。
1.2血样采集及浓度监测 在美罗培南多次给药达到稳态浓度后,采集患者一次给药前0 h,给药后0.5,1.5,3.5,5.5 h时静脉血,进行药物浓度测定。每例患者只收集3个采血点,其中0 h及0.5 h的采血点为必采点,而1.5,3.5,5.5 h的采血点简单随机法(抽签法)采样,保证合适比例。药物浓度采用高效液相色谱法检测。
1.3PK参数及PTA计算 使用Phoenix 64版软件工具(版本8.3.3.33,创腾科技有限公司),根据稀疏采样数据,采用非线性混合效应法构建PK基础模型。再根据基础模型输出每一例患者的药时曲线数据,获得每个个体的PK参数,计算总体平均值及中位数。同时,根据患者药时曲线数据判断在不同预设靶标的情况下PK/PD靶指数的达标情况,计算PTA。
1.4PPK模型建立与验证 根据之前建立的基础模型,利用固定效应残差散点图逐一初筛协变量,协变量包括:年龄、BMI、红细胞计数、中性粒细胞计数、血红蛋白、血小板计数、肌酐清除率、白蛋白、总胆红素、乳酸脱氢酶、丙氨酸氨基转移酶及天冬氨酸氨基转移酶等。初筛剔除无明显相关性的协变量,得到较简模型。再在较简模型基础上对未剔除的协变量采用逐步回归法依次进行正向纳入及逆向剔除筛选,若正向纳入后目标函数值降低>3.841(P<0.05)予以保留进行逆向剔除,反之舍弃结束该变量筛选。逆向剔除后,模型目标函数值升高>6.635(P<0.01),表示该协变量对药动学参数具有显著意义,保留该协变量。纳入协变量建立最终模型,得到最终模型的公式及参数。模型评价采用拟合优度散点图来确定。采用可视化预测检验对模型进行验证。
2 结果
2.1患者基本资料 本研究共收集患者29例,患者人口学特征,确诊疾病类型,TDM当天实验室检查指标,美罗培南用药指征以及美罗培南实际抗感染效果等信息如表1所示。

表1 患者一般资料
2.2致病菌检出情况 本院血液科2020年1—8月份前5位检出致病菌分别为肺炎克雷伯菌(14.17%)、凝固酶阴性葡萄球菌(13.16%)、铜绿假单胞菌(10.12%)、大肠埃希菌(10.12%)、嗜麦芽窄食单胞菌(7.8%)。其中大肠埃希菌对美罗培南耐药率低,为2.8%,肺炎克雷伯杆菌和铜绿假单胞菌对美罗培南的耐药率分别达21.1%、24.1%。嗜麦芽窄食单胞菌对碳青霉烯类抗生素天然耐药。
2.3美罗培南PK参数 根据稀疏采样获得的美罗培南血药浓度,利用Phoenix 64版软件工具,计算出患者的峰浓度(Cmax)、清除率(CL)、半衰期(t1/2)、药-时曲线下面积(AUC)以及表观分布容积(Vd)等PK参数的平均值及中位数,如表2所示。
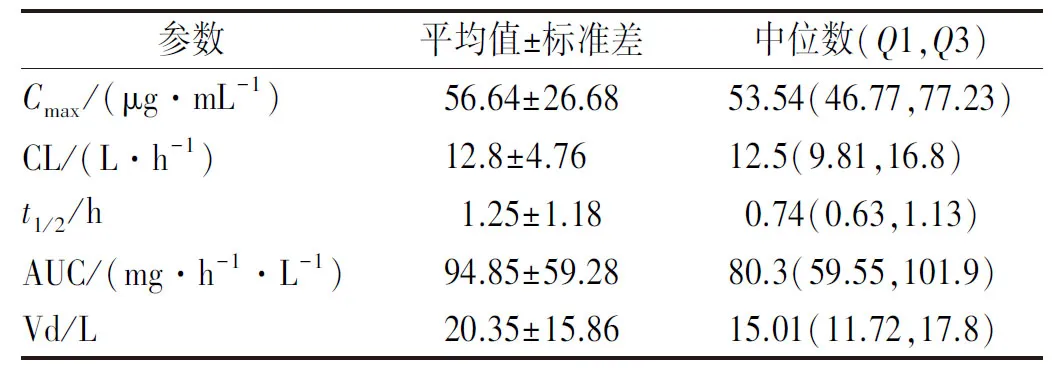
表2 美罗培南PK参数
2.4不同预设PK/PD靶标下的PTA 根据美罗培南对临床常见致病菌的敏感性折点设置不同MIC值,每个MIC值分别在不同预设PK/PD靶标下(40%fT>MIC及100%fT>MIC)的达标人数及达标概率如表3所示。由表可知只有当MIC≤1 μg·mL-1,预设PK/PD靶标为40%fT>MIC,PTA才能达到90%。
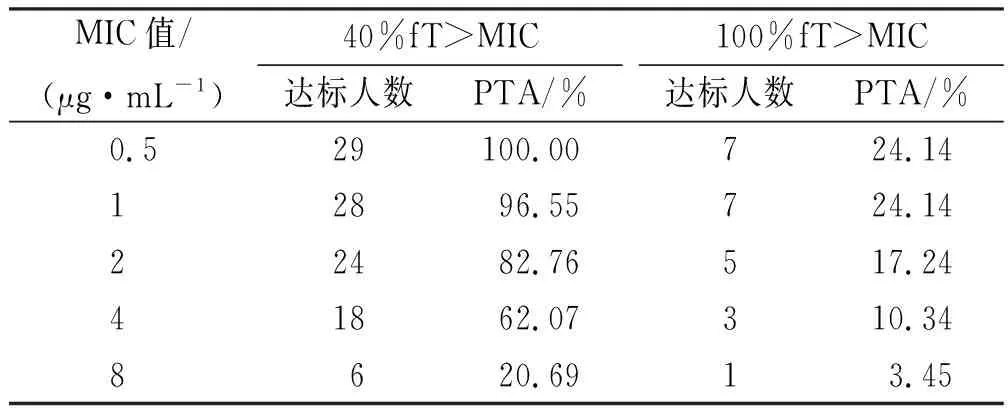
表3 美罗培南在不同预设PK/PD靶标下的PTA
2.5PPK模型的建立与验证 根据目标函数值最小原则,最终选择一室模型作为基础药动学模型,个体内残留误差模型选择加和型拟合度最佳。影响因素筛查显示血清白蛋白水平显著影响美罗培南PK参数。最终模型式为:
V=tvV*(SAB/33.98)^dVdSAB*exp(nV)
Cl=tvCl*exp(nCl)
式中V代表表观分布容积,Cl代表清除率,tvV及tvCl分别代表美罗培南V和Cl的群体典型值,SAB代表血清白蛋白浓度,SAB/33.98即对SAB进行了中心化处理,dVdSAB为协变量SAB对应的系数。n代表各药动学参数的个体间变异,其服从均值为0,方差为ω2的正态分布;其中V对应的ω2值为0.312,Cl对应的ω2值为0.242。模型参数估计值如表4所示。通过观察最终模型的个体预测值与观测值散点图(图1A),群体预测值与观测值散点图(图1B),群体预测值与观测值的条件权重残差图(图1C),时间与观测值的条件权重残差图(图1D),可以发现观测值与预测值之间有很好的线性关系,模型有较好的拟合。可视化预测检验显示:观测值5%,50%,及95%分位数均在预测值的范围内,且显示相同趋势(图2),故模型具有很好的预测能力,最终模型为有效模型。
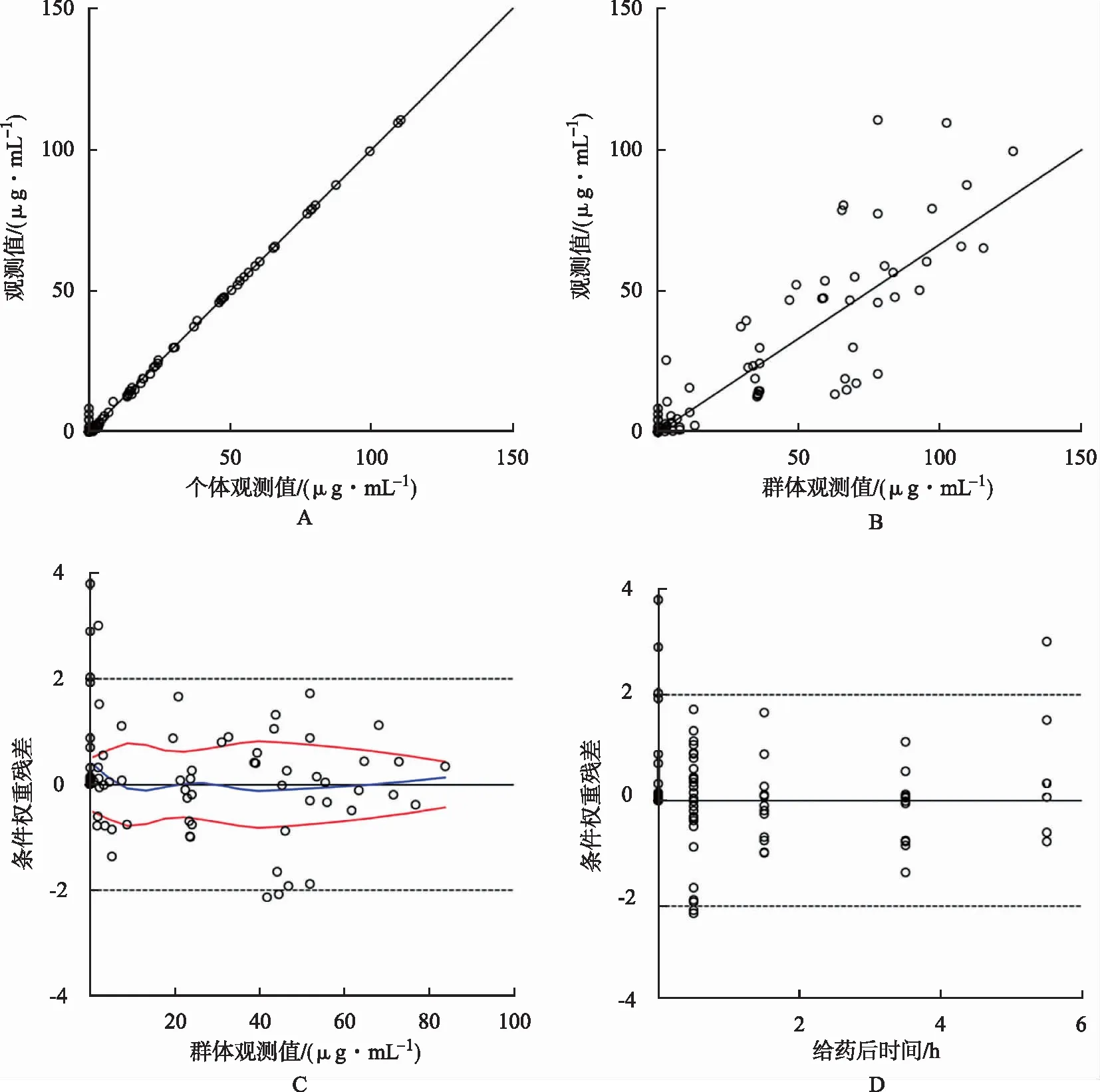
图1 最终模型拟合优度散点图
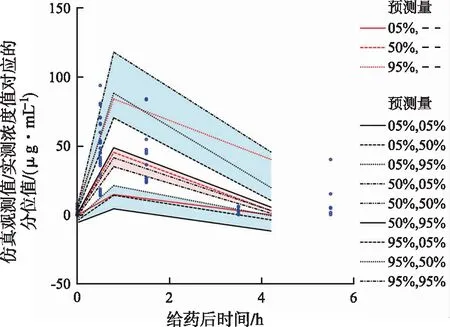
图2 最终模型可视化预测验证图
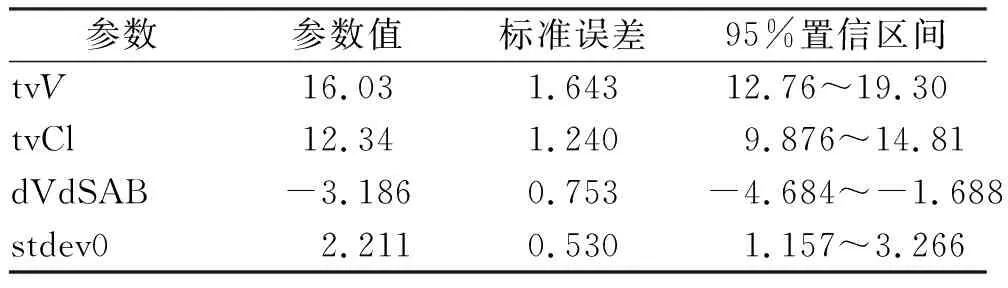
表4 最终模型参数估计值
3 讨论
本研究采用%fT>MIC作为评价指标,评价本院血液肿瘤患者给予美罗培南1 g,q8h,静脉滴注0.5 h经验性抗感染是否合理,能否达到可接受的PTA(>90%);同时考察影响美罗培南PK参数的协变量,构建PPK模型,以期为制定合理的美罗培南输注方案提供参考。结果显示:当美罗培南对目标菌属的MIC>1 μg·mL-1时,美罗培南传统输注策略(1 g,q8h,静脉滴注0.5 h)难以达到可接受的PTA,需要增加美罗培南的剂量或延长输注时间。协变量筛查显示血清白蛋白水平显著影响美罗培南的药动学参数,通过构建的PPK模型,可以优化血液肿瘤患者尤其是白蛋白水平异常患者的给药方案。
与美罗培南在健康志愿者中PK参数比较[6],本研究结果显示血液肿瘤患者t1/2及AUC平均值要偏大,CL及Vd平均值要偏小;说明书中健康受试者静脉滴注美罗培南1 g,平均Cmax为49 μg·mL-1,与本研究患者比较偏小。提示与健康受试者比较,美罗培南在血液肿瘤患者中用药可能获得的血药浓度更高,维持时间更久,抗菌作用更强。然而,本院血液肿瘤患者在美罗培南传统输注策略(1 g,q8h,静脉滴注0.5 h)下,只有当美罗培南对致病菌的MIC≤1 μg·mL-1,预设PK/PD靶标为40%fT>MIC时,PTA才能达到90%以上。事实上对于血液肿瘤患者而言,尤其是移植后早期患者,病情多为危重且存在免疫功能不全,故40%fT>MIC的预设靶标可能不足以达到美罗培南的抗菌效果。一般认为对于危重或免疫功能不全的患者,美罗培南的靶指数需要达到100%fT>MIC,甚至更高[3]。此外,参考美国临床和实验室标准协会相关检验标准与操作规范中美罗培南对临床常见致病菌的敏感性折点,我院血液科同期检出的致病菌前五名中只有两种致病菌在对美罗培南敏感的情况下其MIC≤1 μg·mL-1,总占比约25%,且这两者中肺炎克雷伯杆菌对美罗培南的耐药率高达21.1%。这些证据表明:在致病菌敏感性折点及PK/PD靶标更高的血液肿瘤患者中,我院美罗培南1 g,q8h,静脉滴注0.5 h的输注策略不能达到很好的抗菌效果,需要加大药物剂量或延长输注时间。这也与本研究中真实世界的结果相一致,即纳入的29例血液肿瘤患者使用美罗培南1 g,q8h,静脉滴注0.5 h经验性抗感染,只有约65%患者有效,在这些有效的患者中约有68%的患者还同时联用了抗革兰阳性菌药物,单用美罗培南有效率只有约20%。
协变量筛查结果显示在目标患者中血清白蛋白水平影响美罗培南的PK参数。这出乎我们的意料,因为美罗培南的蛋白结合率仅约2%[7]。理论上对于蛋白结合率高的药物,低蛋白血症可能导致结合型药物减少,游离型药物增多,从而使肝肾对游离药物的清除增加,影响其PK参数。但美罗培南蛋白结合率极低,这使得血清白蛋白的变化对游离型药物的影响微乎其微。不过最近一份研究显示,美罗培南在患者血样中的中位游离分数为62%[8],提示不同于健康志愿者,美罗培南在患者体内的蛋白结合率可能要更高。这使我们不能完全否定患者血清白蛋白变化对美罗培南肝肾清除的影响。其次,人体血浆胶体渗透压主要由白蛋白来维持,低白蛋白血症患者由于胶体渗透压降低,可导致液体漏出,药物随着体液流动会从中央室向外周室扩散,分布容积可能会增加[9],这可能是造成本研究中美罗培南PK参数改变的一个原因。并且,血清白蛋白对药物的代谢及转运也发挥重要作用[10],其水平降低可能会影响美罗培南的代谢及清除。所以,在血液肿瘤患者中,血清白蛋白水平作为可能影响美罗培南PK参数的一个指标值得关注。美罗培南主要经肾脏排泄[7]。然而,在本研究中并未发现肌酐清除率影响美罗培南的PK参数,这与文献报道不一致[4-5]。可能的原因是本研究纳入模型分析的患者肾功能均正常,不足以支撑对肌酐清除率作为影响因素的筛查。所以,虽然本研究基于非线性混合效应法成功构建了美罗培南在血液肿瘤患者中的PPK模型,且模型具有较好的预测能力和稳定性;但受限于纳入模型的样本量及患者的代表性,该模型还具有一定的局限性。
总之,该研究表明我院肿瘤患者使用美罗培南1 g,q8h,静脉滴注0.5 h的传统输注策略进行经验性抗感染治疗不能达到很好的效果,需要考虑加大药物剂量或延长输注时间。并且,美罗培南在血液肿瘤患者中的PK参数受血清白蛋白水平影响,通过本研究构建的PPK模型,可以为美罗培南个体化给药方案的制定提供有力依据。

