砂糖橘精氨酸脱羧酶CrADC基因的克隆及表达分析
吴秀兰 任诗欣 李桂花 唐文武


摘 要:【目的】克隆砂糖橘精氨酸脱羧酶基因(CrADC),分析其在干旱胁迫下的表达模式,为探究CrADC基因调控多胺合成的抗旱分子机制提供理论参考。【方法】利用RT-PCR技术克隆砂糖橘CrADC基因,采用生物信息学进行蛋白序列及进化分析,利用qPCR检测不同组织和干旱胁迫下的基因相对表达量,并进行植物表达载体构建与烟草遗传转化验证。【结果】砂糖橘CrADC基因全长2262 bp,编码753个氨基酸,含有一个吡哆醛结合域。序列及进化分析显示果树ADC蛋白序列较保守且分为3类,起源于温带的苹果、李、枣、葡萄等8种落叶果树为一个进化分支,起源于热带或亚热带的柑橘、杧果、番木瓜等6种果树属于另一分支。qPCR实验表明,CrADC基因在砂糖橘叶、花、果肉和果皮组织均能表达,但不同时期叶片和果实不同部位的表达量差异显著,干旱胁迫24 h内的基因表达量会逐步上升。转基因实验表明,CrADC基因在烟草根、茎、叶组织中也能稳定表达,转基因系比对照烟草的电导率和丙二醛含量更低,过氧化氢酶和超氧化物歧化酶活性更高,表现出更好的抗旱生理特征。【结论】砂糖橘CrADC序列较保守,起源于亚热带或热带果树的进化分支。CrADC基因具有组织表达特异性,在干旱胁迫后24 h内该基因表达量上升,使转基因系比对照烟草具有更好的抗旱生理特性。
关键词:砂糖橘;CrADC基因克隆;干旱胁迫;表达分析
中图分类号:S666.2 文献标志码:A 文章编号:1009-9980(2023)07-1318-12
Cloning and expression analysis of arginine decarboxylase gene (CrADC) from Citrus reticulata ‘Shatangju
WU Xiulan1, REN Shixin1, LI Guihua3, TANG Wenwu2*
(1College of Food and Pharmaceutical Engineering, Zhaoqing University, Zhaoqing 526061, Guangdong, China; 2College of Life Sciences, Zhaoqing University, Zhaoqing 526061, Guangdong, China; 3Vegetable Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, Guangdong, China)
Abstract: 【Objective】 Shatangju (Citrus reticulata Blanco) is one of the most widely cultivated citrus in southern China and often encounters drought stress during cultivation. Polyamines can reduce drought damage by regulating stomatal closure and promoting root development. The arginine decarboxylase as a rate-limiting enzyme in polyamine synthesis, catalyzes conversion of arginine to putrescines, which is further converted into other polyamines. Therefore, in this study, arginine decarboxylase gene (CrADC) was cloned from Shatangju and its expression pattern was examined under drought stress, in order to provide understanding of the molecular mechanism regulating polyamines synthesis in drought resistance. 【Methods】 The cDNA sequence of CrADC was obtained by reverse transcription PCR (RT-PCR). The coding sequences of CrADC was amplified from cDNA, then cloned into the vector pMD19-T and transformed into DH5α by heat shock. The DH5α was cultured overnight at 37 ℃, then DNA from the plasmid was extracted and sequenced after PCR identification. Bioinformatics tools were used to analyze the characteristics and evolutionary relationship of the CrADC protein. The quantitative real-time PCR (qPCR) was used to detect the expression level of the CrADC gene in different tissues (young leaves, old leaves, flowers, 30d fruit flesh, and 30d fruit peel) and at different times (0, 3, 6, 9, 12, 24, 36 h) after exposure to 10% PEG-6000 solution. Transgenic tobaccos were obtained by leaf disk transformation using Agrobacterium tumefaciens, and the expression level of the CrADC in the transgenic tobacco plants was detected by qPCR. Related physiological parameters, such as water loss (FL), electrolyte leakage (EL), malondialdehyde (MDA), and activities of catalase (CAT) and superoxide dismutase (SOD) were compared between transgenic lines (TL) and non-transgenic lines (CK) after drought stress. 【Results】 The cDNA sequence of the CrADC had 3076 bp including a 2262 bp open reading frame (ORF) encoding a protein with 753 amino acids. Bioinformatics analysis indicated the relative molecular weight of the CrADC protein was 80.84 ku; the theoretical isoelectric point was 5.13; the instability coefficient was 40.98; and the average hydrophilic coefficient was -0.009. The CrADC protein belongs to an unstable hydrophilic protein. There was no transmembrane domain in CrADC, and there was a pyridoxal binding domain (Orn_Arg_deC_N) between 139th and 414th amino acids. Pairwise sequence alignment of ADC protein sequences from 16 fruit trees species was performed. The results showed that the CrADC protein from Shatangju was highly similar to those of C. sinensis, C. clementina and C. trifoliata, with a sequence identity higher than 96.5%. The sequence identity was the lowest between CrADC and Musa acuminata ADC protein (62%). Phylogenetic analysis showed the amino acid sequences of ADC from the 16 fruit tree species were relatively conservative and could be divided into three clusters. Eight deciduous fruit species, such as M. domestica, Vitis riparia and Ziziphus jujuba, belonged to an evolutionary branch from temperate areas. Six fruit tree species, such as Citrus, Mangifera indica and Carica papaya, belonged to another evolutionary branch from tropical or subtropical areas. The results of qPCR showed the CrADC was expressed in leaves, flowers, fruit flesh and peel. The highest expression level of the CrADC gene was detected in fruit peel at day 30, and the lowest expression was detected in the old leaves. Furthermore, the expression level of CrADC gene in the peel at day 30 was 3.18 folds higher than that in the flesh. The expression level of CrADC in young leaves from spring was 3.41 folds higher than that in old leaves in winter. In total, the CrADC gene has expression specificity at different development stages. The expression level of CrADC gene obviously increased with the extension of drought treatment time, and the highest level was detected at 24 h and 3.82 folds higher than that at 0 h. Transgenic tobacco experiments showed that the CrADC gene was stably expressed in root, stem and leaf of transgenic tobacco. Transgenic physiological experiment showed the EL and MDA in transgenic tobacco were lower than in non-transgenic tobacco (CK), indicating that the cell membrane permeability of transgenic lines was lower than that of CK. The CAT and SOD in transgenic tobacco were higher than in CK, conferring higher ability in scavenging reactive oxidative species (ROS) to the transgenic plants. Therefore, the transgenic tobacco has greater drought resistance than CK. 【Conclusion】The amino acid sequence of CrADC is relatively conservative, and the CrADC protein belongs to the evolutionary branch from the tropical or subtropical area. The CrADC gene has expression specificity at different development stages of Shatangju, and the expression level of the CrADC increases with the extension of drought, and the transgenic tobacco has greater drought resistance than non-transgenic tobacco.
Key words: Shatangju; CrADC cloning; Drought stress; Gene expression
砂糖橘(Citrus reticulata Blanco ‘Shatangju)是我国南方地区的主栽柑橘品种,仅广东、广西种植面积就达到16.67万hm2,年产量约250万t,是华南地区山区农民增收的重要树种,在乡村产业振兴方面具有重要的经济社会价值[1]。砂糖橘主要种植于南方山地、丘陵等干旱缺水地带,干旱胁迫是影响砂糖橘生长发育、果实品质、高产稳产的重要因素,如何降低干旱对柑橘的胁迫作用是生产中亟待解决的问题[2]。柑橘抗旱品种选育及推广是防止干旱胁迫最经济有效的措施,因此揭示柑橘干旱胁迫生理机制并克隆相关抗性基因,对砂糖橘抗旱品种选育具有重要意义[3]。
多胺(polyamines,PAs)是一类具有生物活性的低分子脂肪族含氮碱,参与柑橘植物胚胎发生、根系形态建成、芽形成及植株生长、成花及开花调控、果实形成及发育、气孔闭合及气体交换、光合作用及叶绿素荧光现象等诸多生长发育和生理过程[4]。植物PAs主要以二胺的腐胺(putrescine,Put)、三胺的亚精胺(spermidine,Spd)以及四胺的精胺(spermine,Spm)形式存在。在PAs合成过程中,首先通过3种精氨酸代谢途径来合成Put,第一种途径植物会通过精氨酸脱羧酶(arginine decarboxylase,ADC)催化的精氨酸脱羧产生胍基丁胺,然后在胍基丁胺脱氨酶和N-氨基甲酰腐胺酰胺水解酶连续催化下形成Put;第二种途径是精氨酸能在ADC催化下直接合成Put,或者胍基丁胺在胍基丁胺脲水解酶作用下合成Put;第三种途径主要存在于动物和真菌中,精氨酸被线粒体中的精氨酸酶催化为鸟氨酸,然后在鸟氨酸脱羧酶作用下转变成Put。Spd、Spm合成则需要借助甲硫氨酸代谢途径,L-甲硫氨酸在S-腺苷甲硫氨酸合成酶以及脱羧酶的催化下生成脱羧S-腺苷甲硫氨酸(decarboxylated S-adenosylmethionime,dcSAM),然后在亚精胺合成酶(spermidine synthase,SPDS)催化作用下,Put接受dcSAM提供的一個氨丙基生成Spd;最后在精胺合成酶(spermine synthase,SPMS)催化下,Spd接受一个氨丙基后转变为四胺的Spm[4]。前人研究表明多胺与植物抗旱性状密切相关,Yang等[5]发现水稻能通过增强叶片的PAs生物合成来维持细胞渗透压,从而适应干旱胁迫。Shi等[6]研究报道了PAs能通过调控叶片的气孔闭合,抑制叶片水分和电解质流失,从而缓解干旱胁迫。Yao等[7-8]研究发现外喷PAs能增加黎檬(C. limonia)的根长、根系表面积、根体积和根尖数,促进根系吸水,缓解干旱胁迫。在植物PAs合成过程中,Spd、Spm是以Put为底物进一步合成,而ADC是植物通过精氨酸代谢途径合成Put的第一关键限速酶,因此克隆植物ADC基因对研究PAs合成调控及干旱胁迫生理机制具有重要意义。
目前在葡萄[9]、枳[10]、甜橙[11]、桃树[12]、杜梨[13]等果树中已分离并克隆了ADC基因,上述果树ADC基因不含内含子结构,其开放阅读框(ORF)介于2178~2262 bp之间,编码720~753个氨基酸。但关于砂糖橘CrADC的基因克隆以及表达与功能分析等研究尚未见报道。笔者在本研究中以砂糖橘为材料,成功克隆得到CrADC基因并进行生物信息学分析,通过实时荧光定量PCR检测不同组织中和干旱胁迫处理下该基因的表达量,并通过稳定遗传转化烟草对该基因进行功能验证,以期为CrADC基因参与 PAs生理调控的分子机制提供基础,并为砂糖橘抗旱分子育种提供候选基因。
1 材料和方法
1.1 试验材料
供试材料为广东地区种植的砂糖橘品种,由肇庆市四会果园提供。选择6年生砂糖橘植株并参照唐文武等[14]的方法获取春梢期嫩叶、越冬期老叶、花芽期花苞、30 d幼果果肉以及30 d幼果果皮,置于-80 ℃冰箱保存后提取总RNA,用于不同组织的基因表达分析。选用6年生砂糖橘的新发秋梢,于10% PEG-6000溶液中模拟干旱胁迫处理,处理时间分别为0、3、6、9、12、24和36 h,3次重复,每个处理所采叶片置于液氮速冻后提取总RNA,用于干旱胁迫下的CrADC基因表达特征分析。
1.2 主要试剂
柱式植物RNAout 2.0试剂盒购自北京天恩泽基因科技有限公司,M-MLV反转录试剂盒购自美国Life technology公司,TaKaRa LA Taq?酶、各种限制性内切酶、T4 DNA连接酶、凝胶回收试剂盒Gel DNA Extraction Kit Ver.4.0以及载体构建的In-Fusion? HD Cloning Kit等试剂盒均购自TaKaRa公司(日本),SYBRTM Green Ⅰ核酸荧光染料购自ThermoFisher公司,大肠杆菌DH5α感受态细胞、农杆菌GV3101感受态细胞、克隆载体pMD19-T和植物表达载体pBI121均由笔者课题实验室保存提供。主要设备仪器:ABI 7500荧光定量PCR仪(美国ThermoFisher公司)、T100 PCR仪(美国Bio-Rad公司)、GelDoc XR+凝胶成像系统(美国Bio-Rad公司)。
1.3 砂糖橘CrADC基因克隆
1.3.1 叶片总RNA提取及cDNA第一链的合成 取6年生砂糖橘果树的嫩叶,按照柱式植物RNAout试剂盒说明提取叶片总RNA,按照M-MLV反转录试剂盒操作步骤合成cDNA第一链。
1.3.2 引物序列设计及PCR扩增 根据柑橘泛基因组育种数据库(http://citrus.hzau.edu.cn)公布的甜橙(C. sinesisi)v3.0版ADC基因序列(Gene ID:Cs_ont_8g020080),设计并筛选到1对PCR引物(CrADC-F/CrADC-R),其引物序列见表1。以反转录合成的cDNA为模板扩增砂糖橘CrADC基因的cDNA序列,PCR反应体系50.0 μL,包括0.5 μL LA Taq,5.0 μL 10×PCR buffer,2 μL dNTP (2.5 mmol·L-1),CrADC-F和CrADC-R(10 μmol·L-1)各1.0 μL,2.0 μL cDNA (100 ng),加ddH2O补充至50 μL。PCR反应程序:94 ℃预变性4 min;设置30个循环,94 ℃ 30 s,55 ℃ 45 s,72 ℃ 60 s;最后72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳后,用DNA凝胶回收试剂盒回收纯化目的片段。
1.3.3 CrADC基因测序 以pMD19-T为克隆载体,将目的基因CrADC与克隆载体连接后,转化到感受态细胞DH5α中,经涂板、培养、质粒DNA提取及PCR鉴定后,送上海生工公司进行测序。
1.4 序列分析及系统进化分析
利用Prot Param进行目标基因编码的蛋白质基本理化性质预测,利用Prot Scale进行亲疏水性分析,利用SOPMA、Predict Protein预测其二级结构,利用SMART对其功能结构域进行分析,利用DNAMAN和MEGA7软件进行蛋白序列多重比较和系统进化树分析。
1.5 CrADC基因表达分析
利用qPCR检测CrADC基因在不同组织及干旱胁迫下的转录表达量,嫩叶、老叶、花、果皮、果肉等样品总RNA提取及cDNA合成参照试剂盒的方法。根据CrADC基因序列,设计并筛选了1对特异性引物(QCrADC-F/QCrADC-R,表1),以柑橘ACTB基因作为内参基因[15]。扩增反应采用SYBR Green Ⅰ染料法在ABI 7500实时定量PCR仪上进行,设置3次生物学重复,数据分析采用2-△△CT法计算[16]。
1.6 植物表达载体构建与烟草遗传转化
设计含有BamHⅠ和SacⅠ酶切位点的引物TranADC-F/TranADC-R(表1),然后PCR扩增CrADC基因。利用BamHⅠ和Sac Ⅰ双酶切pBI121空载体,采用In-Fusion? HD Cloning Kit法,将CrADC基因连接到pBI121载体,转化后经PCR及测序鉴定,获得重组pBI121-CrADC植物表达载体。制备根癌农杆菌GV3101感受态细胞并经冻融法转化重组载体,然后采用农杆菌介导的叶盘法转化烟草[17],经浸染、共培养、抗性芽筛选、生根培养及分子鉴定获得转CrADC基因烟草植株。以烟草β-actin为内参基因[18],利用实时荧光qPCR检测CrADC基因在转基因植株中的表达情况。
1.7 转基因烟草抗旱性鉴定
选取转基因烟草后代中CrADC基因表达量高的T3纯合株系,以及对照普通烟草种子。上述种子播种出苗后,移至植物培养箱在24 ℃、70%湿度、16 h光照下正常浇水种植30 d后,停止浇水20 d进行干旱胁迫处理。取转基因和对照烟草的叶片,参照李合生[19]方法测定干旱胁迫后的叶片电导率、丙二醛(MDA)含量,以及过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等抗氧化酶活性。参照Wu等[20]方法取正常生长30 d的烟草叶片称质量,然后置于25 ℃恒温培养箱中自然脱水,分别于15、30、60、90、120 min后称质量,测定自然脱水后的叶片失水率。上述试验均3次重复,利用SPSS软件进行LSD检验。
2 结果与分析
2.1 CrADC基因克隆及序列测定
以砂糖橘嫩叶总RNA反转录得到的cDNA为模板,利用CrADC-F/QCrADC-R引物扩增后得到一条约3.0 kb特异条带(图1)。该扩增条带经回收纯化后进行基因测序,结果显示,砂糖橘CrADC基因cDNA序列全长为3076 bp,含有1个2262 bp的开放阅读框(ORF),编码753个氨基酸(图2)。
2.2 CrADC蛋白序列比对
利用Prot Param分析的结果表明,CrADC蛋白相对分子质量为80.84 ku,理论等电点为5.13,不稳定系数为40.98。Prot Scale的疏水性分析表明,该蛋白第203位氨基酸疏水性最高,为2.567,第743位疏水性最低,为-2.689,平均亲水性系数为-0.009,属于不稳定亲水性蛋白。SOPMA二级结构预测显示(图3-A),该蛋白二级结构以α-螺旋和无规则卷曲为主,分别占41.30%和37.45%,β-转角仅6.61%,扩展束占14.61%。TMHMM跨膜区分析表明该蛋白不含跨膜结构域(图3-B),属于非跨膜蛋白。SMART预测显示该蛋白的139~414区域为吡哆醛结合域Orn_Arg_deC_N(图3-C),与精氨酸脱羧酶功能密切相关[21]。
为分析果树ADC基因间进化关系,从NCBI数据库中选取15种果树ADC蛋白与CrADC进行序列比对分析。双序列比对表明砂糖橘CrADC与甜橙(C. sinensis,XP_006487299.2)、克里曼丁橘(C. clementina,XP 006423501.1)、枳(C. trifoliata,AEE99192.1)的ADC蛋白序列高度相似,序列一致性超过96.5%,与香蕉(Musa acuminata,XP_009393201.1)ADC蛋白序列一致性最低(62.0%)。多序列比对(图4)显示,16种果树的ADC蛋白序列相似性较高,均包含一个完整的吡哆醛结合域Orn_Arg_deC_N,该结构域的氨基酸序列高度保守,表明果树进化过程中ADC蛋白作为关键酶促蛋白,氨基酸序列较保守。
2.3 CrADC蛋白进化分析
系统进化分析(图5)显示,16种果树的ADC蛋白聚为三类。其中芸香科柑橘属的甜橙、克里曼丁橘、枳、砂糖橘,以及杧果(Mangifera indica,XP_044488993.1)、番木瓜(Carica papaya,XP_021889268.1)6种果树ADC蛋白聚为一类,是主要起源于亚热带或热带地区的果树,处于同一进化分支。蔷薇科的甜樱桃(Prunus avium,XP_021806331.1)、桃(Prunus persica,XP_007200307.1)、李(Prunus dulcis,XP_034226752.1)、苹果(Malus domestica,XP_008358425.2),以及葡萄科的葡萄(Vitis riparia,XP_034681234.1)、鼠李科的枣(Ziziphus jujuba,XP_015892431.2)等果树ADC蛋白聚为一类,是主要起源于温带地区的落叶型果树,处于同一進化分支。芭蕉科的香蕉(Musa acuminata,XP_009393201.1)与杜鹃花科的蓝莓(Vaccinium darrowii,KAH7835244.1)与其他ADC蛋白差异较大,被聚为一类。
2.4 砂糖橘CrADC基因表达分析
对砂糖橘不同组织CrADC基因的qPCR结果(图6)显示,CrADC基因在砂糖橘春梢期嫩叶、越冬期老叶、花、30 d幼果果皮和30 d幼果果肉等组织中均有表达,且除嫩叶与花外,其他组织间基因表达差异均达到显著水平。以30 d幼果果皮的表达量最高,其次是嫩叶和花,老叶中基因表达量最低。进一步比较发现,30 d幼果果皮表达量是果肉的3.18倍,春梢期嫩叶表达量是越冬期老叶的3.41倍,表明CrADC基因在叶片生长的不同时期,以及果实不同部位的基因表达量具有显著差异,表现出基因表达的时空特异性,这可能与CrADC基因参与的生理调控功能或多胺区域化分布差异有关。
为研究CrADC基因在干旱胁迫时的表达特征,利用10%的PEG-6000溶液来模拟干旱胁迫环境。剪取6年生新发秋梢进行干旱胁迫处理,并于3、6、9、12、24、36 h提取叶片总RNA进行相对定量qPCR分析,以0 h为对照。试验结果(图7)显示,随着干旱胁迫时间的延长,CrADC基因表达量也相应上升,并在处理24 h时达到最高,其表达量是0 h对照的3.82倍。当干旱胁迫继续延长后,其基因表达量开始下降,处理36 h时表达量仅为最高24 h时的59.5%。该结果表明,砂糖橘在干旱胁迫24 h内,可显著提高CrADC基因的表达量,推测该基因的高表达将促进腐胺等PAs的合成来适应干旱胁迫,上述推测还有待于进一步试验验证。
2.5 CrADC基因转化烟草研究
将含有pBI121-CrADC重组质粒的农杆菌GV3101,通过叶盘法转化烟草,经Kan抗性筛选后获得25个转基因抗性植株。利用扩增片段包括载体与目的基因序列的特异性引物TranPCR-F/TranPCR-R进行PCR检测,结果发现18株转基因抗性植株中检测到特异性条带(图8),表明CrADC基因已整合到烟草基因组中。
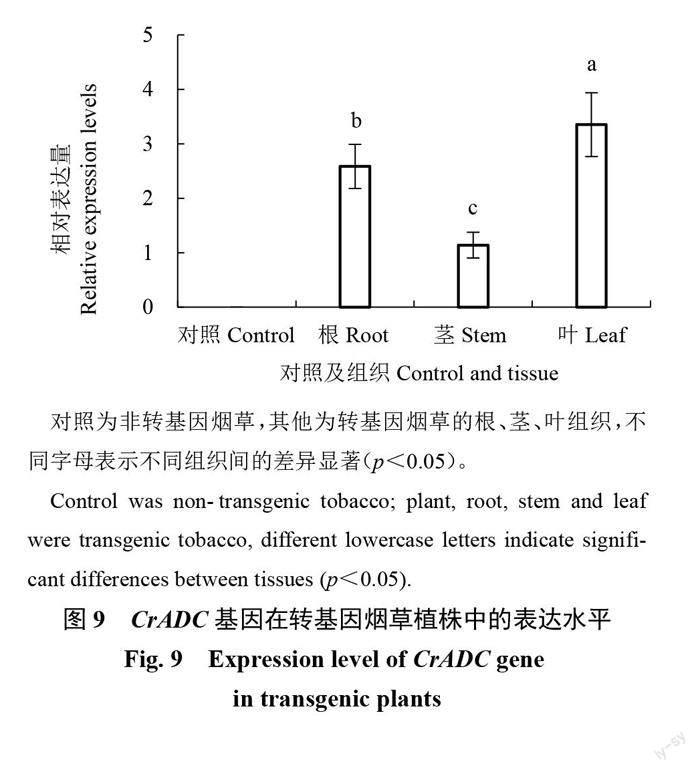
为了检测CrADC基因在转基因烟草中的表达情况,分别提取转基因烟草和对照非转基因烟草的根、茎、叶组织总RNA,经反转录cDNA后进行qPCR实验,以烟草actin为内参基因。结果显示(图9),CrADC基因在转基因烟草的根、茎、叶组织中均能表达,以烟草嫩叶中表达量最高,其次为根系,茎组织表达量最低,而非转基因对照的组织中未检测到该基因表达水平。
2.6 转基因烟草抗旱性分析
对上述转基因T0代植株,进行续代、筛选鉴定后获得一批T3代纯合株系。对T3代纯合株系进行表达分析,筛选出1个CrADC基因表达量最高的株系11-2a开展抗旱性分析。选取该转基因株系和对照烟草正常生长30 d后,剪取叶片进行自然脱水处理后,并于不同时间段取样测定失水率,结果见图10。由图10可知,在120 min内转基因系的失水率在不同时间段都低于对照普通烟草。该结果表明CrADC基因在烟草中超表达后,表现出明显的抗脱水性。
进一步对转基因系和对照烟草进行20 d的干旱胁迫处理,并分别测定衡量细胞膜通透性的电导率、丙二醛含量指标,以及清除过氧化氢、活性氧的抗氧化酶活性,相关结果见图11。由图11-A~B可知,转基因系的电导率和丙二醛含量均低于对照普通烟草,两者间差异分别达到显著和极显著水平,表明超表达CrADC的转基因系能降低叶片细胞膜通透性,从而表现出较高的抗旱性。由图11-C~D可知,转基因系的CAT酶和SOD酶活性均高于对照烟草,两者间差异均达到极显著水平,表明在干旱胁迫后,转基因系提高了叶片的抗氧化酶活性,更能有效清除体内活性氧,避免转基因植株的生理损伤,从而表现较强的抗旱性。
3 讨 论
PAs是生物体普遍存在的一类低分子脂肪族含氮碱,在柑橘属植物的细胞分化、根系建成、成花过程、果实发育、气孔调节和气体交换等生理代谢活动中发挥重要作用[4]。ADC作为PAs生物合成途径中的第一个关键限速酶,能通过调控PAs合成速率来调节植物代谢活动,降低逆境胁迫对植物生长的不利影响[22]。目前在柑橘属PAs合成途径的相关基因中,仅报道了甜橙(C. sinensis)CsSAMDC [23]、砂糖橘CsSAMDC [14],以及枳(C. trifoliata)PtADC [10]的基因克隆相关研究,柑橘属广泛栽培的其他柑、橘、橙、柚等物种的ADC基因克隆及相关功能研究尚未报道。本研究克隆了砂糖橘CrADC基因,與Wang等[10]报道的枳PtADC(AEE99192.1)的氨基酸序列一致性为96.5%,均含有一个序列高度保守的吡哆醛结合域Orn_Arg_deC_N(PF02784),与精氨酸脱羧酶功能密切相关[21]。对16种果树ADC蛋白进化分析显示,起源于温带的苹果、李、枣、葡萄等8种落叶果树为一个进化分支,起源于热带或亚热带的柑橘、杧果、番木瓜等6种果树属于另一分支。表明在果树进化过程中ADC蛋白作为关键酶促蛋白,氨基酸序列较为保守。
前人研究发现,果树ADC基因在植物根、茎、叶、果实等多个组织中均能表达,在杜梨的叶片中表达量最高,而在枳的果皮中表达量最高,在一定脱水时间内果树ADC基因相对表达量会上升[10,13]。本研究CrADC基因在砂糖橘的叶、花、果等组织中均有表达,以30 d幼果果皮的表达量最高。在干旱胁迫的24 h内,CrADC基因表达量随时间延长也相应稳步上升,与枳[10]、桃树[12]、杜梨[13]等果树在脱水环境下的ADC基因表达特征基本相似。Miller等[24]报道干旱胁迫会诱导植株体内活性氧积累,从而造成细胞膜损伤。PAs作为渗透调节剂具有保护酶活性和降低丙二醛含量,清除体内活性氧自由基,增强植物的抗干旱胁迫能力的功能[25]。Shi等[6]和Zhang等[26]研究发现干旱或脱水会导致植物叶片气孔保卫细胞中的PAs浓度上升,而天然PAs会强烈抑制气孔开放、诱导气孔关闭,植物气孔关闭能减少水分蒸发及电解质流失,从而保持植株在干旱环境下正常生长。在根系建成中,PAs能充当细胞增殖分化等激素的第二信使,通过控制生长素/细胞分裂素的比率,从而诱导根系发育[27]。Yao等[7-8]发现外施PAs能增加黎檬(C. limonia)的根长、根系表面积、根体积和根尖数,增强根系吸水能力,缓解干旱胁迫。本研究中,筛选出的转CrADC基因烟草在自然脱水处理后,其叶片相较于对照烟草表现出明显的抗脱水性。在20 d干旱胁迫后,转基因系的电导率、丙二醛含量均低于对照,表现出更低的细胞膜通透性;其CAT酶、SOD酶活性均高于对照,表现强抗氧化酶活性从而避免细胞膜损伤,表现出更好的植株抗旱性。通过基因表达水平和转基因烟草功能分析,笔者推测柑橘在干旱胁迫的诱导下,CrADC基因高表达后促进腐胺等PAs合成,PAs可调节细胞内渗透物质含量,增强吸水性,同时PAs具有保护抗氧化酶活性,清除活性氧而减轻膜脂过氧化程度。高浓度PAs能导致叶片保卫细胞控制气孔关闭,同时PAs作为第二信使促进根系发育而增强吸水能力,从而缓解干旱胁迫对植物生长的不利影响。上述假设还有待于SPMS、SPDS等PAs合成途径基因的克隆及表达特征分析,并继续开展干旱胁迫下砂糖橘内源PAs浓度和气孔闭合、根系生长发育等表型的关联性分析,从而为探究CrADC等基因通过调控PAs合成代谢,抵御干旱等非生物胁迫的生理机制提供分子生物学证据。
4 結 论
克隆了砂糖橘CrADC基因,其全长2262 bp,编码753个氨基酸,属起源于亚热带或热带果树的进化分支。CrADC基因在砂糖橘叶、花、果等组织中均能表达,但不同时期叶片和果实不同部位的表达量均有显著差异,在干旱胁迫24 h内基因表达量随时间延长而逐步上升,转基因系比对照烟草有更好的抗旱生理特性。
参考文献 References:
[1] 区善汉,莫健生,张社南. 广西沙糖橘产业发展存在的问题与对策[J]. 南方园艺,2014,25(5):28-30.
OU Shanhan,MO Jiansheng,ZHANG Shenan. Problems and countermeasures in the development of Guangxi sugar orange industry[J]. Southern Horticulture,2014,25(5):28-30.
[2] 李果果,陈香玲,秦荣耀,刘要鑫,赵小龙,孙宁静,欧智涛,唐志鹏,张广珍. 大果沙糖橘的遗传鉴定及引种栽培表现[J]. 南方农业学报,2018,49(6):1171-1176.
LI Guoguo,CHEN Xiangling,QIN Rongyao,LIU Yaoxin,ZHAO Xiaolong,SUN Ningjing,OU Zhitao,TANG Zhipeng,ZHANG Guangzhen. Genetic identification and cultivation performance of introduced Daguo shatangju[J]. Journal of Southern Agriculture,2018,49(6):1171-1176.
[3] 龚成宇,王毅,宋海岩,杨科,陶海青,刘俊宏,龚荣高. 干旱胁迫对黄果柑果实品质及糖酸代谢酶活性的影响[J]. 西南农业学报,2021,34(2):272-278.
GONG Chengyu,WANG Yi,SONG Haiyan,YANG Ke,TAO Haiqing,LIU Junhong,GONG Ronggao. Effects of drought stress on fruit quality and enzyme activity of glycolic acid metabolism in Huangguogan fruit[J]. Southwest China Journal of Agricultural Sciences,2021,34(2):272-278.
[4] KILLINY N,NEHELA Y. Citruspolyamines:structure,biosynthesis,and physiological functions[J]. Plants,2020,9(4):426.
[5] YANG J C,ZHANG J H,LIU K,WANG Z Q,LIU L J. Involvement of polyamines in the drought resistance of rice[J]. Journal of Experimental Botany,2007,58(6):1545-1555.
[6] SHI J,FU X Z,PENG T,HUANG X S,FAN Q J,LIU J H. Spermine pretreatment confers dehydration tolerance of citrus in vitro plants via modulation of antioxidative capacity and stomatal response[J]. Tree Physiology,2010,30(7):914-922.
[7] YAO Q,WANG L R,CHEN J Z,ZHU H H. The effects of polyamines on root morphology and arbuscular mycorrhiza of citrus seedlings[J]. Acta Horticulturae,2008,774:151-158.
[8] YAO Q,WANG L R,XING Q X,CHEN J Z,ZHU H H. Exogenous polyamines influence root morphogenesis and arbuscular mycorrhizal development of Citrus limonia seedlings[J]. Plant Growth Regulation,2010,60(1):27-33.
[9] PRIMIKIRIOS N I,ROUBELAKIS-ANGELAKIS K A. Cloning and expression of an arginine decarboxylase cDNA from Vitis vinifera L. cell-suspension cultures[J]. Planta,1999,208(4):574-582.
[10] WANG J,SUN P P,CHEN C L,WANG Y,FU X Z,LIU J H. An arginine decarboxylase gene PtADC from Poncirus trifoliata confers abiotic stress tolerance and promotes primary root growth in Arabidopsis[J]. Journal of Experimental Botany,2011,62(8):2899-2914.
[11] 吴昊. 柑橘转录因子CsCBF1和PtrNAC72在调控精氨酸脱羧酶基因表达及抗逆中的功能鉴定[D]. 武汉:华中农业大学,2017.
WU Hao. Functional characterization of Citrus sinensis CBF1 and Poncirus trifoliata NAC72 in regulation ofarginine decarboxylase gene expression and stress tolerance[D]. Wuhan:Huazhong Agricultural University,2017.
[12] 王保全,张晓娜,刘继红,李国怀. 桃树PpADC基因克隆及逆境胁迫表达分析[J]. 西南师范大学学报(自然科学版),2020,45(7):34-41.
WANG Baoquan,ZHANGXiaona,LIU Jihong,LI Guohuai. Cloning and abiotic stress-induced expression of the arginine decarboxylase gene from Prunus persica[J]. Journal of Southwest China Normal University (Natural Science Edition),2020,45(7):34-41.
[13] 靳丛,郭巧会,陈国栋,孙小川,孙敏,周瑾,王纪忠,黄小三. 杜梨精氨酸脱羧酶基因PbADC的克隆与表达分析[J]. 核农学报,2021,35(2):306-313.
JIN Cong,GUO Qiaohui,CHEN Guodong,SUN Xiaochuan,SUN Min,ZHOU Jin,WANG Jizhong,HUANG Xiaosan. Cloning and expression analysis of PbADC in Pyrus betulifolia[J]. Journal of Nuclear Agricultural Sciences,2021,35(2):306-313.
[14] 唐文武,吴秀兰. 沙糖橘S-腺苷甲硫氨酸脱羧酶基因克隆及表达分析[J]. 南方农业学报,2020,51(6):1369-1376.
TANG Wenwu,WU Xiulan. Cloning and expression analysis of S-adenosylmethionine decarboxylase gene (CrSAMDC) in Shatangju[J]. Journal of Southern Agriculture,2020,51(6):1369-1376.
[15] WU X, QIN Y H, HU G B.Cloning and expression analysis of self-incompatibility S1 family protein gene in Citrus reticulata Blanco cv. Wuzishatangju[J]. Research Journal of Biotechnology, 2015, 10(7): 19-25.
[16] LIVAK K J,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J]. Methods,2001,25(4):402-408.
[17] HORSCH R B,FRY J E,HOFFMANN N L,EICHHOLTZ D,ROGERS S G,FRALEY R T. A simple and general method for transferring genes into plants[J]. Science,1985,227(4691):1229-1231.
[18] FAIZE M,FAIZE L,BURGOS L. Using quantitative real-time PCR to detect chimeras in transgenic tobacco and apricot and to monitor their dissociation[J]. BMC Biotechnology,2010,10:53.
[19] 李合生. 植物生理生化實验原理和技术[M]. 北京:高等教育出版社,2000.
LI Hesheng. Principles and techniques of plant physiological biochemical experiment[M]. Beijing:Higher Education Press,2000.
[20] WU H,FU B,SUN P P,XIAO C,LIU J H. A NAC transcription factor represses putrescine biosynthesis and affects drought tolerance[J]. Plant Physiology,2016,172(3):1532-1547.
[21] MEHTA P K,CHRISTEN P. The molecular evolution of pyridoxal-5-phosphate-dependent enzymes[J]. Advances in Enzymology and Related Areas of Molecular Biology,2000,74:129-184.
[22] WI S J,KIM S J,KIM W T,PARK K Y. Constitutive S-adenosylmethionine decarboxylase gene expression increases drought tolerance through inhibition of reactive oxygen species accumulation in Arabidopsis[J]. Planta,2014,239(5):979-988.
[23] WANG J,LIU J H,KUROSAWA T,NADA K,BAN Y,MORIGUCHI T. Cloning,biochemical identification,and expression analysis of a gene encoding S-adenosylmethionine decarboxylase in navel orange (Citrus sinensis Osbeck)[J]. The Journal of Horticultural Science and Biotechnology,2010,85(3):219-226.
[24] MILLER G,SUZUKI N,CIFTCI-YILMAZ S,MITTLER R. Reactive oxygen species homeostasis and signalling during drought and salinity stresses[J]. Plant,Cell & Environment,2010,33(4):453-467.
[25] 李霞,程運河,马晓东,韩蕾,孙振元. 多胺在植物抗逆中的生理机制[J]. 世界林业研究,2018,31(4):23-28.
LI Xia,CHENG Yunhe,MA Xiaodong,HAN Lei,SUN Zhenyuan. Physiological mechanism of polyamines in plant resistance[J]. World Forestry Research,2018,31(4):23-28.
[26] ZHANG Q H,WANG M,HU J B,WANG W,FU X Z,LIU J H. PtrABF of Poncirus trifoliata functions in dehydration tolerance by reducing stomatal density and maintaining reactive oxygen species homeostasis[J]. Journal of Experimental Botany,2015,66(19):5911-5927.
[27] CUI X,GE C M,WANG R X,WANG H Z,CHEN W Q,FU Z M,JIANG X N,LI J Y,WANG Y H. The BUD2 mutation affects plant architecture through altering cytokinin and auxin responses in Arabidopsis[J]. Cell Research,2010,20(5):576-586.

