同时测定大鼠体内甘草次酸和丹参酮分析方法的构建
何彦晓 ,张东萍 ,吴福鸿 ,蒋晶搁 ,袁玥 ,蒲晓辉✉
1宁夏康亚药业股份有限公司,宁夏 银川 750002;2 银川市第一人民医院,宁夏 银川 750002;3 河南大学药学院,河南 开封475004
甘草次酸(glycyrrhetinic acid,GA)是甘草的主要有效成分甘草酸及其盐(即甘草甜素)的代谢产物。甘草次酸具有重要的药理活性,它不仅有消炎美容之功效,而且具有抗肿瘤、抗炎、抗病毒、免疫调节、保护肝细胞、抗氧化及肾上腺皮质激素样作用,具有明显增强肝肾的解毒功能和脑保护作用[1],可治疗肾上腺皮质机能衰退、胃溃疡及十二指肠溃疡等。更重要的是其可以增强机体免疫力,有效地控制艾滋病毒感染者病情的发展,其衍生物还具有抗肿瘤的活性[2-3]。
丹参酮(tanshinone,TAN)脂溶性成分在生物体内广泛分布,具有较强的药理活性,而每一种丹参酮有其特定的生理活性[4]。丹参酮具有保护心血管的作用,包括抗动脉粥样硬化、改善微循环和提高血流量水平、抗凝和抗血小板聚集、减小心肌梗死面积、保护血管内皮细胞。丹参酮具有免疫和调节内分泌、保护脑神经、护肝、改善微循环、抑制血小板聚集、增加肾脏的血供、减缓肾脏损害等方面均有重要作用。清除氧自由基、抑制炎症细胞增殖、杀伤肿瘤细胞及抑制血管平滑肌细胞增殖等作用,丹参酮还可以消除机体氧化反应所形成的毒素,降低患者肾脏的负荷;具有扩张血管、改变微循环、降低血小板聚集的作用。可改善骨折后引起的血运不通,为骨折愈合创造良好的局部环境[5]。
甘草和丹参同时使用较为常见。丹参联合甘草酸用药后,抗肝纤维化临床效果优于单用丹参或甘草酸[6]。已有相关文献[7-14]报道,采用HPLC 法或LC-MS/MS法分别进行甘草次酸和丹参酮的含量测定方法,但采用同一种方法同时测定体内甘草次酸和丹参酮的含量却鲜少报道。
本研究发现,采用HPLC双波长法可以同时测定体内的甘草次酸和丹参酮的含量,该分析方法准确、重复性好、精密度高,为后续相关甘草次酸和丹参酮复方产品的体内质量控制和药代动力学研究提供了方法学基础。
1 材料
1.1 仪器
米欧Miulab MIX-28+圆周振荡器(北京乾明基因技术有限公司);JT-1027HT 超声波清洗器(中国玉环曙峰企业制造);TDZ5-BP离心机(上海安亭科学仪器厂);BSA224S分析天平(赛多利斯科学仪器北京有限公司)
1.2 药品与试剂
色谱甲醇(天津市科密欧化学试剂有限公司,批号:20200106);二甲基亚砜(DMSO)(天津市德恩化学试剂有限公司,批号:20191005);肝素钠(国药准字H12020505,天津生物化学制药有限公司);大黄酸(Re)(南京景竹生物科技有限公司,批号:JZ18041301);0.9%氯化钠注射液(山东齐都药业有限公司,国药准字H37020766)
1.3 实验动物
SPF级雄性SD大鼠36只,体重200±20 g,济南朋悦实验动物繁育有限公司(实验动物质量合格证号:No.37072610100 113618;实验动物许可证:SYXK(鲁)20 190003;动物饲料生产许可证号:豫饲证(2008)25540;所有动物实验均经过河南大学动物实验伦理委员会批准同意,许可证号:HUSOM-2017-236)。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Symmetry C18色谱柱(250 mm×4.6 mm,5μm);流动相:甲醇-磷酸缓冲液(pH=3)(85∶15);检测波长:250 nm(GA)、270 nm(TAN);柱温:30℃;流速:1.0 mL/min;进样量:10μL。
2.2 溶液的配制
2.2.1 标准溶液的配制
精密称取GA 标准品10 mg,TAN 标准品2.5 mg共同置于50 mL 容量瓶中,用少量色谱甲醇使溶解后,定容至刻度线,摇匀,即得对照品贮备液(GA:200μg/ mL、TAN:50μg/ mL),然后将储备液用甲醇稀释成系列浓度即 TAN 的浓度为0.390 625、0.781 25、1.562 5、3.125、6.25、12.5、25 μg/ mL,GA 的浓度为1.562 5、3.125、6.25、12.5、25、50、100μg/ mL的系列标准溶液。
2.2.2 内标溶液的配制
精密称取内标物Re 2.5 mg置于100 mL 容量瓶中,用色谱甲醇溶解并稀释至刻度线,摇匀得到内标储备液浓度为25μg/ mL,然后用吸量管精密移取内标储备液1.25 mL至10 mL容量瓶中,用色谱甲醇溶解并稀释定容至刻度线,得到浓度为3.125 μg/ mL的内标溶液。
2.2.3 体内样品的处理
取大鼠血浆100μL 置于1.5 mL 离心管中,加入100μL内标溶液,涡旋混匀。然后加入400μL色谱甲醇后置于振荡器上涡旋5 min,离心取上清液,弃去底部沉淀的蛋白。按照2.1项下色谱条件进样分析。
2.2.4 专属性实验
取大鼠的空白血浆、空白血浆加标准溶液和静脉注射后大鼠血浆按照2.2.3项下处理并按照2.1项下色谱条件进样分析,另取标准品溶液加内标溶液按2.1项下色谱条件进样并记录色谱图。
2.2.5 标准曲线的建立
取新鲜的大鼠空白血浆100μL 置于1.5 mL EP管中,分别加入2.2.1项下配置的一系列标准溶液后,按照2.2.3项下处理样品,使得相应的血浆中的TAN的浓度为0.078 125、0.156 25、0.312 5、0.625、1.25、2.5、5μg/ mL,GA 的浓度为0.3125、0.625、1.25、2.5、5、10、20μg/ mL,按照2.1 项下的色谱条件进样,记录相应的峰面积。以进样的待测药物浓度(X)为横坐标,以待测药物峰面积AR与内标物质Re的色谱峰面积AS的比值为纵坐标进行线性回归,分别得到GA 和TAN 体内含量测定的线性回归方程。
2.2.6 精密度实验
取大鼠空白血浆100μL 按照2.2.4项下操作,配制高、中、低的混合标准溶液,即最终血浆中TAN的浓度为0.156 25、0.625、2.5μg/ mL,GA 的浓度为0.625、2.5、10μg/ mL,每个样品平行6份。分别在日内及日间对其重复测定,考察精密度,然后记录所测得的色谱峰面积,并通过2.2.4项下所得的线性方程计算出其日内和日间的RSD 值。
2.2.7 提取回收率实验
取生理盐水100μL代替大鼠空白血浆,同样按照2.2.4项下操作,配制高、中、低三种混合标准溶液,每个样品平行6份。将配置好的溶液注入高效液相色谱仪中记录色谱峰面积,计算方法的提取回收率。
2.2.8 体内样品的采集
将大鼠随机分为6组分别是TAN 游离药组、GA游离药组、TAN/MD组、GA/MD 组、TAN/GA/MD 组和TAN/GA/DCA 组。给药剂量为15 mg/kg(参考丹参酮IIA 磺酸钠注射液和甘草酸二铵注射液)。大鼠静脉注射完成时开始计时,分别于0.83、0.25、0.5、1、2、4、6、8、10、12 h的时间点眼眶取血约500μL。然后将取得的血液样品置于经肝素钠浸润过的离心管中,离心取上清液得到新鲜的大鼠含药血浆。按照2.2.3项下处理样品,然后按照2.2.1项下色谱条件进样分析。
2.3 结果与讨论
2.3.1 体内样品含量测定方法的建立与考察
空白血浆、空白血浆加标品以及给药后的血浆样品的HPLC 图见图1。a、b、c分别为内标Re、TAN和GA的色谱峰。
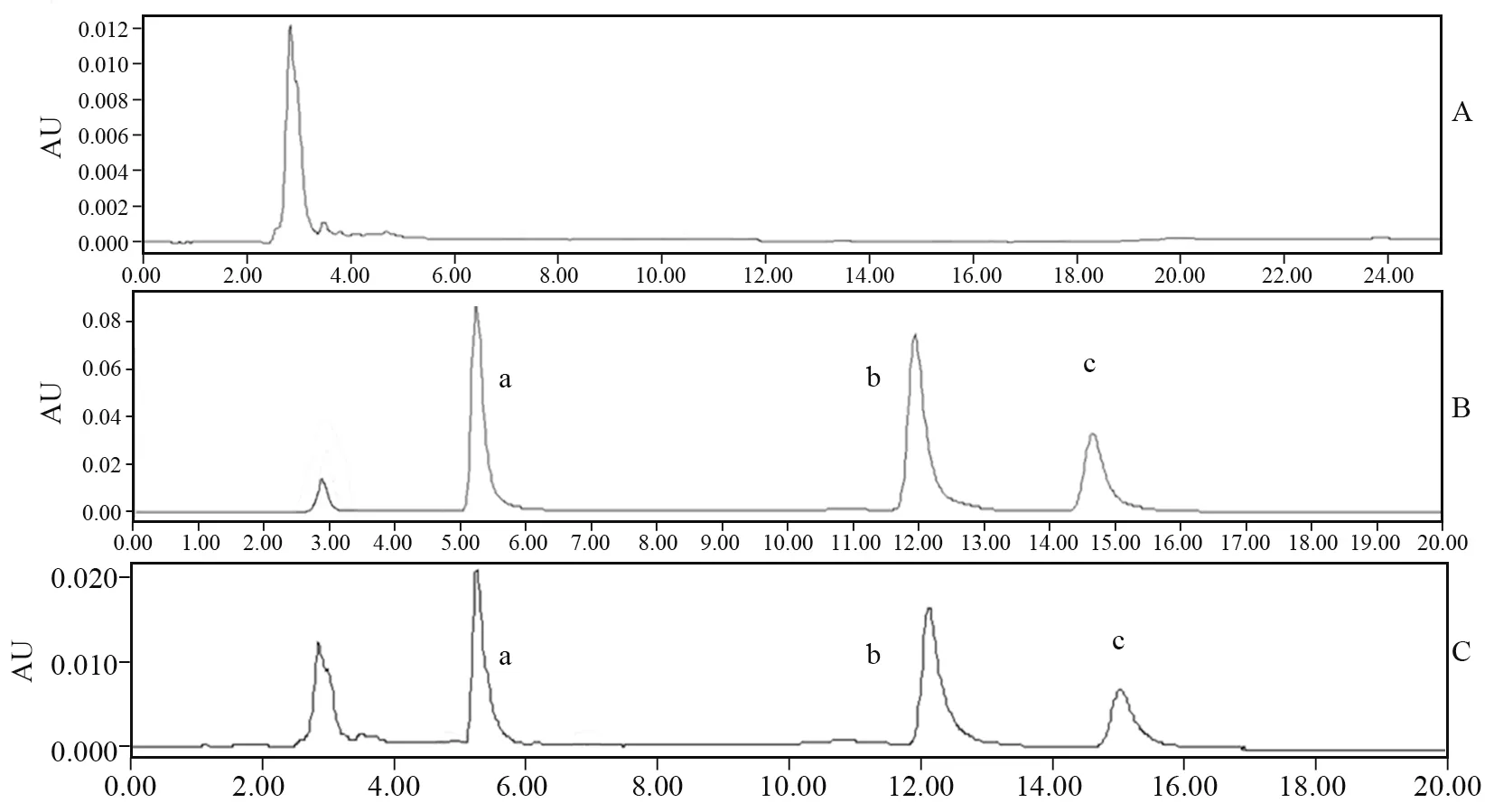
图1 空白血浆HPLC图(A);空白血浆+标准品HPLC图(B);给药后血浆样品HPLC(C)
由图1可知,空白血浆中的内源性物质并不干扰TAN 和GA 的含量测定,且内标Re的保留时间为5.532 min与TAN 和GA 分离较好,表明测定方法具有很好的专属性。
2.3.2 标准曲线
纵坐标为待测峰面积与内标峰面积的比值,横坐标X 代表不同浓度,对浓度X 进行线性回归。最终能够得出TAN 的线性回归方程为:Y=2.237 7X-0.022 2(R2=0.999 6),线性范围为0.078 125 μg/ mL~5μg/ mL;GA 的线性回归方程为:Y=0.430 7X-0.002 6(R2=0.999 8),线性范围为0.312 5μg/ mL~20μg/ mL,见图2。

图2 TAN标准曲线(A);GA标准曲线(B)
研究结果表明,样品的日内及日间精密度均小于3.51%,说明方法精密度良好,符合规定。
2.3.3 精密度考察结果
精密度考察结果见表1。

表1 精密度考察结果(n=6)
研究结果表明,低、中、高三种浓度的提取回收率在95.20~103.43%之间,RSD 值均小于4.93%,符合规定。
2.3.4 提取回收率考察结果
提取回收率考察结果,见表2。
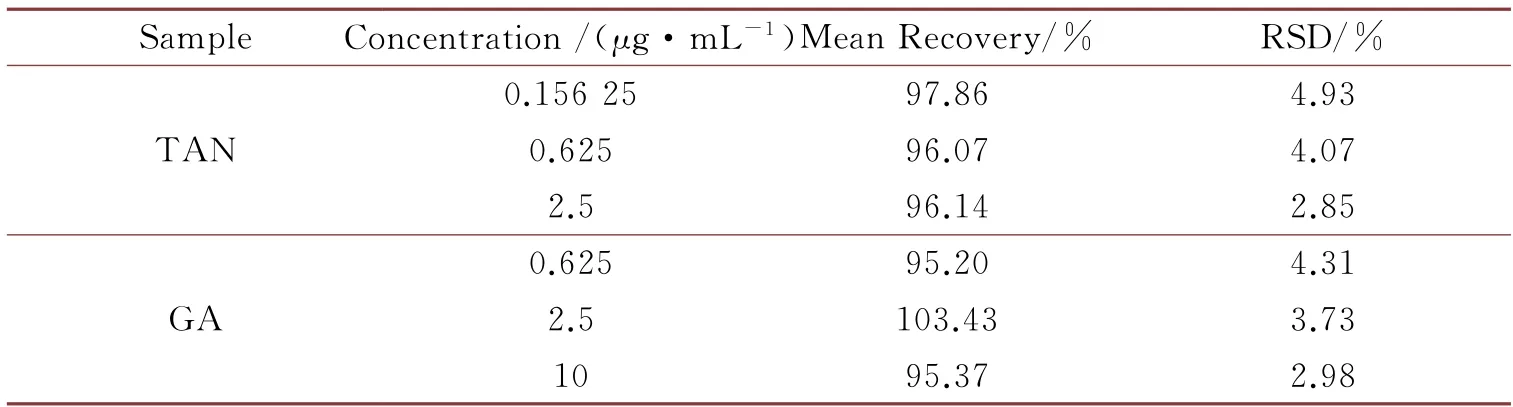
表2 提取回收率结果(n=6)
研究结果表明,在线性范围内GA 和TAN 的色谱峰面积与浓度具有良好的线性关系。
2.4 讨论
本研究通过采用C18色谱柱,以波长250 nm 和270 nm 分别进行甘草次酸和丹参酮的测定。在该色谱试验条件下,血浆中的甘草次酸和丹参酮均能与其他成分达到基线分离,且呈现良好的线性关系。本方法操作简单、灵敏度高,能同时准确对大鼠血浆中的甘草次酸和丹参酮的质量浓度进行测定,从而可实现体内甘草次酸和丹参酮药代动力学的变化监测,此方法适用于相关甘草次酸和丹参酮复方产品的药动学评价。

