桑芪益气养阴方对胰岛素抵抗大鼠肝脏ACC1/FASN/SCD1信号通路及GLUT2的影响
李丽 刘佳琪 冯颖童 扈觐玺 姜斯佳 高晶 贾岚 王景霞
胰岛素抵抗是2型糖尿病的重要发病机制,并贯穿疾病全程。肝脏是胰岛素作用的重要靶器官,其对胰岛素的低敏感性是推动2型糖尿病发展的关键环节[1]。正常生理状态下,胰岛素能调节肝脏中糖原、脂类、蛋白质等生物大分子的合成,抑制糖异生,维持血糖稳态[2];胰岛素抵抗状态下肝脏糖异生抑制受损,而脂肪合成仍保持较高水平,表现为肝脏脂肪酸和甘油三酯水平升高[3]。肝脏内脂质积累造成肝脏氧化应激和功能受损,进一步加重胰岛素抵抗,因此,缓解肝脏胰岛素抵抗为防治2型糖尿病的重点。
中医学以整体观、辨证论治理念为指导,在糖尿病等慢性病防治方面独具优势。就中医而言,2型糖尿病当以消渴论治,其病机演变常遵循“阴虚-气阴两虚-阴阳两虚”这一规律,而气阴两虚是贯穿全病程的根本病机,也是病理转机的关键,故益气养阴法当为消渴病治疗的基本大法[4]。桑芪益气养阴方为结合中医辨证理论及临床经验,由黄芪、桑叶、玉竹、葛根、蜂胶粉组合而成,用于气阴两虚证消渴患者。前期课题组实验研究表明[5],该方除改善气阴两虚型糖尿病大鼠的证候表征外,还可使模型大鼠的空腹血糖和胰岛素抵抗指数显著降低,使空腹胰岛素、胰岛素敏感指数、胰岛β细胞功能指数显著升高,在改善高血糖大鼠糖脂代谢紊乱及胰岛素抵抗方面疗效显著。
本研究进一步探究桑芪益气养阴方对胰岛素抵抗大鼠的肝脏保护作用,并从乙酰辅酶A羧化酶1(Acetyl-coa carboxylase 1,ACC1)/脂肪酸合酶(fatty acid synthase,FASN)/硬脂酰-辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)信号通路及葡萄糖转运蛋白2(glucose transporter2,GLUT2)表达等角度,探究其可能的作用机制,为临床应用提供科学的实验支持。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠48只,体质量(220±20)g。购于北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0006,本研究经北京中医药大学医学与实验动物伦理委员会批准(批准号:BUCM-4-2021052405-2038)。大鼠于北京中医药大学动物房常规饲养,饲养条件:室温22~24℃、相对湿度60%~70%、光照节律12L:12D。由北京斯贝福生物技术有限公司提供特殊高脂饲料,配比为猪油10%、蔗糖15%、蛋黄粉15%、酪蛋白5%、胆固醇1.2%、胆酸钠0.2%、碳酸氢钙0.6%、石粉0.4%、鼠维持饲料52.6%。
1.2 实验药物
桑芪益气养阴方由黄芪、桑叶、玉竹、葛根、蜂胶粉按照4∶2.5∶3∶4∶0.3配比而成,购自安徽亳州市京皖中药饮片厂。制备方法:全方饮片分别用10倍、8倍的加水量煎煮2次,每次2小时,合并2次的滤液,加热浓缩,真空干燥后打粉,使用前用蒸馏水配制成相应浓度的药液。十味消渴胶囊(天津中新药业集团股份有限公司,国药准字号:Z19990033)。
1.3 实验试剂
L-甲状腺素钠(美国BioRuler公司,批号:r5703);链脲佐菌素(美国Sigma公司,批号:102364684);Trizol(美国Ambion公司,批号:15596-026),HiScript®II Q RT SuperMix for qPCR ,HiScript II Q Select RT SuperMix for qPCR,SYBR Green Master Mix购于南京诺唯赞公司,批号分别为:R223-01、R223-01、Q111-02;Taq Plus DNA Polymerase,DL2000 DNA Marker,dNTP购于北京天根生化科技有限公司,批号分别为:ET105-01、MD114-02、CD117。蛋白marker(10-250KD)(北京海利克思科技有限公司,批号:P12103-2);蛋白marker(20-120KD)(南京金斯瑞生物科技有限公司,批号:M00521);PVDF膜(0.45 μm)(美国Millipore公司,批号:IPVH00010);兔多抗GAPDH(37KD)(杭州贤至生物有限公司,批号:AB-P-R001);兔多抗ACC1(250KD)、兔多抗FASN(272KD)购于武汉三鹰生物技术有限公司,批号分别为:21923-1-AP、10624-2-AP;兔单抗SCD1(42KD)(英国Abcam公司,批号:ab236868);兔多抗GLUT2(57KD)(美国Affinity公司,批号:DF7510)。
1.4 实验仪器
台式高速冷冻离心机(德国Centrifuge公司,TY2017005846),水浴锅(姜堰市天力医疗器械厂有限公司,TL-420D),全自动研磨仪(武汉塞维尔生物科技有限公司,KH-III),酶标检测仪(美国Biotek公司,Epoch2C),全自动生化分析仪(深圳雷杜生命科技有限公司,Chemray 240),冰冻切片机(美国Thermo公司,Cryotome E),切片刀(上海徕卡仪器有限公司,Leica819),成像系统(日本尼康株式会社,Nikon DS-U3),电泳仪(DYY-7C)、垂直电泳槽(DYCZ-24DN)、电转仪(DYCZ-40)购于北京六一仪器厂。
1.5 实验方法
1.5.1 动物分组及给药 雄性SD大鼠48只,适应性喂养5天后,禁食不禁水12小时,测定给葡萄糖前(即0小时)大鼠血糖值、给予2.5 g/kg 葡萄糖后大鼠0.5小时和2小时血糖值为基础值,以0、0.5小时基础血糖水平将48只大鼠平均分为6个组,即空白组、模型组、阳性药组(十味消渴胶囊)、桑芪益气养阴方低、中、高剂量组,每组8只。连续30天进行大鼠灌胃给药,给药体积为1 mL/100 g,阳性药组给药剂量为十味消渴胶囊1.32 g/kg、桑芪益气养阴方低、中、高剂量组灌胃药物剂量分别为1.25、2.5、7.5 g/kg,空白组、模型组灌胃同等体积生理盐水。
1.5.2 造模方法 建立由高脂饲料喂养、甲状腺素(tetraiodothyronine,T4)皮下注射、联合链脲佐菌素(streptozotocin,STZ)注射造成胰岛素抵抗糖脂代谢紊乱大鼠模型[6]。适应性喂养5天后开始造模,造模周期维持30天,空白组给予维持料饲养,其余各组均给予高热能饲料;除空白组外,其余各组在实验第21~27天下午14﹕00进行上颈部皮下注射T4混悬液(0.2 mg/kg);在实验第28天除空白组外,各组禁食24小时(不禁水),在实验第29天以1 mL/100 g体质量的剂量一次性腹腔注射2%STZ溶液(30 mg/kg),注射后继续给予高热能饲料饲养5天,实验结束后取材。
1.5.3 血液及肝脏样本制备 在实验第35天,各组大鼠禁食不禁水16小时,第36天早晨,采用腹腔注射1%戊巴比妥钠(0.5 mL/100 g)麻醉大鼠,腹主动脉取血,室温静置2小时后4℃ 3 500 r/min,10分钟离心,取上层血清,-80℃保存。取肝大叶分装冻存管转移至液氮冻存,-80℃冰箱存放。
1.6 指标检测
1.6.1 血清生化分析及肝脏中游离脂肪酸(free fat acid,FFA)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)、肝糖原、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)的测定 采用比色法在全自动生化仪上测各组大鼠血清中谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)的浓度变化;采用比色法测各组大鼠肝脏中肝糖原、FFA、MDA、SOD、GSH-Px含量。
1.6.2 RT-qPCR检测大鼠肝脏组织ACC1、FASN、SCD1、GLUT2的mRNA表达 从-80 ℃超低温冰箱取大鼠肝脏组织,每组随机选取3个大鼠肝脏样本,Trizol法提取总RNA,将干燥后的RNA溶解于20 μL DEPC水中,取2 μL定量测试OD260、OD280,余量留待逆转录。以总RNA为模板合成cDNA,进行聚合酶链锁反应(polymerase chain reaction,PCR)反应。扩增条件:95°C 10分钟;95°C 15秒,60°C 60秒,循环40次;95°C 15秒,60°C 1分钟,95°C 15秒。在PCR扩增结束后,以2-ΔΔCt表示mRNA相对表达量。引物序列见表1。
1.6.3 Western Blot检测大鼠肝脏组织ACC1、FASN、SCD1、GLUT2蛋白表达 每组随机选取3个大鼠肝脏样本,按试剂盒法提取细胞总蛋白,蛋白定量法(Bicinchoninic acid,BCA)测定蛋白浓度。取蛋白样品进行SDS-PAGE电泳,转膜,封闭。用ACC1(1∶1 000、FASN(1∶1 000)、SCD1(1∶1 000)、GLUT2(1∶1 000)、GAPDH(1∶1 000)一抗,4 ℃孵育过夜,PBST洗膜5次,二抗(1∶10 000),室温孵育2小时,PBST洗膜5次,显色曝光,image-pro plus分析胶片条带灰度值。
1.7 统计学方法
2 结果
2.1 桑芪益气养阴方对胰岛素抵抗大鼠血清ALT、AST的影响
与空白组相比,模型组大鼠ALT显著升高(P<0.01)。与模型组比较,阳性药组大鼠ALT、AST显著升高(P<0.01),桑芪益气养阴方各剂量组ALT均显著降低(P<0.01),桑芪益气养阴方中、高剂量组AST显著降低(P<0.01)。见表2。
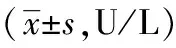
表2 桑芪益气养阴方对胰岛素抵抗大鼠ALT、AST的影响
2.2 桑芪益气养阴方对胰岛素抵抗大鼠肝脏肝糖原和FFA的影响
与空白组相比,模型组大鼠肝脏肝糖原显著降低(P<0.01),FFA显著升高(P<0.05)。与模型组比较,阳性药组和桑芪益气养阴方各剂量组大鼠肝脏肝糖原均显著升高(P<0.05,P<0.01),桑芪益气养阴方中、高剂量组大鼠肝脏FFA显著降低(P<0.05,P<0.01)。见表3。

表3 桑芪益气养阴方对胰岛素抵抗大鼠肝脏肝糖原和FFA的影响
2.3 桑芪益气养阴方对胰岛素抵抗大鼠肝脏MDA、SOD、GSH-Px的影响
与空白组相比,模型组大鼠肝脏SOD、GSH-PX显著降低,MDA显著升高(P<0.01)。与模型组比较,阳性药组大鼠肝脏MDA显著降低,SOD、GSH-PX显著升高(P<0.01)。桑芪益气养阴方各剂量组大鼠肝脏SOD、GSH-PX显著升高,MDA显著降低(P<0.01)。见表4。
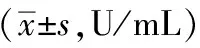
表4 桑芪益气养阴方对胰岛素抵抗大鼠MDA、SOD、GSH-Px的影响
2.4 桑芪益气养阴方对胰岛素抵抗大鼠肝脏ACC1、FASN、SCD1、GLUT2 mRNA表达的影响
与空白组比较,模型组大鼠ACC1、FASN、SCD1 mRNA表达显著升高(P<0.01),GLUT2 mRNA表达显著降低(P<0.01)。与模型组比较,阳性药组和桑芪益气养阴方低、中剂量组大鼠ACC1、FASN、SCD1 mRNA表达显著降低(P<0.01),GLUT2 mRNA表达显著升高(P<0.01)。见表5。

表5 桑芪益气养阴方对胰岛素抵抗大鼠ACC1、FASN、SCD1、GLUT2基因表达的影响
2.5 桑芪益气养阴方对胰岛素抵抗大鼠肝脏ACC1、FASN、SCD1、GLUT2蛋白表达的影响
与空白组比较,模型组大鼠ACC1、FASN、SCD1蛋白表达显著升高(P<0.01),GLUT2蛋白表达显著降低(P<0.01)。与模型组比较,阳性药组大鼠ACC1、FASN、SCD1蛋白表达显著降低(P<0.01),GLUT2蛋白表达显著升高(P<0.01);桑芪益气养阴方各剂量组大鼠FASN、SCD1蛋白表达均显著降低(P<0.01),桑芪益气养阴方中、高剂量组大鼠ACC1蛋白表达显著降低,GLUT2蛋白表达显著升高(P<0.01)。见表6,图1。

注A空白组;B模型组;C阳性药组;D桑芪益气养阴方低剂量组;E桑芪益气养阴方中剂量组;F桑芪益气养阴方高剂量组。图1 各组胰岛素抵抗大鼠肝脏ACC1、FASN、SCD1、GLUT2蛋白条带表达情况图

表6 桑芪益气养阴方对胰岛素抵抗大鼠ACC1、FASN、SCD1、GLUT2蛋白表达的影响
3 讨论
胰岛素抵抗是导致2型糖尿病的重要病理机制之一,同时也是非酒精性脂肪肝、高脂血症、动脉粥样硬化等疾病的共同危险因素。胰岛素抵抗的分子机制主要有糖毒性、脂毒性、氧化应激等,导致胰岛素受体信号转导异常。肝脏作为胰岛素作用的主要靶器官及糖脂代谢的重要器官,肝脏胰岛素抵抗在2型糖尿病的发生发展中起着举足轻重的作用[7]。GLUT2是一种跨膜载体蛋白,是肝脏和血液之间葡萄糖转移的主要转运体,可调节葡萄糖跨细胞膜运动,维持血糖稳定。胰岛素抵抗情况下,GLUT2蛋白表达减少,肝细胞葡萄糖摄取减少,可导致血糖升高[8];反之,肝脏GLUT2表达水平上调可促进肝组织对血液中葡萄糖的摄取,降低血糖水平[9]。前期研究显示,桑芪益气养阴方能显著降低气阴两虚型糖尿病大鼠的胰岛素抵抗指数,本研究结果显示桑芪益气养阴方还能显著抑制胰岛素抵抗环境下肝脏GLUT2蛋白的减少,增加肝糖原合成,从而降低血糖水平。
胰岛素抵抗加速脂肪组织分解并刺激肝脏脂肪合成,引起脂质代谢紊乱。脂肪组织加速分解,血液中大量游离脂肪酸流入肝脏,肝脏游离脂肪酸含量增加[10];另外,胰岛素抵抗过度刺激脂质的从头合成(de novo lipogenesis,DNL)并使肝脏脂质合成长期亢进[11]。DNL是肝脏脂质合成的重要途径,在维持血清甘油三酯稳态方面发挥重要作用[12]。ACC1、FASN和SCD1是DNL的三个关键酶。葡萄糖经糖酵解,在三羧酸循环中产生柠檬酸盐,CoA在ATP柠檬酸裂解酶的作用下释放,后经ACC1催化并转化生成丙二酰辅酶A,FASN以丙二酰辅酶A为底物合成棕榈酸酯,SCD1催化棕榈酸酯发生去饱和反应并延长,产生复杂脂肪酸[13],造成肝脏内甘油三酯过度沉积。本研究显示,桑芪益气养阴方可减少肝脏游离脂肪酸含量,并通过下调胰岛素抵抗大鼠肝脏组织的ACC1、FASN、SCD1mRNA和蛋白表达,抑制DNL的过度激活,减少肝脏脂质沉积,改善脂代谢紊乱。
氧化应激为肝脏糖脂代谢紊乱与肝脏胰岛素抵抗、肝功能受损中间环节。高血糖状态下氧化应激,一方面葡萄糖自身氧化作用增加,产生大量自由基;另一方面长期高血糖使多种蛋白质发生糖基化,形成糖基化终产物,过程中有大量自由基产生,其中SOD、GSH-Px等抗氧化酶的糖基化及活性下降加剧了氧化与抗氧化作用的失衡[14]。此外,过量游离脂肪酸在肝细胞线粒体内发生β氧化,影响线粒体的活性,使脂肪酸转化为甘油三酯沉积在肝细胞中,肝脏脂质过量沉积加剧肝细胞氧化应激反应,产生过多的自由基与活性氧,导致脂质过氧化反应[15],并在反应末端产生MDA,并消耗SOD、GSH-Px等多种抗氧化酶,从而引起蛋白质、核酸等生命大分子的交联聚合,使细胞丧失功能,引起肝脏细胞凋亡,从而导致肝脏功能紊乱[16]。本研究结果显示桑芪益气养阴方可缓解肝脏氧化应激,从而改善胰岛素抵抗并保护肝功能。
从中医角度看,在2型糖尿病的发展过程中,脾虚气少,津不上承则气阴两虚,脾失健运,不能转谷为精,则湿浊内停,这与现代医学中促进胰岛素抵抗“糖毒”“浊毒”“氧化应激产物”等相似[17]。中医在健脾益气养阴的同时,必注重激浊扬清,化湿还津。桑芪益气养阴方中黄芪健脾补气,益气养阴;桑叶清热润燥养阴,生津止渴;葛根健脾益气,升举清阳;玉竹甘寒质润,益胃生津;蜂胶补虚弱,化浊脂,止消渴。诸药合用,中州得健,纳运有常,清阳得升,浊阴得降,湿浊得化,津液得复,则消渴得愈。现代药理研究显示,黄芪[18]、桑叶[19]、葛根[20]、玉竹[21]、蜂胶[22]均有确切的降糖作用。
本实验研究显示,桑芪益气养阴方能通过增加肝糖原合成,降低血糖水平,减少糖毒;还能减少肝脏游离脂肪酸含量,减少肝脏脂质沉积,改善脂代谢紊乱,从而降低脂毒;尚能缓解肝脏氧化应激,从而改善肝脏胰岛素抵抗并保护肝功能,其作用机制可能与调节ACC1/FASN/SCD1通路和GLUT2基因和蛋白表达有关。桑芪益气养阴方既能减少糖毒、又能降低脂毒,还能保护肝脏,体现了中医辨证论治,标本兼治的特点,为高糖高脂人群的疾病防治提供了方向。

