基于网络药理学研究马钱子治疗类风湿性关节炎的作用机制*
陈玉婷,余 薇,镇树清,熊 丽**
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北省咸宁麻塘中医医院风湿病科)
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性炎症性自身免疫性疾病,其特征是进行性破坏性关节损伤和关节外表现[1]。关节受累通常与清晨僵硬对称,其发病机制尚不完全清楚[2],据估计,全球RA的患病率在0.5%~1.0%[3]。RA的治疗药物包括非甾体类抗炎药(如阿司匹林)[4]、慢效抗风湿药(如青霉胺)[5]和肾上腺皮质类固醇(如氢化可的松)[6]。然而,这些西药主要用于减轻症状,大多数表现出长期的不良反应和毒性[7]。因此,需要新的策略来改善抗关节炎药物的治疗效果并降低毒性。RA属于中医“痹证”范畴,其中,风寒湿邪、经络不畅、痰瘀互结是导致RA发生、发展的病机关键。
马钱子(semen strychni,SS)是临床上比较常用的一味中药,其别名有马前、番木鳖、大方八、苦实等,始载于《本草纲目》,是马前科植物云南马前(strychnospier 2rtana A1 W1 will)或马前(S.nux-Vomica L)的成熟种子[8]。马钱子含有单体多肽,且有很强的抗炎、抗风湿及类激素样作用。其含有的多肽神经毒素有神经阻断剂作用,能改善局部微循环,从而起到明显的镇痛作用[9]。马钱子在民间可用于治疗RA和面神经麻痹[10]。文献报道[11]马钱子可以影响单胺氧化酶含量以及色氨酸和多巴胺的代谢途径,从而改变大脑中乙酰胆碱(ACH)等神经递质的水平。
本研究采用网络药理学方法分析了马钱子中RA的活性成分及其潜在靶点,对马钱子有效成分-交集靶点-RA进行系统可视化网络图的构建,对靶基因进行GO功能富集分析、KEGG信号通路分析,进而阐明马钱子抗RA的潜在分子机制。
1 材料与方法
1.1 数据库网址及软件
TCMSP(http://tcmspw.com/tcmsp.php)、GeneCards(https:// www.genecards.org)、DisGeNET(https://www.disgenet.org)、OMIM(https://www.omim.org)、Uniprot(https:www.uniprot.org)、Venny2.1.0(http://bioinfogp.cnb.csic.es/tools/venny)、STRING(http://string-db.org/cgi/input.pl)、微生信(www.bioinformatics.com.cn)、软件Bioconductor(http://www.bioconductor.org/)和软件Cytoscape3.9.0。
1.2 基于网络药理学的分析
1.2.1 马钱子的活性成分和抗RA的靶点选取
从中药系统药理学(traditional chinese medicine database and analysis platform,TCMSP)获得了马钱子的有效成分并通过Uniprot转化其相应的靶点,并使用“马钱子”进行关键词搜索,筛选出口服生物利用度(oral bioavailability,OB)≥20%,类药性(drug-likeness,DL)≥0.1的信息。为了确定活性成分的靶点,删除了重复的值,并利用蛋白质序列和功能信息资源数据库UniProt确定了马钱子的靶点,利用Cytoscape3.9.0软件绘制了活性成分和目标之间的网络图谱。
1.2.2 疾病RA靶点的筛选
通过在GeneCards和OMIM数据库中输入关键词“Rheumatoid arthritis”进行检索。首先,在搜索框中输入“Rheumatoid arthritis”之后点击查询,出现该疾病相关的基因,先后计算两次GeneCards所得数据中Relevance score的中位数,分别是0.55和1.12,筛选出中位数大于等于1.12的疾病靶点,取这两个数据库所得疾病靶点的并集并去除重复项后,得到RA的靶点。
1.2.3 马钱子有效成分和RA交集靶点的获取及蛋白互作(protein-protein interaction,PPI)
网络的构建将马钱子有效成分和RA的靶点导入Venny2.1.0中制作韦恩图,得到马钱子有效成分与RA的交集靶点,导入String数据库中进行PPI分析。限定物种为“Homo Sapiens”,设置最低置信度为0.4,同时勾选隐藏游离的点,构建PPI网络。将PPI网络图下载TSV格式并上传至cytoscape 3.9.0软件中,应用CytoNCA插件计算各节点的BC、CC、DC、EC、LAC及NC值,筛选核心靶点。
1.2.4 GO和KEGG富集分析
利用生物信息学开源软件Bioconductor在R语言内安装运行clusterProfiler、Stringin、DOSE和Pathview程序,对其进行生物学过程的GO、KEGG功能富集分析,并通过微生信平台进行可视化显示。GO基因功能从生物过程(biological process,BP)、细胞成分(cellular component,CC)、分子功能(molecular function,MF)三方面注释药物治疗疾病的作用靶蛋白在基因功能中的作用,为阐明药物治疗疾病的靶点在信号通路中进行KEGG通路富集分析。
2 结 果
2.1 马钱子的活性成分和抗RA的靶点
利用TCMSP数据库搜索“马钱子”,筛选出刺罂粟碱[(S)-Stylopine]和(2R)-5,7-二羟基-2-(4-羟基苯基)色氨酸-4-酮[(2R)-5,7-dihydroxy-2-(4-hydroxyphenyl)chroman-4-one]等12个有效成分,其中OB≥20%、DL≥0.1,见表1。利用Uniprot数据库将有效成分的靶点与人类基因名进行匹配,删除重复值,并确定了32个潜在靶点。如图1所示,Degree表示是在网络分析中刻画节点最直接度量指标,节点度越大就意味着这个节点的度中心性越高,该节点在网络中就越重要。刺罂粟碱和(2R)-5,7-二羟基-2-(4-羟基苯基)色氨酸-4-酮Degree最高,所以它们可能是马钱子治疗RA两个主要有效成分。
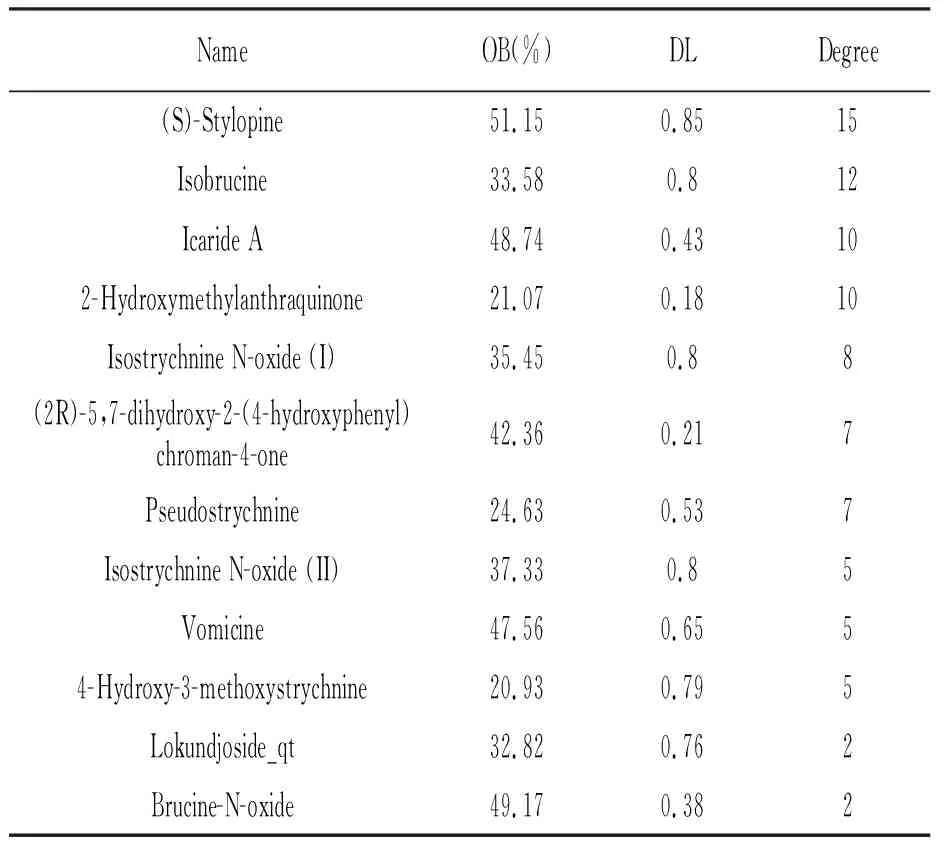
表1 马钱子活性成分的筛选
利用GeneCards和OMIM数据库,对关键字进行“Rheumatoid arthritis”搜索,分别识别出5319和27个靶点。对从这两个数据库中获得的目标数据进行合并和重复数据删除后,鉴定出5319个RA靶点。最后,本研究使用维恩图总结了马钱子和RA有17个共同靶点,以便进一步分析,见图2A。关于这些目标的详细信息见表2。此外,这17个RA交集靶点根据其细胞功能分为5类,其中跨膜信号受体(PC00197 35.29%)是最富集的类,见图2B。

图2 马钱子抗RA的交集靶点的获取及蛋白互作(PPI)
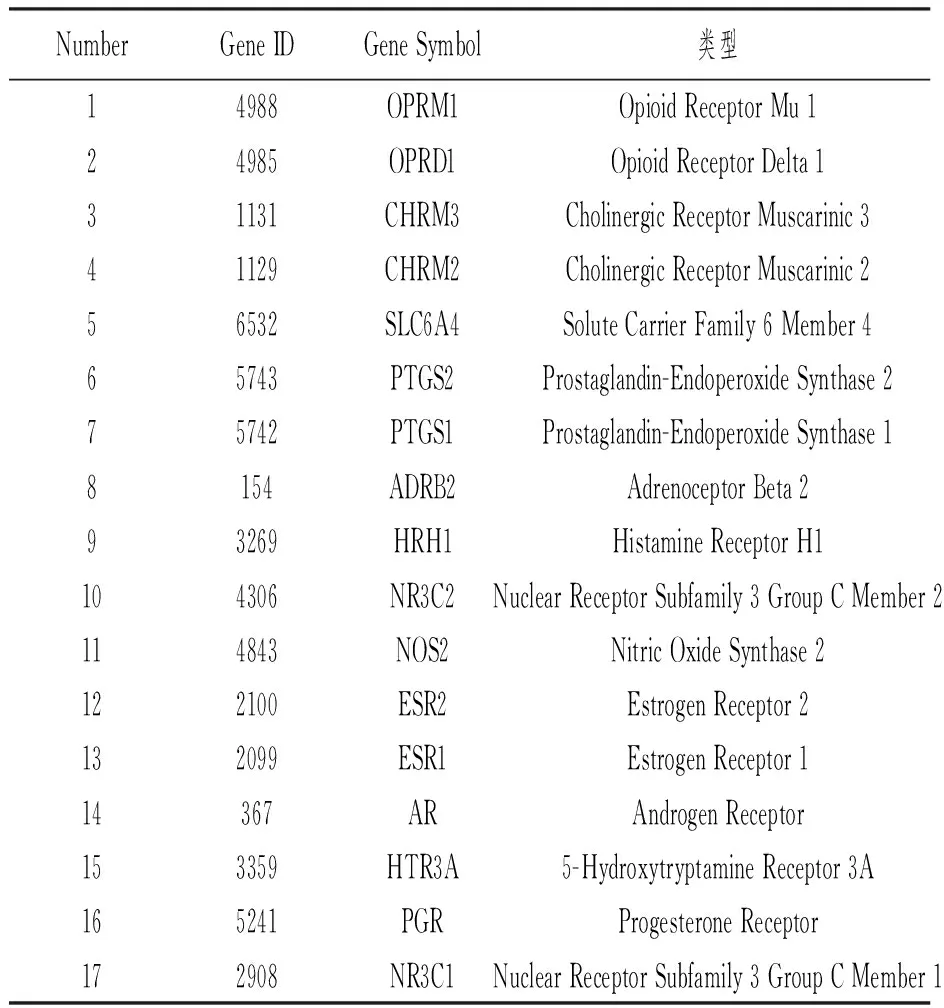
表2 马钱子与RA交集靶点
将马钱子有效成分与RA的17个交集靶点导入String数据库中,构建PPI网络并进行PPI分析。PPI网络包含17个节点,35条边,平均度为4.12度(图2C)。以NR3C1、SLC6A4、PTGS2、PGR、ESR1、AR、OPRM1、ADRB2、NR3C2和HTR3A为Degree排序前十核心靶点。其中,NR3C1、SLC6A4和PTGS2是相关性最高的前三个靶点,Degree分别为8、8和7,见图2D。结果表明马钱子成分通过多个靶点和生物学机制对RA有效。
2.2 马钱子有效成分-交集靶点-RA构建
为了探讨马钱子的有效成分治疗RA的作用机制,利用马钱子中的17个交集靶点和12个有效成分构建了马钱子-RA-交集靶点网络图,见图3。刺罂粟碱[(S)-Stylopine](Degree=9)有效成分的靶点最多,表明马钱子的有效成分很可能成为治疗RA的重要机制。
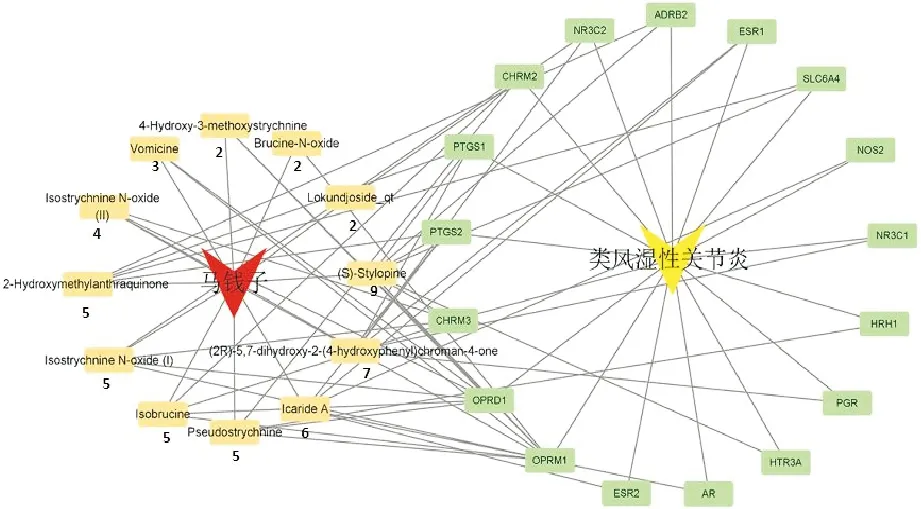
图3 马钱子成分-靶点-疾病图
2.3 马钱子对RA的潜在作用机制
为了研究马钱子对RA的潜在协同机制,在R语言内安装运行clusterProfiler和Stringin等程序,对其进行生物学过程的GO、KEGG功能富集分析。根据GO生物功能分析,BP条目861个,CC条目98个,MF条目127个,分别选取前10进行绘图(图4A-C)。BP主要是细胞内类固醇激素受体信号通路(GO:0030518)、类固醇激素介导的信号通路(GO:0043401)、RNA聚合酶Ⅱ启动子的转录起始(GO:0006367)、类固醇激素反应(GO:0048545)和细胞对多巴胺的反应(GO:1903351)等。CC主要集中突触前膜(GO:0042734)、突触后膜(GO:0045211)和突触膜(GO:0097060)上。MF主要集中核受体活性(GO:0004879)、配体激活的转录因子活性(GO:0098531)和类固醇激素受体活性(GO:0003707)等方面,这表明马钱子在多种生物学方面对RA的发生发展都有影响。

图4 马钱子活性成分抗RA关键靶基因富集分析
为了找出与马钱子治疗RA靶点有效成分相关的信号通路,进行KEGG富集通路分析,得到相关性最高的前20条信号通路(图4D)。神经活性配体受体相互作用通路(hsa04080)、化学致癌-受体激活通路(hsa05207)、血清素突触通路(hsa04726)和钙信号通路(hsa04020)等。KEGG通路富集分析见表3。
3 讨 论
为了研究马钱子对RA的治疗作用,并揭示其潜在的分子机制,本研究采用了网络药理学的方法,确定了马钱子中有12种抗RA成分的17个潜在靶点。在12种有效成分中,刺罂粟碱[(S)-Stylopine]有9个抗RA靶点。既往研究表明[12],马钱子可以治疗RA,但其作用机制尚不明确。到目前为止,关于刺罂粟碱和(2R)-5,7-二羟基-2-(4-羟基苯基)色氨酸-4-酮治疗RA的还未有研究报道。本研究综合探讨了马钱子对RA的治疗作用。
根据研究结果,马钱子的神经活性配体受体相互作用通路和血清素能突触通路是治疗的重要途径,可能是刺罂粟碱等活性成分中枢和外周两种途径发挥镇痛作用以及降低血清中的血清素(5-HT)减少炎症因子的分泌,达到治疗的效果。
PPI网络分析发现,NR3C1、SLC6A4和PTGS2是排名前三的靶点,推测马钱子在RA治疗中尤为重要。NR3C1核受体亚家族3C组成员1是重组蛋白属于糖皮质激素受体,它调节糖皮质激素受体(corticoid receptor,GR)参与调节多种神经系统基因的转录和表达。与GR结合的内源性糖皮质激素(GCs)是由肾上腺皮质束状带细胞合成和分泌的,能调节心血管功能,活化中枢神经系统以及抑制免疫/炎症反应等多种生理、病理过程,是一种强有力的物质代谢及炎症反应调节剂[13]。SLC6A4是血清素转运蛋白基因,PTGS2是前列腺素生物合成中的核心酶,有研究表明[14],SLC6A4和PTGS2这些目标主要与氧化应激、激素失调等有关。
进一步进行GO生物过程富集分析和KEGG信号通路分析,GO生物过程富集主要包括细胞内类固醇激素受体信号通路、类固醇激素介导的信号通路和RNA聚合酶Ⅱ启动子的转录起始等。KEGG信号通路得到20条信号通路与治疗RA有关,其中神经活性配体受体相互作用通路、化学致癌-受体激活通路、血清素突触通路和钙信号通路等。核心靶点NR3C1、SLC6A4和PTGS2主要富集神经活性配体受体相互作用通路和血清素能突触通路。据报道[15],NR3C1多态性与某些免疫介导疾病的易感性和类固醇治疗敏感性的差异有关。血清素能突触中5-羟色胺2受体调控的SLC6A4出现显著高表达[16]。PTGS2已被证明在阿尔茨海默病的发展中发挥重要作用[17-18]。PTGS2可能通过激活其下游通路(如PI3K/AKT通路)来增加炎症趋化因子和细胞因子的产生,从而促进神经元凋亡和炎症并抑制神经突生长[19]。通过对马钱子抗RA相关的作用靶点进行GO生物过程富集分析、KEGG信号通路分析,证明了马钱子是通过多靶点、多通路发挥治疗RA的作用。
综上所述,本研究通过药理学方法确定了马钱子治疗RA的关键成分、核心靶点和途径。基于这些证据表明,刺罂粟碱和(2R)-5,7-二羟基-2-(4-羟基苯基)色氨酸-4-酮可能通过神经活性配体受体相互作用通路和血清素能突触通路作用于NR3C1、SLC6A4、PTGS2靶点。马钱子可能是通过神经活性配体受体相互作用通路、下调血清素能突触通路发挥抗RA作用的,以期为今后深入研究马钱子治疗RA的关键机制提供理论依据。

