改良组织块贴壁法培养小鼠气道平滑肌细胞及鉴定
赵爱玲,姚 冬
0 引 言
气道平滑肌细胞(airway smooth muscle cells,ASMCs)是气道的重要组成部分,是气道病理生理学的主要决定因素,其生理紊乱与多种肺部疾病的发生和发展密切相关,尤其在气道高反应性和气道重塑中[1-4]。近年来气道平滑肌已成为哮喘、慢性阻塞性肺病等疾病发病机制研究中的热点,ASMCs的体外培养为这些机制研究提供了一个有效的平台[5-8]。小鼠经常被用来建立哮喘和慢性阻塞性肺疾病模型,因此,如何在短期内获得高纯度、高活力的小鼠ASMCs并稳定传代,具有重要意义。目前文献所报道的原代细胞培养方法一般为酶消化法和单纯组织块贴壁法[10-13]。酶消化法获取细胞速度快,但获得细胞数量少,难以控制消化时间,易损伤细胞活力;单纯组织块贴壁法方法简单,但培养周期长,极大地限制小鼠ASMCs的体外应用。本实验将两者综合改进,采用组织块消化后贴壁法进行ASMCs的原代培养,在体外建立了稳定传代的小鼠ASMCs增殖模型,并与酶消化法和单纯组织块贴壁法进行比较,探讨改良组织块贴壁法培养的优点。
1 材料与方法
1.1 实验动物SPF级健康清洁C57BL/6J野生小鼠15只,5~8周龄,购自北京斯贝福生物技术有限公司,动物许可证号SCXK(京)2019-0010。本动物实验遵循中国实验动物福利伦理审查指南。小鼠分笼饲养于SPF级动物房的独立送风隔离笼具内,饲养室按照正常生物光照循环,温度控制在18~22 ℃,湿度控制在50%~60%,保持温度和湿度相对稳定,笼内垫料保持干燥清洁,饮用消毒灭菌处理后的水。实验时使用随机分组法将小鼠分为3组,每组5只。
1.2试剂和仪器DMEM高糖培养基、HBSS液、DPBS液、青链霉素、两性霉素B 、0.25 %胰蛋白酶购自美国Gibco公司;胎牛血清(Fetal Bovine Serum,FBS)购自以色列BI公司;I型胶原酶购自加拿大Stemcell公司;弹性蛋白酶、DAPI、鼠源单克隆α-SMA-Cy3、α-SMA-FITC、Vimentin-Cy3特异性抗体购自Sigma-Aldrich公司;Cell Counting Kit(CCK8)检测试剂盒购自日本同仁;CO2细胞培养箱购自美国Thermo Fisher Scientific公司;倒置显微镜购自日本Nikon公司;体式显微镜购自德国Zeiss公司;离心机为Eppendorf 5910 R高速冷冻离心机。
1.3原代培养颈椎脱臼法处死小鼠,将小鼠浸润到75%乙醇中消毒1 min(勿浸口鼻),酒精棉球擦拭消毒小鼠未浸润部分,无菌器械从腹部至颈部依次剪开皮肤和肌肉,腹主动脉放血后再剪开胸腔,取出带有气管的肺部。将组织转移入预冷HBSS液中,在体式显微镜下使用无菌显微镊将支气管表面的结缔组织小心剥离,纵向剖开气管,剪去无平滑肌组织的气管软骨环,仅保留富含平滑肌细胞的组织,最后用无菌棉签轻轻擦拭平滑肌条内壁2~3次。将处理好的组织转移入生物安全柜,用预冷HBSS液清洗3次。为了较为准确地分析3种分离方法获得ASMCs的速度,我们共计分离了15只小鼠的肺部平滑肌组织,随机平均分为3份后,再进行以下不同方法的原代培养实验。
1.3.1酶消化法将处理好的平滑肌条收集在24孔板单孔内,加入1 mL的I型胶原酶(1 mg/mL)和弹性蛋白酶(3.3 U/mL),放入37 ℃培养箱消化30 min后,再放入HBSS液中清洗1次,转移入单个24孔板,眼科剪剪碎平滑肌条(0.5~1 mm3),再加入1.5 mL的I型胶原酶(1 mg/mL)和弹性蛋白酶(15 U/mL),放入37 ℃培养箱中消化2.5 h后,用5 mL枪头轻柔吹打2 min,将组织分散为单个细胞或细胞团块,用70 μm无菌细胞滤网过滤到15 mL离心管中,100×g离心5 min后弃上清,加4 mL含10% FBS的DMEM培养液重悬,接种于T12.5细胞培养瓶,在含5% CO2的37 ℃细胞培养箱中静置培养,第4天换液,以后每隔3天更换一次培养液。
1.3.2单纯组织块贴壁法将清洗过的平滑肌条收集到6孔板内,眼科剪剪碎组织块,体积约为1 mm3。用100 μL含20% FBS的DMEM培养液重悬组织块并转移到T12.5细胞培养瓶,使用1 mL枪头将组织块涂抹均匀于培养瓶底面,将培养瓶底面翻转向上后加入4 mL的含20 %FBS的DMEM培养液,保持培养瓶底面向上,于37oC培养箱静置3 h后,翻转细胞培养瓶使培养液没过组织,在细胞培养箱静置培养,第3天换液。
1.3.3改良组织块贴壁法将处理过的平滑肌条收集于24孔板单孔内,加入1 mL 37 ℃预温过的I型胶原酶(2 mg/mL),在37 ℃培养箱中消化30 min,将平滑肌条转移到含有20 % FBS的DMEM培养液中终止消化,然后再次将平滑肌条收集到6孔板内。余下步骤与单纯组织块贴壁法相同。
1.4传代培养待细胞生长至80%~90%时可进行传代。先吸弃培养液,用DPBS液清洗2次,加入含0.05% EDTA的0.25%胰蛋白酶,轻晃培养瓶使其分布均匀,停留10 s后吸弃,在37 ℃培养箱放置3 min,此时镜下可观察到细胞回缩变圆,加入含10% FBS的DMEM培养液终止消化,轻柔吹打细胞使其脱落,形成的单细胞悬液按1∶2或1∶3接种传代。P1代的细胞接种密度可为1.0 × 104个细胞/cm2。
1.5细胞计数台盼蓝染色法进行细胞计数,取10 μL细胞悬液与10 μL 0.2%台盼蓝,吹打混匀后移至细胞计数板,细胞计数仪随机选取3个视野进行计数,计算时取平均数。活细胞不被台盼蓝染色,而死细胞则被染成蓝色,仪器会自动测量死活细胞个数和细胞密度。公式如下:
细胞总数 = 细胞密度 × 细胞悬液总体积
1.6细胞纯化成纤维细胞贴壁时间较平滑肌细胞短,这一特性常用来去除成纤维细胞。具体操作:如前所述消化细胞,并将其制成单细胞悬液。在6 cm培养皿内加入4 mL细胞悬液,37 ℃绝对静置15 min,此时显微镜下可观察到部分细胞贴壁,轻轻吸取未贴壁细胞转移至新皿内,再次静置15 min,即得到纯度较高的平滑肌细胞。若细胞数量足够多或希望进一步提高细胞纯度,可首次差速贴壁30 min,再差速贴壁15 min。
1.7细胞免疫荧光技术为了比较原代ASMCs的纯度,我们将酶消化法、单纯组织块贴壁法和改良组织块贴壁法获得的P1代平滑肌细胞接种于24孔板细胞爬片上,待ASMCs融合至60%~80%时进行α-SMA-Cy3直标抗体染色。ASMCs具有正常的α-SMA阳性表达,可见肌动蛋白呈红色条束,细胞核用DAPI染色后呈蓝色荧光。随机选取5个视野计数α-SMA阳性细胞数量(红色荧光标记)和总细胞数(蓝染DAPI细胞核数量),统计α-SMA阳性细胞比率,即为原代ASMCs的纯度。为了判断ASMCs培养后期性状是否会发生改变,我们应用α-SMA-FITC(绿色荧光)和Vimentin-Cy3(红色荧光)直标一抗对改良组织块贴壁法获得的P1代和P5代ASMCs进行免疫荧光共染色。α-SMA抗体染色阳性且Vimentin抗体染色阳性的细胞为平滑肌细胞,α-SMA抗体染色阴性但Vimentin抗体染色阳性的细胞为成纤维细胞。具体步骤:吸弃旧培养液,PBS洗涤1次;加入4%多聚甲醛室温固定30 min,PBS静置洗涤5 min × 3次;加入0.2% Triton-X-100室温通透15 min,PBS静置洗涤5 min × 3次;加入5% BSA室温封闭1 h,倾去后用PBS洗涤1次;加入直标一抗(α-SMA-Cy31∶600、α-SMA-FITC 1∶400、Vimentin-Cy31∶500),4 ℃避光孵育过夜;0.1% Triton-X-100洗涤5 min × 3次;加入的1∶5000 DAPI室温避光孵育5 min,PBS静置洗涤5 min × 3次,封片后在正置荧光显微镜下观察并拍片。平滑肌细胞纯度公式计算如下:
平滑肌细胞纯度(%)=α-SMA阳性细胞数/DAPI核染细胞总数 × 100%
1.8CCK8实验待3种原代培养方法产生的细胞发生克隆抑制后进行首次传代,将ASMCs差速贴壁纯化得到P1代细胞,通过CCK8实验比较3种方法获得的ASMCs的增殖速度。在96孔板内培养小鼠ASMCs,培养密度为5 × 103个细胞/孔,做3个重复孔。每隔24 h检测1次。吸弃旧培养液,每孔加入100 μL含10% CCK8的细胞培养液,孵育2 h后在450 nm吸光度下测量A值。

2 结 果
2.1 细胞生长情况酶消化法第1天仅有少量细胞贴壁伸展,第4天绝大多数细胞贴壁完成,一般需要7~10 d长满。单纯组织块贴壁法的组织块在第1天基本无细胞游离出,培养第4天时,大部分组织块周围游离出贴壁细胞,但较稀少,并且仍有部分组织块未游离出贴壁细胞。改良组织块贴壁法在第1天即可观察到细胞从组织块边缘游离出来贴壁生长,培养第4天时可见组织块周围游离出大量细胞并发生克隆抑制,此时可进行首次传代。原代培养的细胞形态不一,单个平滑肌细胞呈梭形或不规则三角形,可见到多个圆形细胞核,细胞质丰富。显微镜下观察改良组织块贴壁法培养第4天的细胞,可见细胞融合后,部分区域细胞呈束状排列,相互穿插,起伏状生长呈现出典型“峰谷”状现象。见图 1。

图 1 原代培养ASMCs的形态学观察Figure 1 Morphological observation of primary cultured ASMCs
2.2ASMCs纯度鉴定结果显示,相比单纯组织块贴壁法,改良组织块贴壁法获得的原代平滑肌细胞的纯度更高[(93.0%±1.8%)vs(96.1%±1.8%),P<0.01],酶消化法获得的平滑肌细胞的纯度(90.8%±1.9%)最低,与改良组织块贴壁法相比,差异具有统计学意义(P< 0.01)。结果还显示P5代细胞与P1代细胞相比,平滑肌细胞生长形态较前改变,呈不规则形,且α-SMA阳性表达减弱,Vimentin阳性表达增强,标志着平滑肌细胞的纯度会随传代次数增加而逐渐降低。见图 2。
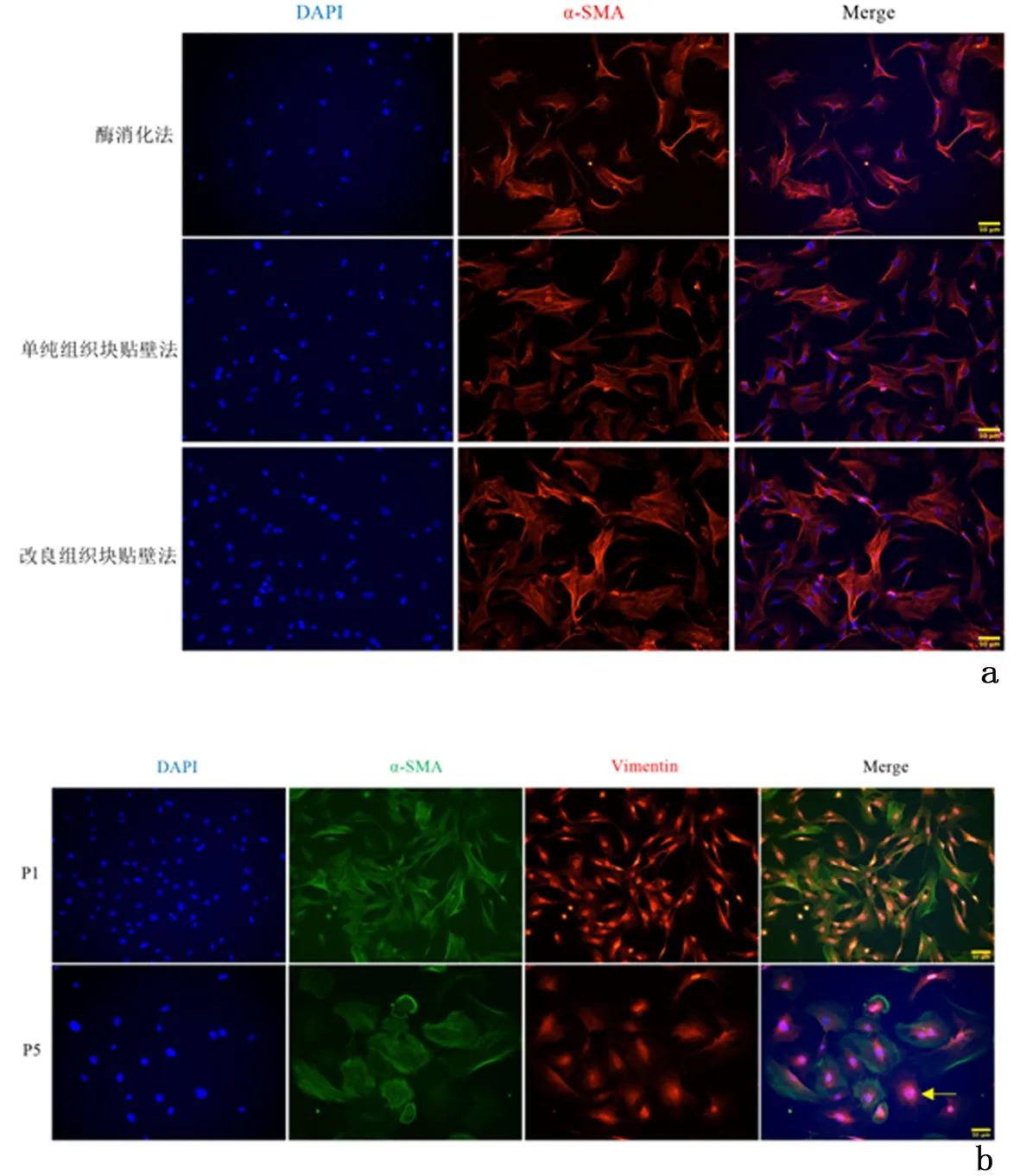
a:3种培养方法得到的ASMCs的免疫荧光鉴定(×200); b:改良组织块贴壁法P1代和P5代ASMCs的免疫荧光染色(×200),黄色箭头所指为成纤维细胞图 2 ASMCs纯度的比较Figure 2 Comparison the purity of ASMCs
2.3原代培养ASMCs增殖比较结果显示酶消化法获得的ASMCs的增殖速度较单纯组织块贴壁法和改良组织块贴壁法获得的ASMCs的增殖速度慢(P< 0.01),而单纯组织块贴壁法和改良组织块贴壁法获得的细胞的增殖速度差异无统计学意义(P>0.05)。见图 3。
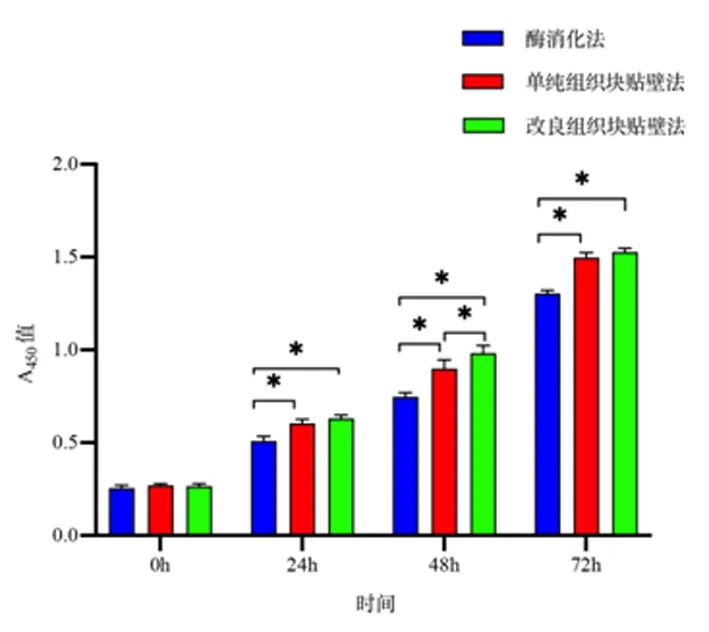
*P<0.01图 3 ASMCs增殖速度的比较Figure 3 Comparison the proliferation rate of ASMCs
3 讨 论
原代气道平滑肌细胞培养是在分子水平研究呼吸道疾病发病机制和治疗手段的主要体外细胞模型,因此,如何简单快捷地分离到足够数量的高纯度和高活力的原代气道平滑肌细胞至关重要。
与大鼠相比,小鼠肺部气道细小,极易撕扯破裂,二级支气管以下较难剥离干净,如何分离到较完整的气道平滑肌组织获得较纯的ASMCs是小鼠原代ASMCs培养的难点,故此我们首先优化了取材方法,只取小鼠二级支气管以上部位,并在显微镜下轻柔剥离支气管上的结缔组织;剪去无平滑肌组织的气管软骨环部分,仅保留富含平滑肌组织的后壁,减少成纤维细胞爬出的概率,进一步提高分离出的ASMCs的纯度;无菌棉签轻柔擦拭平滑肌条内壁2~3次,减少上皮细胞和内皮细胞的爬出,减小因为使用镊子和手术刀片等其他工具而损伤到平滑肌细胞的可能性。体式显微镜下进行这些操作可以避免撕破气道平滑肌组织,最大程度保证其完整性。
从获取平滑肌细胞的速度来看,酶消化法获取细胞速度最快,但成本高,操作复杂,获得细胞数量较少,细胞中心融合需7 ~ 10 d左右,方能进行首次传代。相比于酶消化法,单纯组织块贴壁法操作简单,可以较为稳定的获得原代ASMCs,但是组织块游离出细胞的快慢程度不一,培养周期长,本实验中单纯组织块贴壁法的首次传代时间一般为5 ~ 7 d左右。经过反复试验摸索,我们优化了组织块的处理,在单纯组织块贴壁法的基础上,使用2 mg/mL的I型胶原酶预先处理组织后再贴壁,因为I型胶原酶消化作用较为温和,是唯一一种可以降解广泛存在结缔组织内的胶原纤维的蛋白酶。结果发现经I型胶原酶处理过的组织变得疏松伸展,细胞从组织块边缘游离出的阻力减小,细胞游离贴壁的速度加快,在实验次日即可观察到有细胞从组织块边缘游离出,并且经I型胶原酶处理过的组织块的出膜率也高于单纯贴壁的组织块,一般在培养的第4天即可进行首次传代,综上所述,相比酶消化法和单纯组织块贴壁法,改良组织块贴壁法可以在更短的时间内获得更多的原代ASMCs。
从获取细胞的纯度来看,酶消化法所得细胞的纯度最低,原因可能是酶消化了整个组织块的所有细胞,包括上皮细胞、内皮细胞、成纤维细胞以及其他杂细胞,这些细胞在初始贴壁后便开始克隆生长,平滑肌细胞后期难以利用传代增殖优势抑制杂细胞的生长。实验发现,贴壁法的组织块在培养第四天开始游离出上皮细胞。为防止大量上皮细胞混杂,降低平滑肌细胞的纯度,此时应尽快进行首次传代。而改良法中的组织块可在短期内游离出大量平滑肌细胞,在培养第四天组织块外缘细胞就发生了克隆抑制,可进行首次传代,这保证了ASMCs的传代增殖优势,可有效提高ASMCs的纯度。
从获得的细胞的质量来看,通过CCK8实验比较3种方法获得的P1代原代气道平滑肌细胞的增殖速度,结果显示相比于单纯组织块贴壁法和改良组织块贴壁法获得的ASMCs,酶消化法获得的ASMCs的增殖速度较慢。这可能与消化酶的浓度大小与消化时间长短有关,时间过短不能完全消化组织,但时间过长又容易损伤细胞活力。小鼠气道平滑肌组织少而珍贵,酶消化法的各种不确定性使得它不宜成为小鼠平滑肌细胞原代培养的首选方法。
ASMCs有两种表型,包括收缩表型与合成表型[14]。收缩表型标志物包括α-SMA(α平滑肌肌动蛋白),合成表型标志物包括Vimentin(波形蛋白),Vimentin同时也是成纤维细胞的标志物[15-16]。原代ASMCs通常是收缩表型,但由于其具有表型可塑性,细胞在培养过程中会从收缩表型转变为合成表型,同时α-SMA的表达减少,Vimentin的表达增加[17]。根据实验结果,我们可以发现,随着传代次数的增加,原代ASMCs性状会发生改变,部分收缩型ASMCs逐渐转变为合成型ASMCs,并且成纤维细胞增多,平滑肌细胞纯度降低。为避免干扰实验结果,我们建议选用形态和功能保持稳定的P5代之前的平滑肌细胞进行科学实验。
本培养方法需要注意的其他事项还有:本实验为开放式取材,实验过程中所用HBSS液需含有100 U/mL青霉素和100 μg/mL的链霉素,细胞培养液需含有100 U/mL青霉素、100 μg/mL的链霉素和0.25 μg/mL的两性霉素B,传代后可使用不含抗生素的细胞培养液;组织块贴壁后要防止组织块漂浮,应绝对静置两天;组织块会产生代谢废物,在组织块贴壁后的第3天必须换液;消化细胞时,若吹打后仍有部分细胞不离壁,可轻拍瓶身帮助细胞脱落,切勿多次吹打细胞,会严重损伤原代细胞活力;原代细胞脆弱且珍贵,传代时非必要不离心,即简化实验步骤又可避免细胞的损伤和损失;使用P3或P4代细胞时可差速贴壁20 min,进一步纯化细胞后再进行后续实验。
综上所述,改良组织块贴壁法成本较低、操作简便且耗时较短,不仅提高了ASMCs的纯度还保证了ASMCs的数量和质量,可为研究人员提供可靠的细胞来源,为今后气道疾病的基础研究和药物开发提供了理想的体外培养模型。

