兔管状肠外瘘模型的建立
李 泽,瞿桂文,陈 康,蒋运罡,黄金健,任建安
0 引 言
肠外瘘是指肠道破损与体外相通,导致肠内容物漏出。肠外瘘是手术后常见的并发症,会严重危及患者生命,显著增加患者的病死率。肠外瘘包括管状瘘、肠空气瘘(enteroatmospheric fistula,EAF)以及唇状瘘等,其中管状瘘是最常见的肠外瘘[1]。肠外瘘的原发疾病主要为恶性肿瘤,常发生于空回肠[2]。近年来随着人口老龄化和医学的发展,肠瘘发病率呈逐年增加的趋势。
自20世纪60年代,肠外瘘的治疗经历了从早期手术治疗到“引流+择期手术”再到“肠腔隔绝技术和早期确定性手术”的过程[3-4]。早期尽快恢复肠道的完整性对于肠外瘘的治疗极其重要,其可以减少水电解质紊乱,减轻瘘口周围皮肤损伤,同时,尽早恢复肠内营养、维持肠道稳态[5-6]。对于管状瘘通常首选医用凝胶进行封堵,促进其自愈合;EAF通常通过引流或通过补片临时保持肠管的完整性后进行确定性手术[7]。然而,既往报道的肠外瘘动物模型极少关注管状瘘的病理生理特征,难以对不同干预措施进行临床前研究[8-10]。随着近年来吻合口瘘、手术部位感染、炎性肠病以及放射性肠炎导致的管状瘘患者逐年增加,亟待建立管状瘘的动物模型。本研究旨在建立兔管状肠外瘘动物模型,以期为管状肠外瘘的临床治疗提供理论依据。
1 材料与方法
1.1 材料新西兰大白兔由我院比较医学科提供,许可证号为SCXK(苏)2019-0005。主要试剂:乌拉坦购自上海麦克林生化科技股份有限公司;5%葡萄糖氯化钠注射液、10%葡萄糖注射液购自四川科伦药业股份有限公司;4%多聚甲醛固定液购自武汉赛维尔科技有限公司;注射用头孢哌酮舒巴坦钠购自扬子江药业集团有限公司;亚甲蓝注射液购自江苏济川药业集团有限公司;外科缝线购自中国苏州医疗用品有限公司。
1.2动物及分组雄性新西兰大白兔12只,体重为 (2.5±0.15)kg,自然光照和暗循环,相对湿度(50±5)%,食水自由摄取,动物适应环境1周后开始试验,实验过程中喂食标准颗粒饲料,术前禁食30 h,禁饮6 h,禁食时饮水换为5%葡萄糖水。通过随机数表法,将新西兰大白兔分为2组。实验组8只,对照组4只。研究用实验动物的使用与操作均由东部战区总医院动物调查伦理委员会审核批准(伦理编号:2020JLHGKJDWLS-54)。
1.3造模实验组:首先应用乌拉坦等渗盐水溶液(20%)进行基础麻醉,按5 mL/kg经耳缘静脉注射,麻醉后将兔子仰卧位固定于手术台上,充分备皮后,消毒3次,在距剑突下6 cm处取腹正中切口,长约5 cm,用电刀经白线打开腹膜进入腹腔,标记回肠末端距离阑尾伴行处10 cm的近心端肠管,自腹壁外侧经腹外斜肌斜行至近切口处造成一长0.8 cm、深0.5 cm的通道,在标记肠管的系膜对侧平行于肠管长轴切开肠管,长约0.5 cm,并将裁剪后的18号T管留置于肠腔内,用3-0可吸收线将肠管边缘与T管充分固定后,将T管自腹壁的斜形切口取出,拉紧后在腹壁外侧用丝线固定,用纱布封堵T管,防止肠液丢失。检查腹腔内无出血或异物,清点纱布数量后,用4-0可吸收线连续缝合肌层,用4-0丝线间断缝合皮肤,边距1.5~2.5 mm,针距3.5~5 mm关闭腹腔、消毒并放置造口袋保护创面。对照组:麻醉后行开腹探查手术。
1.4围手术期管理依据郑惊雷等[11]的研究,各组术中静脉注射6 mL 0.3 g头孢哌酮舒巴坦钠溶液,术后给予100 mL 5%葡萄糖氯化钠溶液缓慢静脉滴注,禁食不禁饮,术后前3 d饮水器内补充含0.5 g头孢哌酮舒巴坦钠的10%葡萄糖溶液,第4天给予正常饮食,第14天拔除T管。
1.5评价指标及方法①实验动物存活率:通过动物模型建立期间各组动物的存活及死亡的数量,计算存活率。②手术时间:记录每只动物从开腹到关腹的时间。③术后3 d饮水量:每天按时记录饮水瓶中剩余量与添加量,估算24 h的饮水量。④窦道形成评估:术后第14天饮水中加入亚甲蓝(1 mL/100 mL),拔除T管后,观察瘘口排泄物颜色变化。⑤血清指标检测:术后第14天麻醉后经心脏取血10 mL,1000×g离心5 min后取上清液,通过全自动生化仪(迈瑞BS-240)检测血清总蛋白(total protein,TP),血清白蛋白(albumin,ALB)和血糖(blood glucose,Glu)。⑥形态学变化:动物取血后行剖腹探查术,按我们之前报道的方法,选择腹部“U”型切口进腹,避开原手术切口,观察腹腔粘连情况以及瘘口周围肠管变化情况[12]。⑦瘘口形态及组织学变化:取瘘口处全层皮肤及肠管置于甲醛固定液中24 h,采用石蜡包埋后切片4 cm ,进行苏木精-伊红(HE)染色和Masson三色染色。观察各组标本中成纤维细胞、新生毛细血管以及炎性细胞浸润情况。

2 结 果
2.1 实验动物存活率对照组动物在造模过程中未出现死亡,实验组死亡1只,于手术后第2天死亡,该组存活率为87.5%,死亡动物解剖发现腹腔有肠内容物,考虑死亡原因为肠内容物漏出导致的腹腔感染。
2.2手术时间实验组的手术时间为(36.9±3.8)min,对照组相应控制关腹时间为37 min。
2.3术后液体情况对照组术后3 d的饮水量比实验组更多,但差异无统计学意义(P>0.05)。拔管后24 h饮水量较造模术后增多(P<0.05)。见表1。
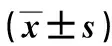
表 1 实验兔术后指标比较Table 1 Postoperative indicators of the two groups
2.4窦道形成评估拔除T管后可见腹壁瘘口有蓝色物质排除,证明腹壁瘘口与消化道相通。
2.5血清指标实验组和对照组在术后14 d的血清总蛋白、血清白蛋白、血糖差异均无统计学意义(P>0.05)。
2.6形态学变化对照组1只动物的肠管与切口
处的腹壁轻微粘连,4只动物的肠管均无明显水肿及缺血。实验组见瘘口周围的肠管与腹壁紧密相连。周围肠管间轻度粘连,肠管轻度水肿,无明显血凝块及肠内容物。见图1。

a:内侧面(肠管侧); b:外侧面(皮肤侧)图 1 管状肠外瘘局部离体组织内外侧面的大体外观Figure 1 Gross appearance of the local isolated tissue inside and outside of the tubular intestinal fistula
2.7瘘口形态及组织学变化在HE染色的切片中可见明显的窦道结构,窦道内有坏死组织,管状瘘内口的肠管与腹壁紧密相连,窦道周围组织中存在成纤维细胞和毛细血管增生以及明显的炎症反应,见图2a。Masson染色可见窦道两侧肠管浆膜与腹膜之间有明显的粘连组织,胶原纤维排列紊乱。提示:管状瘘形成,瘘口周围的肠管与腹壁组织已形成稳定的纤维粘连,见图2b。

a:黑色虚线表示两侧窦道边界,红色实线框内为肠管与腹壁的粘连部位,红色虚线框内为窦道旁皮肤;b:黄色框内为窦道两侧肠管与腹壁的粘连部位,白色五角星为肠管浆膜与腹膜之间的粘连组织图 2 管状肠外瘘瘘口组织的HE染色和Masson染色Figure 2 HE staining and Masson staining of fistula tissue in tubular intestinal fistula
3 讨 论
管状肠外瘘是最常见的肠外瘘,约占2/3,外科手术是最主要的直接致瘘原因,而这些患者接受手术治疗的原因多为肿瘤或者创伤[2]。这些患者通常需要进一步放化疗或康复治疗,一旦发生肠瘘患者往往要经过漫长的引流、控制感染、营养支持、多学科密集的护理甚至是外科手术治疗,这将会显著影响患者原发疾病的治疗进程。肠外瘘常好发于小肠,亦难以通过转流手术建立肠内营养。针对管状肠外瘘,临床上常通过纤维蛋白胶和富血小板血浆等医用凝胶进行封堵以恢复肠道的连续性,但受限于其自身机械强度、抗消化性能以及制备成本,患者往往需要进行多次封堵,给患者带来巨大的精神压力和经济负担。由于目前缺乏管状肠外瘘的动物模型,许多生物化学胶水无法直接应用于管状肠外瘘患者。因此,管状肠外瘘动物模型制备对研究管状肠外瘘病理机制与治疗极为重要。
在既往的研究中通常通过小肠或结肠造口的方法来模拟肠外瘘,但这种急性手术的方法难以模拟管状瘘逐渐发生的病理过程[10,13]。陈怀仁等[9]曾通过部分切开犬的回肠并将其置于腹壁来模拟“感染型”肠瘘,但这种方法的动物死亡率高,疾病发生过程随机性大,无法建立稳定的窦道,难以模拟管状肠外瘘的病理生理特征。本研究的造模方法可以使肠管与腹壁形成稳定、紧密连接的窦道,能够很好的模拟管状瘘的病理生理过程,同时具有较高的动物存活率,此外,还能通过调整不同T管的型号以制备不同窦道直径的动物模型。
本研究通过在兔的回肠处留置T管成功构建了兔管状肠外瘘动物模型,平均手术时间为37 min,实验组动物模型的存活率为87.5%,与对照组相比,实验组术后饮水量及营养指标无明显差异,拔管后24 h平均肠液漏出量为191.67 mL,与持续麻醉回肠末端双腔造口后肠液漏出量一致[14]。死亡动物解剖发现腹腔有部分肠内容物,考虑其在放置T管时肠管损伤较严重,致使缝合张力较大,导致术后肠管缝线处撕裂,最终死于严重腹腔感染,这提示我们在留置T管时要避免损伤肠管,手术操作要稳定轻柔,同时,可以选择12号的T管,降低放置难度,此外,在模型建立过程中需注意缝合前用等渗盐水润湿缝线,缝合打结时亦要注意力度。在建模过程中除了要注意手术技巧外,还需要注意围手术期的管理[15]。由于兔子的肠道较长、造模手术属于污染手术且术后需要动物至少存活2周,在术前需要充分的禁食和禁饮,术中、术后给予抗生素,术后前3天仅喂食糖水,逐步增加喂食量。
本研究结果表明,通过规范的手术操作及严格的围手术期管理,将T管留置于兔的回肠可以较好的模拟管状肠外瘘的病理特征,本模型制备的可控性强,能做到统一化建模,使腹壁瘘口与消化道形成稳定的窦道,同时,具有较低的动物死亡率,可以为管状肠外瘘的临床治疗提供理论基础。

