树突状细胞(DCs)交叉递呈疫苗抗原分子途径研究进展
杨苏珍,刘运超,尚延丽,张改平,2,3*
(1.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;2.河南农业大学 牧医工程学院,河南 郑州 450000;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
探索抗原递呈和免疫应答的分子机制,研制安全、高效的猪用疫苗和佐剂,做好猪病防控对稳定生猪养殖业健康发展和肉类食品供应具有重要意义。理想的疫苗应该在保证安全的前提下,同时激活体液免疫反应和细胞免疫反应,进而产生快速而持续的免疫保护。疫苗免疫动物机体后通过固有免疫系统和适应性免疫系统做出免疫应答,起到免疫保护作用。固有免疫系统包括单核/巨噬细胞、天然杀伤细胞(NK)、树突状细胞(dendritic cells,DCs)、粒细胞和先天类T细胞等。这些免疫细胞在激活后可直接执行免疫清除作用或通过分泌细胞因子,如IFN-g等,在刺激体液免疫应答和免疫调控中发挥重要作用。DCs是专职抗原递呈细胞(antigen presenting cells,APC),能有效地诱导CD8+T淋巴细胞的免疫应答。通常,外源抗原经过DC细胞递呈的MHCⅡ途径可激活体液免疫应答,经过交叉递呈MHCⅠ途径,外源抗原能够激活细胞毒性T淋巴细胞( cytotoxic T lymphocytes,CTL)起到清除感染细胞的作用。现从疫苗设计角度对猪树突状细胞(DCs)介导的交叉递呈外来抗原的分子机制进行综述。
1 DCs介导的抗原交叉递呈概述
DCs是目前已知功能最强大的APC,它能高效地摄取、加工处理和递呈抗原,成熟DCs能有效激活初始T细胞,处于启动、调控、并维持免疫应答的中心环节[1]。通常情况下,内源性抗原,如病毒感染宿主细胞产生的病毒抗原以及细胞基因突变后产生的肿瘤抗原等,被DCs摄取后进入主要组织相容性复合体Ⅰ(major histocompatibility complexⅠ,MHCⅠ)递呈途径,刺激CD8+T细胞活化,成为细胞毒性T淋巴细胞(CTL),直接参与病毒清除。外源性抗原,如灭活疫苗和亚单位疫苗中的蛋白抗原,经DCs处理后通常会通过主要组织相容性复合体Ⅱ(major histocompatibility complexⅡ,MHCⅡ)递呈途径,结合MHCⅡ的多肽抗原可以被抗原特异性CD4+T细胞识别,激活辅助性T细胞(helper T cells,Th),启动B细胞免疫应答[2]。但是,在某些情况下,外源性抗原可以进入MHCⅠ类分子递呈途径,激活CD8+T细胞,启动CTL反应,这一递呈途径被称为抗原交叉递呈(cross-presentation)[3]。交叉递呈对外源性抗原激活CTL,促进B细胞和T细胞免疫协同应答,进而引发抗肿瘤、抗病毒免疫反应有重要意义。
抗原通过经典的抗原递呈途径和交叉递呈会分别启动不同的免疫应答模式,两种递呈途径的分子机制也存在较大差异[4]。经典MHCⅡ抗原递呈途径,内化的抗原分子在内体(endosome)或溶酶体内被蛋白酶(如组织蛋白酶)降解成多肽。新合成的MHCⅡ分子通过与不变链(invariant chain,Ii,CD74)结合保持稳定,并从内质网被转运到内体或溶酶体隔室,Ii被溶酶体内蛋白酶降解为CLIP(与MHC类分子稳定相联的最小的Ii片段),MHCⅡ分子与CLIP结合。随后,来自于抗原加工的多肽在伴侣蛋白HLA-DM(human leukocyte antigen DM)的协助下取代CLIP与MHCⅡ结合,进而展示在细胞表面,激活Th细胞,主要参与B细胞免疫应答[5-6]。在交叉递呈途径,外源性抗原通过进入细胞后以另一种方式进行加工和递呈,激活CD8+T细胞免疫应答。
许多细胞能够递呈外源抗原到MHCⅠ类分子激活CD8+T淋巴细胞,但DCs是最主要的交叉呈递细胞[8]。DCs分为传统的DCs(classic or tissue-resident DCs,cDCs)和浆细胞样DCs(plasmacytoid DCs,pDCs),cDCs进一步被分为cDC1和cDC2[9]。在小鼠和人体内,cDC1以趋化因子受体XCR1的表达为特征,其发育依赖于转录因子IRF8和Batf3的表达,而cDC2的发育主要受IRF4的调控[10]。cDC1被认为是一种高效的交叉呈递细胞,小鼠cDC1表达CD8(在淋巴组织中)或CD103(在非淋巴组织中),而人类cDC1表达BDCA-3(CD141)。因此,在小鼠淋巴组织中,和细胞相关的可溶性抗原通过驻留在淋巴组织的CD8+DCs交叉递呈,而在肺、肠道和皮肤的抗原则通过迁移的CD103+DCs实现交叉递呈[11]。
单核细胞来源的DCs(monocyte-derived DCs,MoDCs)也称为炎性DCs,在疫苗刺激的获得性免疫应答中发挥重要作用。在动物的外周血、肌肉和皮下组织中含有大量的单核细胞,这些单核细胞可以分化为向CD4+和CD8+T细胞呈递抗原的MoDCs[12]。在缺乏炎症的情况下,肠道、肌肉和皮肤等外周组织中也发现了MoDCs,研究显示MoDCs表达转录因子ZBTB46[13]。在病原体诱导或疫苗接种的情况下,募集到炎症部位的单核细胞原位分化成表达CD11c、MHCⅡ/Ⅰ等的MoDCs,发挥抗原递呈或交叉递呈作用,启动获得性免疫应答反应[14]。MoDCs可以进行交叉递呈和MHCⅡ限制性递呈,并且可以根据炎症环境诱导Th1、Th2或Th17应答[15]。有研究显示,在疫苗接种环境中,MoDCs促进抗原特异性T细胞产生和滤泡辅助性T细胞分化,在特异性免疫应答和免疫记忆中发挥重要作用[16]。在体外,血液中的单核细胞在粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)和白细胞介素4(IL-4)的共同刺激下分化成MoDCs,表面标志物为CD1、CD14、CD16、CD80/86、CD1721、MHCⅠ和MHCⅡ等[12,17]。高效的疫苗能够通过诱导交叉递呈同时激活T细胞免疫应答和B细胞免疫应答,充分理解DCs介导的交叉递呈分子机制,对理解疫苗的起效机制,开发高效的猪用疫苗和佐剂具有重要的指导意义。
2 MoDCs交叉递呈外源性抗原的途径
交叉递呈外源性抗原的分子途径主要有内体-胞质途径(endosome-to-cytosol pathway)、液泡途径(vacuolar pathway),以及缝隙连接途径(gap junction pathway)[18]。
2.1 内体-胞质途径内体-胞质途径是最早被发现的抗原交叉递呈途径,颗粒性抗原通过巨噬细胞诱导的CD8+T细胞反应依赖于蛋白酶体、抗原加工相关转运体(transporter associated with antigen processing,TAP)和内质网-高尔基体转运通路,但是不依赖溶酶体[19-20]。这一通路也参与可溶性抗原的交叉递呈[21]。在内体-胞质途径中,外源抗原被DCs内化形成吞噬泡,吞噬泡与早期内体融合,抗原在转运复合体SEC61协助下从内体转运到细胞质溶液中,并在细胞质内被蛋白酶降解成多肽[22]。事实上,在抗原由内体转运到胞质之前先进行了去蛋白折叠和部分水解。抗原一旦定位于胞质内,就会被泛素化进而靶向蛋白酶体。随后,这些多肽被TAP转运到内质网或者回到内体,并在内质网或内体中被装载到MHCⅠ,随后MHCⅠ多肽复合体被转运到DCs表面[23]。被转运到内质网的多肽在内质网与MHCⅠ结合,随后经内质网-高尔基体途径转运到高尔基体,并从高尔基体转运到细胞膜。但是被转运回到内体的多肽在内体与来自内质网的MHCⅠ结合,并最终被转运到细胞膜(图1)[24]。尽管有大量证据显示,某些抗原确实可以不依赖于蛋白酶降解和TAP介导的肽转运而通过液泡途径进行抗原交叉递呈,但是大部分的交叉递呈都是通过内体-胞质途径实现的[25]。
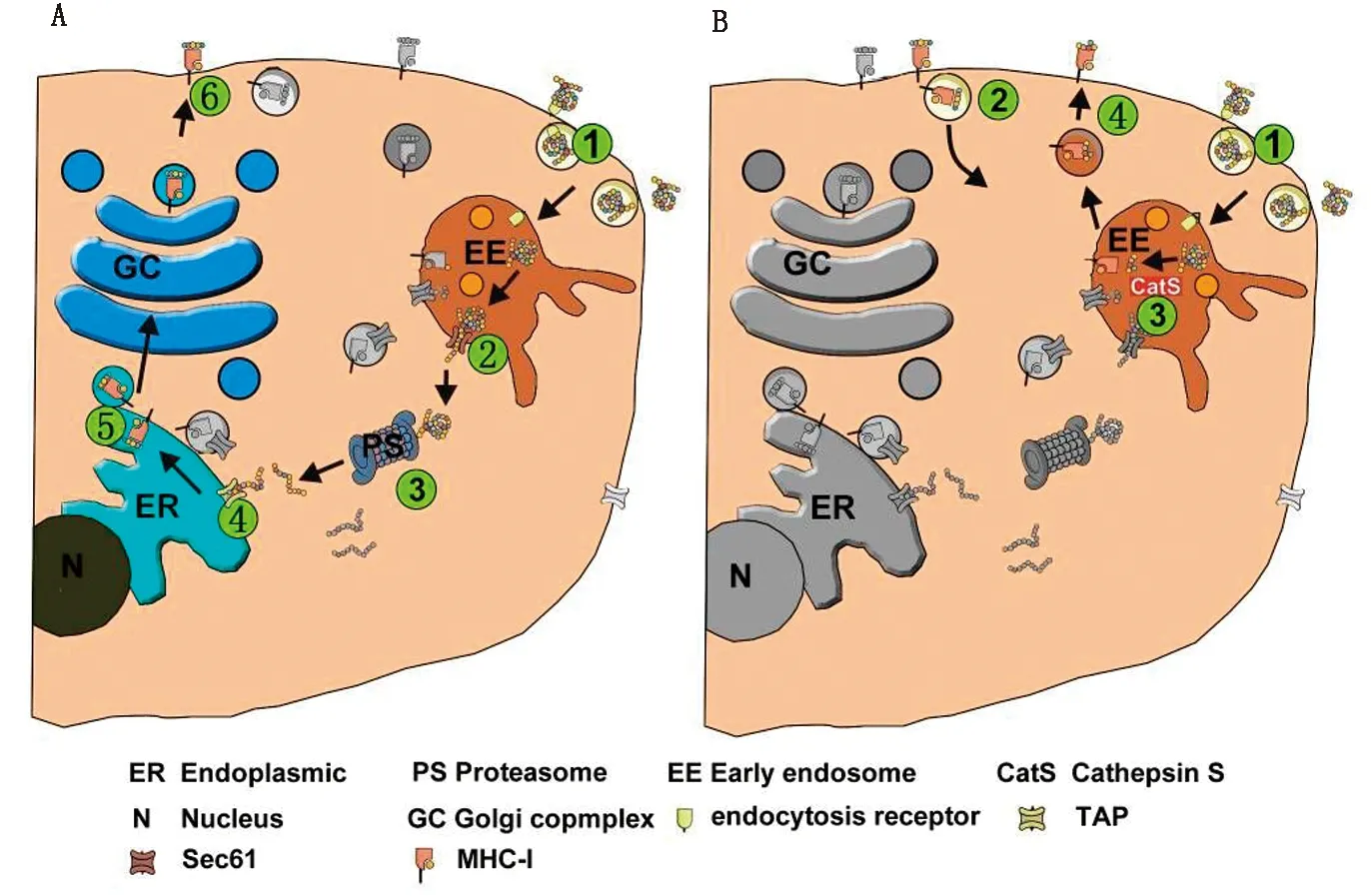
A.MoDC细胞经液泡途径交叉递呈抗原示意图;B.MoDC细胞经内体-胞质途径交叉递呈抗原示意图
2.2 液泡途径除了内体-胞质途径,还存在另一种对蛋白酶抑制剂和TAP抑制剂不敏感的途径,不依赖于胞质的抗原降解活性,即液泡途径。在液泡途径中,抗原被DCs吞噬,进入内体,随后在内体中被组织蛋白酶(cathepsin S,Cat S)降解成短肽片段,短肽片段被装载到细胞表面的MCHⅠ,最后MCHⅠ-多肽复合体通过早期内体相关的液泡转运到DCs表面。抗原的加工和装载于MHCⅠ分子发生在内体或溶酶体区。在液泡途径中,由于内体和蛋白酶体的水解作用能够被亮抑蛋白酶肽(leupeptin)、半胱氨酸蛋白酶抑制剂E-64和蛋白酶抑制剂Z-FA-FMK所抑制,因此这种水解作用被认为是半胱氨酸酶在发挥作用,尤其是Cat S;相反,蛋白酶抑制剂胃蛋白酶A对液泡交叉递呈的影响很小[3]。液泡途径在颗粒性抗原和细胞相关抗原的交叉递呈中发挥重要作用,包括那些重组融合蛋白、多聚物修饰形成的聚合蛋白和VLPs等,以及非颗粒性抗原,如OVA抗原和肿瘤来源的多肽抗原等[11]。随着猪瘟E2蛋白亚单位疫苗、猪伪狂犬亚单位疫苗和口蹄疫病毒病毒样颗粒疫苗等通过上市或临床试验审批,基因工程亚单位疫苗成为未来猪病疫苗的一个重要研发方向,深入研究抗原交叉递呈的液泡途径对开发新型猪用基因工程亚单位疫苗具有重要意义。
2.3 缝隙连接途径另有一种研究较少的交叉递呈途径,缝隙连接途径(gap junction pathway),受病毒感染或者病变细胞的抗原多肽分子通过缝隙连接进入DCs的胞质,并被转运到粗面内质网与MHCⅠ结合,随后被转运到细胞表面[26]。细胞间的缝隙连接由高度有序化的Cx43组成,是重要的细胞通讯方式,允许细胞间各种分子交换,缝隙连接途径主要递呈来自相邻细胞的抗原[27]。
DCs交叉递呈激活CTL的过程对抗病毒和抗肿瘤免疫治疗至关重要,抗原交叉递呈能够激活抗原特异性CTL,这些CTL向感染部位迁移后具备杀死潜在靶细胞的能力,例如病毒感染细胞和肿瘤细胞。在当前生猪养殖业面临巨大疫病防控压力的情况下,利用猪抗原交叉递呈的分子机制或为非洲猪瘟等重大动物疫病疫苗设计的关注点。
3 影响抗原递呈的因素
DCs的交叉递呈存在多种机制,抗原进入DCs方式和抗原在内体的定位是影响抗原交叉递呈的重要因素。DCs内吞抗原是抗原递呈的开始,内吞效率在免疫应答调节中扮演重要角色。不同的内吞机制决定了抗原降解的差异,导致抗原递呈效率差异。研究显示,用来内化抗原的内吞作用受体决定了抗原的内吞路线和降解途径[28]。由胞饮作用或清道夫受体介导的抗原内化后迅速靶向溶酶体,被溶酶体蛋白酶有效降解,导致抗原交叉递呈降低。然而,如果由DCs通过甘露糖受体(mannose receptor,MR)内化相同的抗原,则其靶向的是一个不同的早期内体池,这些内体不与溶酶体快速融合,且抗原在内体中受到保护不被降解,从而导致甘露糖受体内化抗原的有效交叉递呈[29]。
3.1 抗原进入DCs的方式抗原进入DCs的方式对抗原递呈有着重要的影响。通常情况下,细胞的内吞作用可以分为吞噬作用(phagocytosis)和胞饮作用(pinocytosis)。在哺乳动物中有3种白细胞具有吞噬作用,它们是巨噬细胞、嗜中性粒细胞(neutrophils)和DCs,这些细胞能通过吞噬作用吞噬侵入机体的病原微生物。胞饮作用发生在几乎所有的真核细胞中,是一种快速的内吞作用。细胞胞饮作用的内吞机制可以分为4种:(1)网格蛋白型内吞途径(clathrin-dependent endocytosis,CDE);(2)小窝蛋白依赖的内吞途径(caveolae-dependent endocytosis,CaDE);(3)网格蛋白、小窝蛋白非依赖型内吞途径(the non-clathrin-,non-caveolae-dependent pathways)和(4)巨胞饮作用(macropinocytosis)[30]。药理阻断是研究细胞内吞作用的常用方法,许多药物可以阻断细胞内吞作用,针对细胞内吞方式的认知主要来自药物阻断的研究成果。氯丙嗪 (chlorpromazine,CPZ)可引起网格蛋白网络在内体膜上的组装并阻止细胞内表面上的被膜小窝组装,进而抑制网格蛋白介导的内吞作用,因此常被用来研究网格蛋白在某种抗原内吞过程中的作用[31]。同样,甲基-β-环糊精(MβCD)、制霉菌素等可通过减少或隔离胆固醇抑制脂筏/胞膜窖介导的内吞作用[32];盐酸阿米洛利(amiloride)可通过抑制Na+/H+交换,进而抑制巨胞饮作用[33];细胞松弛素D(cytochalasin D)可通过抑制肌动蛋白的聚合反应,从而抑制吞噬作用和巨胞饮作用;Dynamin作为一种GTPase对包括CDE、CaDE以及网格蛋白和小窝蛋白独立的内吞作用途径都是必不可少的,而Dynasore(C18H14N2O4)可通过抑制动力蛋白Ⅰ和Ⅱ的GTP酶活性抑制Dynamin依赖的内吞途径[33]。不同种类的抗原,甚至同一类抗原因聚集形态、电荷分布等的差异也会引起内吞方式和效率的不同,进而引起交叉递呈和免疫应答的差异。
3.2 抗原在DCs的定位抗原在DCs的定位对抗原递呈有着重要的影响。内体是抗原的储藏室,抗原在内体的稳定性以及内体本身的稳定性都对抗原递呈和免疫应答强度有着重要的影响。内体是细胞内吞作用运载途径的一个区室,提供了细胞外物质进入细胞内的运载途径[34]。很多病毒抗原首先与细胞膜吸附,其后被细胞内吞囊泡包裹进入细胞与内体融合,进入抗原递呈途径。不同时期内体的超微结构、密度、pH、所含酶类、MHC分子浓度存在差异。根据细胞内吞作用的不同时间阶段,可以将内体分为早期内体(early endosome)、晚期内体(late endosome)以及再循环体(recycling endosome)。一旦在内吞作用中的囊泡被释放,它们首先与初级内体融合,之后再成长为次级内体并与溶酶体融合。初级内体成长形成次级内体,其酸度通过V-ATPase的活动而增加,其大小通过融合同类型的内体成为更大的囊泡而增加,次级内体或以多泡体(multivesicularbody,MVB)的形式呈现。最终,次级内体释放RAB5而获取RAB7,为其与溶酶体的融合做好准备[35]。早期内体包含囊泡-小管网络,囊泡的直径可大至1 μm,周围连接着直径大约50 nm的小管。标记物包括运铁蛋白RAB5,RAB4和它的运铁蛋白受体以及EEA1。晚期内体也被称为多泡体,形态为球形,管状结构较少,主要包含密集的空腔状囊泡,标记物包括RAB7,RAB9以及M6P受体[3]。再循环内体主要集中在微管组织中心,包含管网结构,标记物为RAB11。
3.3 抗原的驻留时间抗原的降解过程影响抗原交叉递呈效率。抗原的快速降解会在抗原被适当的加工和装载到MHCⅠ之前其表位被迅速而大量的破坏[36]。此外,负载多肽的MHCⅠ分子在细胞膜上的寿命有限,因此,使DCs在向淋巴结迁移后能够持续而高效的活化T细胞,持续的向DCs表面转运MHCⅠ抗原复合物,同时延长复合物在DCs表面展示的时间对CTL激活非常重要[37]。在小鼠的CD8a+DCs中,转录因子EB(transcription factor EB,TFEB)可以促进溶酶体的成熟和溶酶体蛋白酶活化,是交叉递呈的重要负向调控因子。因此,APC中限制抗原降解可能是一种产生细胞内抗原库的机制[38]。这种机制确保了抗原库(溶酶体或内体)中的抗原可以被持续加工和呈递,进而保证负载多肽的MHCⅠ分子在细胞表面较长时间的存在,保证对T细胞的连续刺激。这种细胞内抗原储存库也出现在人类单核细胞中,这些长肽段抗原可以在单核细胞的非溶酶体间室中积累超过5 d而不会迅速降解[39]。
4 展望
我国养猪业的疫情防控形势复杂严峻,新型疫苗研发如火如荼,但目前对疫苗抗原分子交叉递呈途径研究的针对性和系统性不足,导致T细胞疫苗研究缺乏理论指导和技术支撑,影响疫苗免疫效力的提升和新型疫苗产品的开发。随着外源性抗原交叉递呈分子途径及相关影响因素研究的深入,对于疫苗抗原经MoDC细胞交叉递呈的途径和影响T细胞免疫激活相关因素的认知逐渐丰富,为疫苗T细胞免疫效力提升和新型亚单位疫苗的开发提供了新的思路。DCs交叉递呈异源抗原分子是疫苗抗原启动T细胞免疫应答的主要途径,深入理解抗原交叉递呈分子机制和影响因素,对设计T细胞疫苗抗原,促进疫苗在诱发体液免疫和细胞免疫方面的协调作用,具有重要的指导意义。近年来,猪细小病毒病毒样颗粒疫苗(PPV VLPs)[40-41]、猪圆环病毒(PCV)亚单位疫苗、犬细小病毒[42]和禽法氏囊病毒亚单位疫苗[43]等新型亚单位疫苗的研究发展迅速,开展疫苗抗原交叉递呈途径的探索性研究对高效疫苗抗原设计和疫苗产品开发具有重要指导意义。

