绿原酸对镉致三黄鸡肾脏损伤的保护效应
白玉妮,原俊朝,邹 辉,顾建红,袁 燕,刘学忠,刘宗平,卞建春*
(1.扬州大学 兽医学院,江苏 扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
镉(cadmium,Cd)多与氧、氯、硫等元素形成无机化合物广泛分布于自然界中,是一种对动物机体具有剧毒作用的重金属元素。由于Cd具有质软、延展性好且耐腐烛等理化特性,被广泛应用于电镀、电池、塑料、化妆品、涂料、颜料及防腐等的生产过程中,由此产生的Cd对环境的污染问题也引发了人们的广泛关注[1]。Cd在机体内不能被降解,在人体中的生物半衰期为10~30年,其排泄率极低[2]。Cd进入机体后首先会在肝脏和金属硫蛋白(MT)结合形成Cd-MT复合物,然后通过血液循环,经肾小球滤过作用,最终被肾小管重吸收,在溶酶体中被降解,释放出游离Cd[3]。但Cd引起肾脏损伤并不完全依赖于Cd-MT复合物,即无机Cd也可引起肾损伤,且损伤程度要比Cd-MT复合物更为严重[4-5]。此外,Cd具有致癌、致畸、肾毒性、生殖毒性以及骨骼损伤等多种毒性作用[6-7]。其毒性作用可以使家禽生产性能降低,具体表现为产蛋量下降、产软壳蛋、料肉比增高、骨质疏松、关节炎,以及死亡率增加等[8]。有学者以氯化镉(CdCl2)饲喂鸡8周后,观察Cd在各器官中积累量之后发现,Cd在肾脏中残留最高[9]。虽然Cd的毒理机制尚未明确,但根据文献报道,Cd可以通过诱导氧化应激、凋亡、自噬、钙平衡失调、DNA甲基化以及干扰DNA修复系统等多种机制对细胞产生有害影响[10]。其中,氧化应激被认为是Cd诱导细胞损伤最重要的机制[11]。
绿原酸(chlorogenic acid,CA)又称为咖啡鞣酸、咖啡单宁酸,是由咖啡酸(caffeic acid)的1位羧基与奎宁酸(quinic acid)的3位羟基脱水缩合形成的一种多酚类物质[12]。研究发现CA有抗炎、抗菌、抗病毒、抗肿瘤、肝肾保护、抗氧化等广泛的作用,被誉为植物黄金[13-15]。有报道指出,CA可以通过抑制氧化应激、细胞凋亡、炎症和自噬保护肾脏[16]。因此,本研究以扬州三黄鸡为研究对象,探讨CdCl2致肾脏毒性机制以及CA在Cd致肾毒性中的保护作用,为防治Cd中毒提供潜在药物选择。
1 材料与方法
1.1 实验动物1日龄健康扬州本地三黄鸡96只,由江苏省家禽研究所提供。所有实验操作均按照国家研究委员会《实验动物护理与使用指南》的建议进行,并经扬州大学动物护理与使用委员会批准(批准ID:202012-201)。
1.2 主要试剂CA(国产分析纯);氯化镉·(五水合物)(CdCl2·5H2O);丙二醛 (MDA)、还原性谷胱甘肽 (GSH)、谷胱甘肽过氧化物酶 (GSH-Px)、过氧化氢酶 (CAT)和超氧化物歧化酶 (SOD)检测试剂盒(南京建成生物工程研究所);BCA蛋白质量浓度测定试剂盒(碧云天生物技术有限公司);标准蛋白(新赛美生物科技有限公司)。
1.3 动物分组与处理将24只健康扬州本地三黄鸡于安静清洁干燥的环境(室温30℃,湿度为70%左右)预饲养7 d,预饲养后测量体质量并将其随机分为4组,分别为对照组(Con组)、Cd组(含70 mg/kg CdCl2的基础日粮)、CA组(含400 mg/kg CA的基础日粮)、Cd+CA组(含70 mg/kg CdCl2和400 mg/kg CA的基础日粮),试验期间自由饮水。处理30 d后颈静脉放血致死,采集血液至15 mL 离心管。剖检取出肾脏,分离肾脏皮质,分离肾脏背膜,从肾脏剥离出皮质并剪碎,放入冻存管中,-80℃保存。
1.4 肾组织中Cd含量的测定取湿重500 mg的肾脏样品80℃烘干48 h后,放入研钵磨碎,取100 mg 加入4 mL优级硝酸溶解,采用微波消解法消解样品。消解好的溶液放入赶酸仪中赶酸至1 mL 后用超纯水定量至10 mL。利用电感耦合等离子体质谱仪测定肾皮质中Cd的含量。
1.5 血液中肾功能相关生化指标的测定采集血液,2 500 r/min离心10 min后取上层血清,用全自动生化分析仪检测血液中肌酐(CREA)、尿酸(UA)含量。
1.6 病理切片制作与HE染色将分离的肾脏在固定液中浸泡24 h,取出后用手术刀进行切割,使用脱水机进行梯度酒精脱水、二甲苯透明,石蜡浸泡并包埋。用切片机切片后滴加30%酒精后移入40℃恒温水浴使其完全展开,再贴附于载玻片上,用烤片机烘干。经二甲苯脱蜡、蒸馏水漂洗后,分别用苏木素染色、盐酸酒精分色、自来水冲洗、氨水返蓝、伊红染色、酒精脱色脱水、二甲苯透明,最后用中性树胶封片,在光学显微镜下观察。
1.7 肾皮质氧化应激相关指标的测定测定肾脏皮质内GSH、MDA含量和GSH-Px、SOD、CAT活性,根据南京建成生物工程研究所检测试剂盒的说明书进行操作。
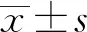
2 结果
2.1 CA和Cd对鸡肾皮质中Cd含量的影响结果如图1所示,与对照组相比,Cd暴露后肾皮质中Cd含量极显著升高(P<0.01),与Cd组相比,CA组和Cd+CA组肾皮质Cd含量均极显著降低(P<0.01),对照组和CA组之间肾脏Cd含量无显著差异(P>0.05)。
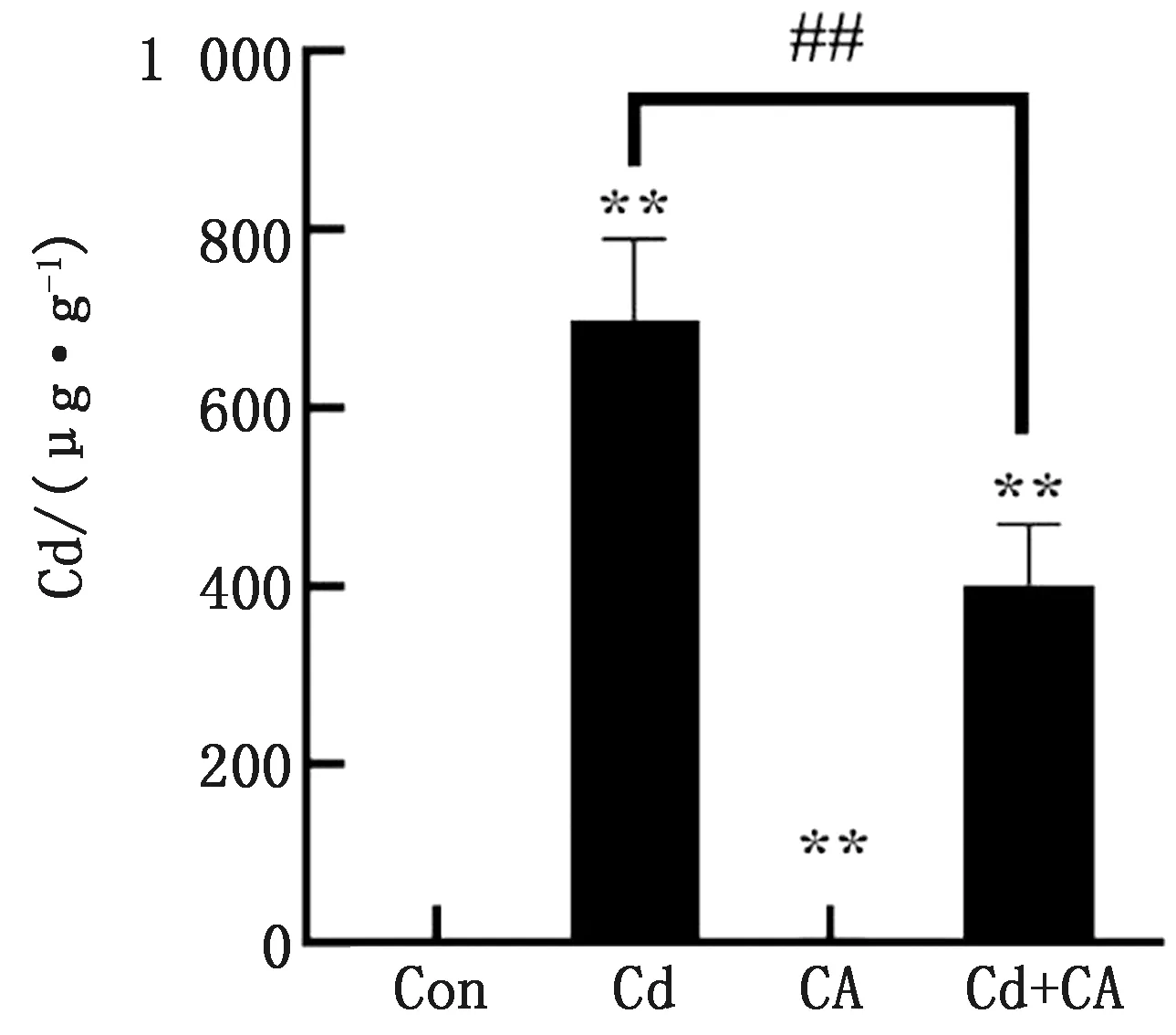
与Con组相比,*表示P< 0.05,**表示P< 0.01;与Cd组相比,#表示P< 0.05,##表示P< 0.01。下同
2.2 CA和Cd对鸡肾脏组织病理学的影响结果如图2所示,对照组(图2A)和CA组(图2C)鸡肾组织染色均匀,肾小球形态结构未见明显异常;Cd组(图2B)大鼠肾组织可见较多肾小管上皮细胞颗粒变性,管腔增大(白色箭头),胞质疏松淡染,蛋白管型增多;与Cd组相比,Cd与CA共处理组(图2D)病变有所减轻,肾小球形态结构未见明显异常,肾小管上皮细胞颗粒变性(白色箭头)、胞质疏松淡染(红色箭头)、蛋白管型(黄色箭头)等有所缓解。说明CA可以缓解Cd中毒引起的鸡肾脏损伤。
2.3 CA和Cd对鸡血清中肾功能相关指标的影响结果如图3所示,与对照组相比,Cd组血清中CREA和UA含量均极显著升高 (P<0.01);与Cd组相比,Cd+CA组CREA和UA均极显著降低(P<0.01),对照组和CA组之间CREA和UA含量无显著性差异(P>0.05)。
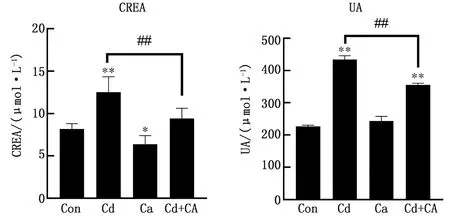
图3 CA和Cd对鸡血清中肌酐、尿酸的影响
2.4 CA和Cd对鸡肾脏氧化指标的影响如图4所示,与对照组相比,Cd组肾皮质中MDA和GSH 含量极显著升高(P<0.01);SOD、GSH-Px活性极显著降低(P<0.01),CAT活性显著降低(P<0.05),与Cd组相比,Cd+CA组MDA和GSH含量极显著降低(P<0.01),SOD、GSH-Px活性极显著升高(P<0.01),CAT活性显著升高(P<0.05);对照组和CA组之间MDA、GSH、SOD、GSH-Px、CAT含量无显著性差异(P>0.05)。提示CA缓解了Cd中毒引起的鸡肾脏的氧化损伤。

图4 CA和Cd对鸡肾脏抗氧化酶活性的影响
3 讨论
作为一种蓄积性极强的重金属污染物,Cd可以通过呼吸道、消化道和皮肤等多种途径进入动物体内,造成机体多器官、多系统发生病变[17]。在实际生产中,畜禽主要通过食入被Cd污染的玉米、豆粕、肉骨粉等动植物饲料发生中毒。有研究者分别在1日龄海兰鸡日粮中添加35,70,140 mg/kg CdCl2饲喂90 d,建立鸡Cd中毒模型后发现,70 mg/kg CdCl2可以造成鸡小脑、心脏等多个器官的明显病变[18-19]。因此本研究选用70 mg/kg CdCl2拌饲的方式来探究Cd对三黄鸡肾脏的毒性作用,使研究更符合Cd实际接触情况。
肾脏是Cd毒性最重要的蓄积部位和主要靶器官,组织中Cd含量也可以在一定程度上反映机体内Cd负荷量[20],有研究表明,肾脏Cd含量安全域值为50 μg/g,超过该限制即可认为Cd接触已对肾脏产生危害[17,21]。本研究结果显示,Cd暴露后,肾脏中Cd的含量已大于600 μg/g,提示机体Cd负荷过高。HE结果显示,肾小管上皮细胞颗粒变性,胞质疏松淡染,呈空泡化,肾小管管腔增大,蛋白管型增多,说明重金属Cd对鸡的肾脏造成了损伤。最后,本试验检测血清中肾功能相关指标肌酐和尿酸的含量来进一步评估肾脏损伤状况,结果显示Cd暴露后鸡血清中肌酐、尿酸含量均不同程度呈现升高趋势,说明Cd可引起鸡肾脏功能受损。
越来越多的研究表明,氧化应激在Cd引起肾脏损伤的生物机制中发挥了重要作用[22],Cd进入机体后通过活化黄嘌呤氧化酶、血红色素氧化酶导致机体内产生大量的活性氧,扰乱细胞内氧化与抗氧化状态的平衡,使细胞内抗氧化酶活力下降,自由基生成增加并对细胞造成损害[23]。体内氧自由基毒性产物的清除有赖于SOD、GSH-Px、CAT等酶类抗氧化剂和GSH、维生素C、维生素E、微量元素等非酶类抗氧化剂的共同作用[24-25]。SOD可以专一清除生物氧化过程中的超氧阴离子自由基,被认为是抗氧化系统的第一道防线[26]。CAT作为一种抗氧化酶,其主要作用是清除体内H2O2,催化H2O2分解为H2O和O2,减少细胞的损伤[27]。GSH-Px为硒依赖性细胞内抗氧化酶,可以保护细胞膜的结构及功能不受过氧化物的干扰及损害。GSH含有丰富的非蛋白质硫醇,可以通过游离巯基与Cd形成复合物来改变Cd的分布和排泄,从而提供抗氧化防御功能。它还可以作为GSH-Px的底物,被催化为氧化型谷胱甘肽(GSSG)的同时清除H2O2与脂质过氧化物[28]。而MDA是脂质中的多不饱和脂肪酸与ROS作用而形成的一个重要产物,其含量间接反映机体内自由基的多少并且可以作为衡量细胞膜磷脂氧化损伤程度的生物标志[29]。它们在活性氧的清除中发挥着各自的重要作用,所以这些指标均可以间接反映细胞氧化应激损伤的程度。本研究发现,Cd暴露后肾皮质中SOD、CAT、GSH-Px酶的活性呈现不同程度的降低,同时,MDA、GSH含量呈现升高趋势。与徐明畅等[30]的研究结果相一致。但GSH升高趋势与李静慧等[31]、张静等[32]的研究结果存在差异,可能是Cd抑制了CSH-Px的活力,从而限制了GSH向GSSG转化,造成了CSH的堆积[33],也可能是由于机体为了抵御Cd而造成的GSH代偿性增高[34]。
CA是植物有氧呼吸过程中经莽草酸途径产生的一种苯丙素类化合物。在杜仲科、忍冬科、蔷薇科等植物中含量较高,例如:杜仲、金银花、向日葵、咖啡和可可树等[12]。因其具有抗氧化、抗肿瘤、降血压、降糖、护肝等多种生物活性受到了诸多研究者的关注。有研究证实,CA具有清除ROS和抗脂质过氧化的作用,可以有效延缓肾脏损伤[35]。DING等[36]按每千克体质量30 mg CA给小鼠灌胃8周后发现,进入机体后的CA,部分以原型形式被胃和小肠吸收,然后在肠黏膜和肠道菌群的酯酶作用下水解为咖啡酸和阿魏酸。咖啡酸和阿魏酸具有优异的抗氧化活性,可提高SOD和CAT活性,改善Cd引起的肝肾损伤。本研究发现,相比于Cd组,加入CA后,肾皮质Cd含量明显降低,肾脏病理损伤有所减轻,且鸡血清中肌酐、尿酸含量明显降低,MDA和GSH的产生水平降低,SOD、CAT、GSH-Px活力含量显著增加,说明CA可以提升肾脏抵抗氧化应激的能力,有效缓解Cd引起的肾脏损伤。
综上所述,基础饲粮Cd暴露可对三黄鸡肾脏产生损伤,毒性机制可能仍与氧化损伤有关。本研究为CA在Cd所致的肾脏损伤中的应用提供了一定的理论依据,但仍需进一步阐明其保护途径和调控机制,有望能够在Cd致肾损伤的临床治疗中得到更广泛的应用。

