奶山羊不同组织来源干酪性脓肿中伪结核棒状杆菌的分离及毒力基因和耐药性检测
魏宇辰,王 斌,白新栋,王小园,王晨骁,王 娟,杨增岐
(西北农林科技大学 动物医学院,陕西 杨凌 712100)
伪结核棒状杆菌(Corynebacteriumpseudotuberulosis,C.pseudotuberulosis)为革兰阳性球杆菌,是一种兼性细胞内寄生菌[1],能够对多种动物和人造成感染,引发干酪性淋巴结炎[2](caseous lymphadenitis,CLA)。在诸多易感动物中,伪结核棒状杆菌对羊的感染和侵害最为普遍,羊感染后又称羊伪结核病,发病羊以体表下颌淋巴结、肩前淋巴结和腘淋巴结等处出现干酪性脓肿最为常见[3],由于该菌的理化性质和致病特点,在其对受感染羊只造成持久慢性损伤的同时,能够对健康羊群产生长久感染威胁,由此也为该菌的防制和净化带来困难,已成为威胁羊群健康和养殖场经济效益的顽固性病原之一。除体表型伪结核外,伪结核棒状杆菌还能引起内脏型和混合型干酪性淋巴结炎[4-5],但由于内脏型伪结核难于肉眼观察、羊群通常不开展伪结核棒状杆菌的血清学普查、超声和X线等诊断方法在羊病诊断中普及度较低等因素影响,内脏型伪结核多在屠宰过程和病死羊解剖时被发现,造成该病治疗延误且进一步增加羊群传播风险。
此外,关于伪结核棒状杆菌的生物分型,有学者提出根据硝酸盐还原反应可将该菌分为2种生物型[6],分别为硝酸盐还原反应阴性的生物I型(C.pseudotuberculosisbiovar ovis,羊种伪结核棒状杆菌)和硝酸盐还原反应阳性的生物Ⅱ型(C.pseudotuberculosisbiovar equi,马种伪结核棒状杆菌),且当前研究表明,羊源伪结核棒状杆菌均为羊种伪结核棒状杆菌[7]。我国当前对于羊内脏型和乳腺型伪结核以及病原菌生物型的报道较为少见。本研究从陕西关中地区奶山羊体表淋巴结、肺脏和乳腺组织成功分离到9株伪结核棒状杆菌,并对分离菌开展病原学研究和比较,能够进一步丰富羊伪结核病的研究资料,对研究羊伪结核病的防制和评估该病的公共卫生安全危害具有参考意义。
1 材料与方法
1.1 样品来源不同组织来源的9份干酪性脓肿内容物均采自陕西蓝田某养殖场中的9只奶山羊。
1.2 采样方法下颌淋巴结脓肿和乳腺脓肿样品的采集:经患处消毒后,均使用20 mL一次性无菌注射器刺入脓腔抽取内容物约2 mL,分装于无菌离心管中2 h 内低温运送至实验室;肺脏脓肿内容物样品来自2只4 h内死亡送检羊,解剖后肺脏表面消毒,使用无菌剪刀镊子采集干酪性脓肿组织。
1.3 主要试剂5%绵羊血琼脂培养基为实验室自制;硝酸盐还原反应试剂盒购自青岛海博生物(货号:HB8282);细菌DNA提取试剂盒购自天根生化科技(北京)有限公司;引物合成和基因测序由西安擎科泽西生物技术有限公司完成;2×Taq PCR Master Mix和DL2000 DNA Marker购自北京迪宁生物科技有限公司;抗生素标准品购自大连美仑生物技术有限公司;96孔微量反应板购自耐思生物科技有限公司;病理组织切片由西安依科生物技术有限公司制备;50只8周龄SPF小鼠(BALB/c)购自成都达硕实验动物有限公司。
1.4 组织涂片于载玻片上滴少许无菌生理盐水,使用无菌接种环蘸取少量脓肿内容物与生理盐水涂抹均匀,火焰固定后进行革兰染色,镜检。
1.5 细菌分离培养在超净工作台内使用无菌接种环蘸取少量脓肿内容物,3区划线接种于5%绵羊血琼脂培养基,倒置于电热恒温培养箱中(36±1)℃培养48 h,之后挑取单菌落接种于血琼脂培养基,使用相同培养条件进行纯化培养。
1.6 细菌16S rRNA基因PCR扩增和测序鉴定经纯化培养后,挑取单菌落,使用细菌基因组DNA提取试剂盒提取DNA,以提取的DNA为模板,使用细菌16S rRNA基因PCR扩增通用引物[8]27 F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492 R(5'-GGTTACCTTGTTACGACTT-3'),目的片段大小为1 465 bp,反应体系为20 μL,反应条件:94℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸1 min,共35个循环;72℃延伸10 min。
1.7 硝酸盐还原试验将培养物接种于5 mL硝酸盐肉汤, (36±1)℃培养72 h,加入对甲基苯磺酸溶液和α-萘酚乙酸溶液各2~3滴,混匀后观察结果,出现红色为阳性反应,不变色为阴性反应,如出现阴性结果,可再加入锌粉少许,若出现红色,则鉴定为阴性结果,若不变色则为阳性结果。
1.8 毒力基因PCR检测根据文献[9]所述的引物和PCR程序,以分离菌的DNA为模板,对整合膜蛋白(integral membrane protein,FagA)、铁肠菌素转运子(iron enterobactin transporter,FagB)、ATP结合胞质膜蛋白(ATP binding cytoplasmic membrane protein,FagC)和含铁细胞-铁结合蛋白(iron sidero-phore binding protein,FagD)进行基因检测[10],扩增产物条带大小分别为245,291,173,226 bp。磷脂酶D(phospholipase D,PLD)基因的PCR扩增,使用Primer Premier 5设计引物,上游引物为PLD-F:5′-ATAAGCGTAAGCAGGGAG-3′,下游引物为PLD-R:5′-GGTAGCCAGATGGTGAGTAG-3′,按常规PCR方法进行扩增,反应体系为20 μL,退火温度为55℃,扩增产物条带大小为611 bp。
1.9 动物致病性试验将分离的菌株使用含5%血清的BHI肉汤培养基扩增培养后,每一分离株使用无菌PBS溶液将菌液浓度调整至约106CFU/mL。将50只小鼠随机分为10组(n=5),9组试验组小鼠分别腹腔注射0.1 mL 9株分离菌菌液,对照组小鼠腹腔注射0.1 mL无菌PBS溶液,于注射后第7天处死并解剖小鼠,观察病理变化并制备病理切片。
1.10 药物敏感性试验选取青霉素(PEN)、万古霉素(VAN)、头孢噻肟(CTX)、庆大霉素(GEN)、环丙沙星(CIP)、红霉素(ERY)、四环素(TET)和复方新诺明(SXT)共8种药物,使用微量肉汤稀释法进行最小抑菌浓度(minimal inhibitory concentration,MIC)检测,培养基为含5%小牛血清的CAMHB肉汤,菌液浓度为0.48~0.56麦氏值,根据美国临床和实验室标准协会(clinical and laboratory standards institute,CLSI)文件中规定的伪结核棒状杆菌折点范围判定结果。
2 结果
2.1 组织涂片和菌落形态临床发病羊脓肿组织(图1)内容物经制片和革兰染色镜检后,可见单个散在或聚集存在的革兰阳性球杆状菌体,无荚膜和芽胞(图2A);脓肿组织内容物培养48 h后于血琼脂平板上可见乳白色、边缘较整齐、干燥易于刮落的菌落(图2B),挑取单菌落进行革兰染色和镜检,显微镜下可见与脓肿组织涂片中形态一致的菌体。
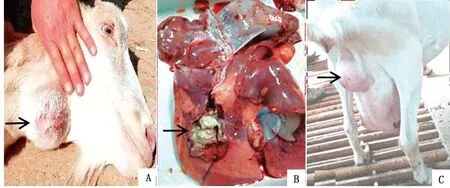
A.下颌淋巴结脓肿;B.肺脏脓肿;C.乳腺脓肿
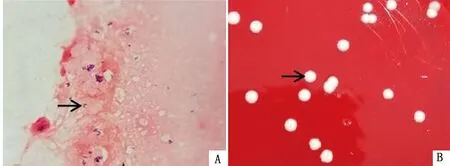
A.组织抹片镜检(1 000×,Gram);B.血平板培养单菌落
2.2 细菌16S rRNA基因的PCR扩增和测序鉴定PCR产物经1%琼脂糖凝胶电泳后,可见约1 465 bp的条带(图3),与预期大小一致,经16S rRNA基因测序和序列比对表明,分离的细菌均为伪结核棒状杆菌。将下颌淋巴结样品源菌株编号为X1~X5,肺脏样品源菌株编号为F1、F2,乳腺样品源菌株编号为R1、R2。
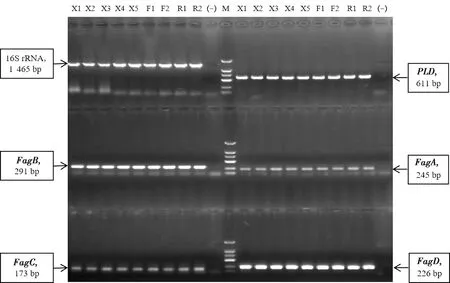
M.DL2000 DNA Marker;(-).阴性对照
2.3 硝酸盐还原试验所获得的9株羊不同组织来源的伪结核棒状杆菌硝酸盐还原反应均为阴性,表明分离的9株伪结核棒状杆菌均为羊种伪结核棒状杆菌(生物Ⅰ型)。
2.4 毒力基因PCR检测对分离菌的毒力基因PCR检测结果表明,分离的9株不同组织源伪结核棒状杆菌均携带PLD、FagA、FagB、FagC、FagD基因(图3)。
2.5 动物致病性试验试验组小鼠解剖后可见注射部位出现干酪样化脓灶。病理组织切片显微镜下可见肠系膜淋巴结出现急性淋巴结炎、淋巴细胞坏死和巨噬细胞浸润;肝脏可见肝索结构不清,肝窦内可见少量淋巴细胞和中性粒细胞;脾脏可见坏死性脾炎,白髓区局部坏死,易见巨核细胞(图4),对照组小鼠未见异常。
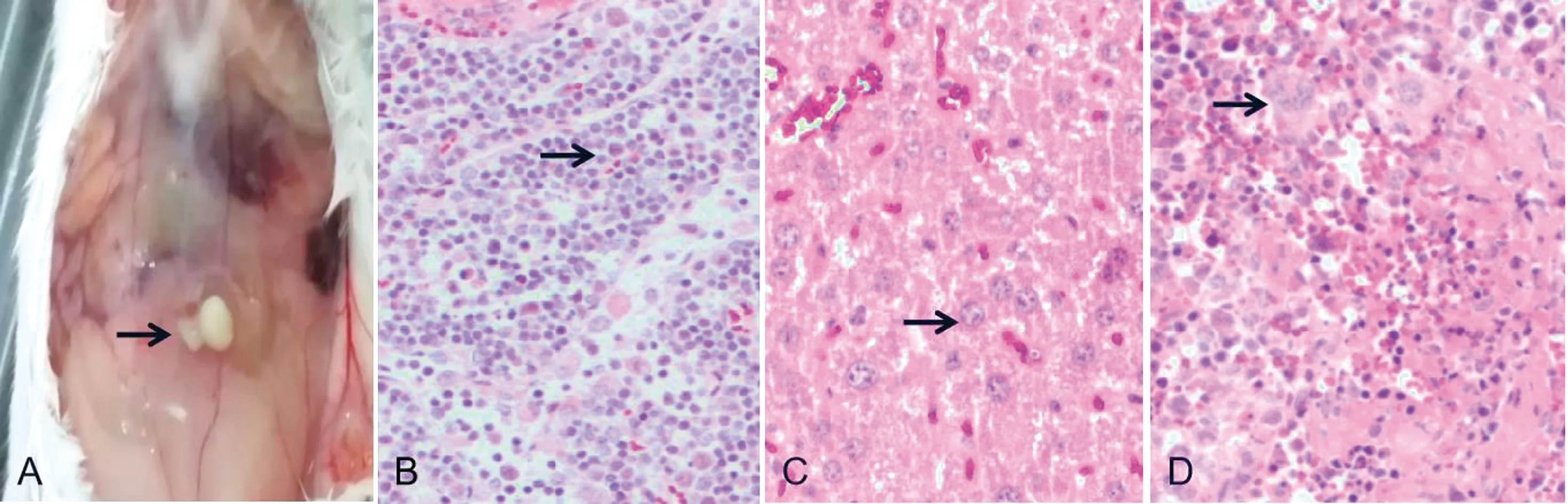
A.注射部位脓肿; B.肠系膜淋巴结(100×,HE); C.肝脏(100×,HE); D.脾脏(100×,HE)
2.6 抗生素敏感试验经过对9株分离菌进行MIC检测和结果判定,结果表明,分离菌对万古霉素、庆大霉素、环丙沙星、四环素和复方新诺明敏感率为100%,对青霉素只表现为耐药或中度敏感,对红霉素存在一定程度耐药,对头孢噻肟敏感或中度敏感,试验结果见表1,图5。
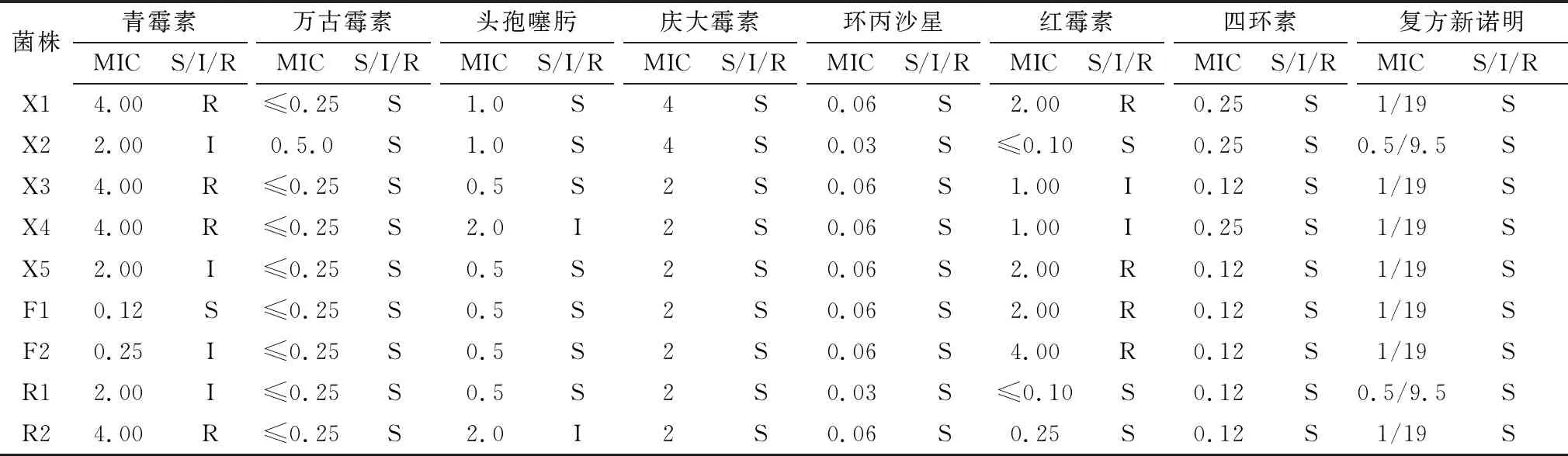
表1 分离菌MIC检测结果

图5 分离菌对不同药物的耐药性
3 讨论
羊源伪结核棒状杆菌的研究报道正在引起诸多专家学者的关注,本研究对同一养殖场来源的羊下颌淋巴结、肺脏和乳腺干酪性脓肿组织中病原菌进行分离鉴定,最终从9份样品中均分离到伪结核棒状杆菌,且对试验小鼠均有致病性,能够引起小鼠局部化脓性病变和淋巴结等组织炎性反应。在细菌分离鉴定过程中发现,脓肿组织来源的伪结核棒状杆菌在初次分离培养时生长缓慢,在血琼脂培养基中至少培养48 h才能出现较为明显的特征性菌落,因此,在初次分离培养时,应提供充足的培养时间。生物型鉴定结果显示,本次所获得的9株细菌均为羊种伪结核棒状杆菌,该结果与国外学者研究结果一致[6-7],进一步证实根据硝酸盐还原反应进行该菌生物分型的可行性。主要毒力基因鉴定表明,本研究中不同组织来源的伪结核棒状杆菌菌株携带的主要毒力基因类型一致,均携带PLD、FagA、FagB、FagC、FagD基因,本研究中未发现不同组织来源与毒力基因类型之间存在差异,AQUINO等[9]虽发现不同组织来源的伪结核棒状杆菌毒力基因类型存在差异,但在其研究的168株伪结核棒状杆菌中,同时携带该5种毒力基因的菌株占比高达95.23%(160/168),由此可以表明PLD/FagA/FagB/FagC/FagD为伪结核棒状杆菌的主要毒力基因型,能够为该菌的特异性基因诊断方法开发提供一定参考。耐药性研究结果表明,分离菌对青霉素和红霉素耐药率较高,对头孢噻肟有耐药趋势,临床用药应予以关注,其中,分离菌对青霉素耐药程度由高到低依次为下颌源、乳腺源和肺脏源菌株,可能与体表和乳腺脓肿易于发现并及时进行青霉素局部治疗有关;肺脏源菌株对红霉素均耐药,可能与大环内酯类药物在有呼吸道症状病羊的治疗中普遍应用有关。但本研究中肺脏源和乳腺源菌株数量较少,关于该菌的耐药性现状研究仍需进一步扩大菌株数量。
当前,关于羊伪结核病的报道大多以羊浅表淋巴结干酪性脓肿为主[11-12],本研究中除病羊下颌淋巴结外,从肺脏化脓灶和乳腺炎性脓肿中亦分离到伪结核棒状杆菌,表明伪结核棒状杆菌能够对羊多种组织器官造成局部化脓性感染,由此说明,针对伪结核棒状杆菌对羊群的危害,除关注体表型感染外,还应对羊内脏型伪结核病予以群体筛查,此外,由于伪结核棒状杆菌为人畜共患病原菌[13],乳腺炎性脓肿组织中伪结核棒状杆菌的存在,应引起养殖场和畜牧兽医工作者的重视。同时提示该菌不仅会对羊奶产业造成相关经济损失,同时可能会对食品安全和公共卫生健康造成一定威胁。

