镉胁迫下α-硫辛酸对大鼠肾细胞MAPK信号通路的影响
罗通旺,李卓悦,王晓杜,邵春艳,宋厚辉
(浙江农林大学 动物科技学院/动物医学院 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室/动物健康互联网检测技术浙江省工程实验室/动物医学与健康管理浙江省国际科技合作基地/中澳动物健康大数据分析联合实验室,浙江 杭州 311300)
镉(Cd)是环境中分布广泛且毒性很强的一种重金属污染物,它的生物半衰期长而且排泄率低,容易在动物体内蓄积[1-2]。Cd对生物体的损伤已在大量研究中被证实[3-5],当Cd蓄积到一定程度时会抑制细胞中ATP的活力并导致组织发生氧化损伤,从而引发相关疾病[6-7]。目前,Cd中毒的机制还没有完全阐明,而且对Cd造成的毒性损伤也没有确切、有效的治疗方法。肾脏作为Cd在生物体内最主要的靶器官和蓄积部位,研究Cd暴露导致的肾脏损伤机制和防治方法具有非常重要的临床意义。
丝裂原活化蛋白激酶( MAPK )信号通路是生物体内重要的信号转导系统之一,参与介导细胞生长、分裂和凋亡等多种生理及病理过程[8-10]。哺乳动物细胞中 MAPK 有3个主要的家族成员,分别为 ERK1/2、JNK和p38 MAPK[11-12],当通路被激活时,ERK1/2、JNK和p38蛋白的磷酸化水平将升高。根据已报道的文献以及本实验室前期的研究表明,MAPK信号通路在Cd诱导的细胞损伤和死亡中能够被激活并参与了细胞的自噬和凋亡等[13-15],但其作用机制还不是很明确。
α-硫辛酸(α-LA)是一种很强的抗氧化剂,具有容易吸收与转化以及水相、脂相双重溶解的特性[16-17]。α-LA作为一种常见的抗氧化剂在临床科研中得到了广泛的应用,近年的研究表明,α-LA对氧化应激引起的脏器损伤具有保护作用[18-20],但α-LA能否通过调节MAPK信号通路缓解Cd诱导的肾脏细胞损伤还不明确。因此,本研究通过SD大鼠体内试验结合细胞体外试验进一步验证α-LA在Cd致大鼠肾细胞损伤中的作用并探究其对MAPK通路的影响,以期为α-LA的临床应用和Cd中毒的防治提供一定的理论依据。
1 材料与方法
1.1 主要仪器和试剂紫外分光光度测定仪(上海光谱仪器有限公司);高速匀浆机(PT-MR2100 型,瑞士);荧光显微镜(DM2500 Leica)、酶标仪(Tecan,Australia);超净台(上海新苗有限公司);PS-9000705 超纯水装置(美国LABCONCO公司);超声波细胞破碎仪(宁波新芝生物科技股份有限公司);台式高速冷冻离心机5810R(Eppendorf,Germany);SD大鼠购自江苏大学比较医学中心;NRK-52E细胞购于上海细胞库;α-LA购于Santa公司;醋酸镉购于 Sigma 公司;RIPA 裂解液、蛋白酶抑制剂购自北京普利莱公司;BCA试剂盒购于碧云天公司;β-actin和MAPK通路相关抗体均购于美国 Cell Signaling Technology公司。
1.2 动物试验设计24只60~70 g清洁级雌性SD大鼠购回后适应环境1周,然后称量体质量并随机分成4组,每组6只,分别为Control组、Cd组(50 mg/L CdAc2)、Cd+α-LA组(50 mg/L CdAc2+50 mg/kg α-LA)以及α-LA组(50 mg/kg α-LA)。Control组以及α-LA组的大鼠,自由饮用ddH2O;Cd组与Cd+α-LA组的大鼠,自由饮用配制好的Cd液并且每天按时灌胃α-LA;为了减小误差其他组的大鼠同样给予ddH2O灌胃处理。持续处理12周。期间记录好大鼠每天的体质量以及饮水量和采食量,动物饲养环境保持清洁干燥,同时温度控制在最适温度的范围内。在试验结束的第2天用戊巴比妥钠麻醉后用颈椎脱臼处死并开展相关的试验进行检测。
1.3 取材与细胞培养原代细胞的获取与培养:按照动物福利要求将大鼠处死,无菌操作打开腹腔,暴露肾脏并取出,用手术镊剔除肾脏外的包膜,切下肾皮质于小烧杯中剪碎并研磨,用80目筛网过滤后,1 200 r/min离心5 min。 加入胶原酶于37℃水浴中消化15 min,再次1 200 r/min离心5 min。小心的倒去上清,加入DMEM-F12培养基吹打均匀后以正常培养体积的1/2接种于细胞培养板中,放置在37℃、5% CO2饱和湿度下的CO2培养箱中培养,24 h后补充培养基至正常量,继续培养至72 h时更换培养基,当细胞长到对数生长期时进行Cd暴露等处理。NRK-52E的细胞培养:将NRK-52E细胞培养在含有10%的胎牛血清和100 U/mL青链霉素的DMEM培养基中培养。当细胞铺满细胞培养瓶底部时,用0.25%的胰蛋白酶消化细胞1 min,并用含血清的培养基终止胰酶消化,然后用新鲜的完全培养基重悬细胞并按照1∶3的比例接种到新的培养瓶中继续培养,当细胞长到对数生长期时进行Cd暴露等处理。Cd暴露前30 min在细胞培养基中先加入α-LA,然后加入Cd孵育12 h,其中 NRK-52E细胞的Cd浓度为5 μmol/L,rPT细胞的Cd浓度为2.5 μmol/L,α-LA的浓度为200 μmol/L。
1.4 组织学观察(1)光镜观察:切取合适的左肾切片固定于10%福尔马林溶液,常规脱水、石蜡包埋切片,HE染色后在光镜下观察;(2)电镜观察:处死后迅速分离包膜,取右肾皮质切成约1 mm3小块,于2.5%戊二醛固定液中固定2 h,用磷酸缓冲液漂洗,梯度乙醇以及丙酮脱水,环氧树脂包埋,制作超薄切片,用醋酸铀和柠檬酸铅双重染色,透射电镜下观察。
1.5 Western blot检测MAPK通路相关蛋白的表达常规方法提取肾皮质组织蛋白或细胞蛋白,取等量的各组织蛋白样品进行SDS-PAGE后,将凝胶上的蛋白转印至PVDF膜,用5%的脱脂奶粉(TBST配置)对膜进行常温封闭90 min,然后加入1∶1 000稀释的单克隆抗体,4℃孵育过夜;用TBST洗膜6次,每次5 min;洗完后加入HRP标记的二抗(1∶5 000稀释),常温孵育2 h;再用TBST洗膜6次,每次5 min;之后进行显影并用Image Lab软件测定蛋白条带的灰度值后进行统计学分析。
1.6 统计学处理试验数据用先用Excel进行初步处理,然后用SPASS 22.0统计软件进行单因素方差分析,并进行多重比较。统计结果以“平均值±标准差”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 Cd胁迫下α-LA对大鼠肾脏超微结构的影响透射电镜观察可见,Control组细胞核的核膜完整、核仁清晰、核染色质分布均匀(图1A)。与Control组比较,Cd组多数细胞核固缩、变形、染色质边聚甚至溶解,细胞内出现大量空泡(图1B)。Cd+α-LA组的大鼠细胞核轻微皱缩,染色质分布相对均匀,且向核膜边缘聚集程度有所缓解(图1C)。α-LA组细胞核除了轻微的皱缩以及染色质轻微的边聚外无明显可见的病理变化(图1D)。
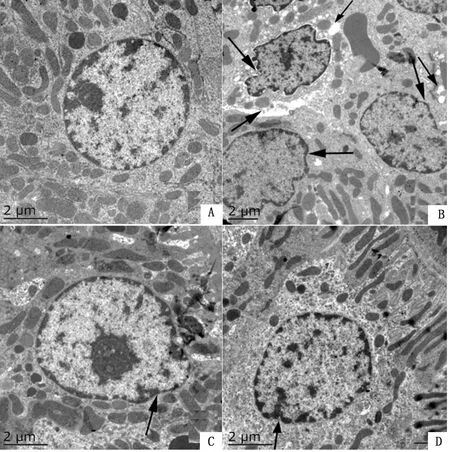
A.Control组;B.Cd组;C.Cd+α-LA组;D.α-LA组
2.2 Cd胁迫下α-LA对大鼠肾脏组织结构的影响Control组中大鼠的肾皮质无明显的病理变化,小管间质区结构清楚,未见炎症细胞浸润、纤维组织增生与肾小球硬化(图2A);Cd组大鼠的肾小球内细胞数量增多,肾小管上皮细胞表现出明显的变性和坏死,坏死脱落的上皮细胞进入官腔出现大量的管型现象,有的管壁变薄甚至破裂(图2B);Cd+α-LA组大鼠切片可见肾小球毛细血管有轻微的充血现象,肾小球内细胞数量较少,肾小管管型数量与Cd组比明显变少(图2C);α-LA组中无论肾小管还是肾小球都没有明显的病理现象(图2D)。
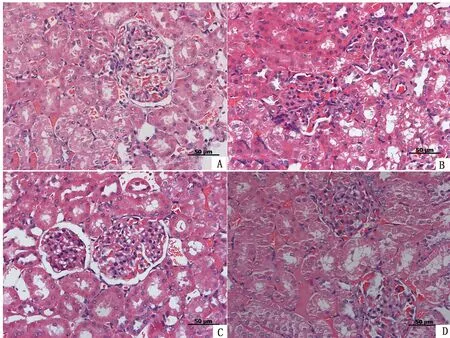
A.Control组;B.Cd组;C.Cd+α-LA组;D.α-LA组
2.3 Cd胁迫下α-LA对大鼠肾脏组织细胞MAPK信号通路的影响常规方法提取大鼠肾脏组织蛋白,用Western blot检测了MAPK信号通路相关蛋白的磷酸化水平,结果如图3所示,与Control组相比,Cd暴露组大鼠肾组织中ERK1/2和JNK1/2的磷酸化水平极显著升高(P<0.01),p38的磷酸化水平显著升高(P<0.05);Cd+α-LA组与Cd暴露组相比,ERK1/2的磷酸化水平极显著降低(P<0.01),JNK1/2和p38的磷酸化水平显著降低(P<0.05),但都高于Control组;α-LA组与Control组相比,ERK1/2、JNK1/2和p38的磷酸化水平无显著差异。
2.3 Cd胁迫下α-LA对大鼠肾小管上皮细胞ERK1/2蛋白磷酸化水平的影响结果如图4所示,与Control组相比,Cd暴露后无论是NRK-52E还是rPT细胞的ERK1/2磷酸化水平都极显著升高(P<0.01);Cd+α-LA组与Cd暴露组相比,NRK-52E细胞的ERK1/2磷酸化水平显著降低(P<0.05),rPT细胞的ERK1/2磷酸化水平极显著降低(P<0.01);α-LA组与Control组相比无论是NRK-52E还是rPT细胞的ERK1/2磷酸化水平都无显著差异。
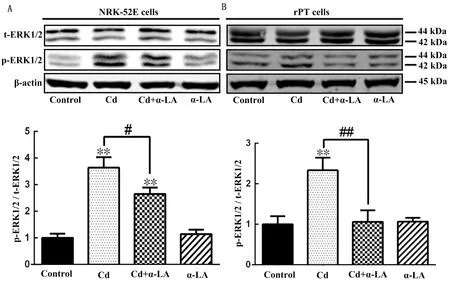
A.NRK-52E细胞ERK1/2蛋白的磷酸化水平;B.rPT细胞ERK1/2蛋白的磷酸化水平
2.4 Cd胁迫下α-LA对大鼠肾小管上皮细胞JNK1/2蛋白磷酸化水平的影响结果如图5所示,与Control组相比,Cd暴露后无论是NRK-52E还是rPT细胞的JNK1/2磷酸化水平都极显著升高(P<0.01);Cd+α-LA组与Cd暴露组相比,NRK-52E细胞的JNK1/2磷酸化水平显著降低(P<0.05),rPT细胞的JNK1/2磷酸化水平极显著降低(P<0.01);α-LA组与Control组相比无论是NRK-52E还是rPT细胞的JNK1/2磷酸化水平都无显著差异。
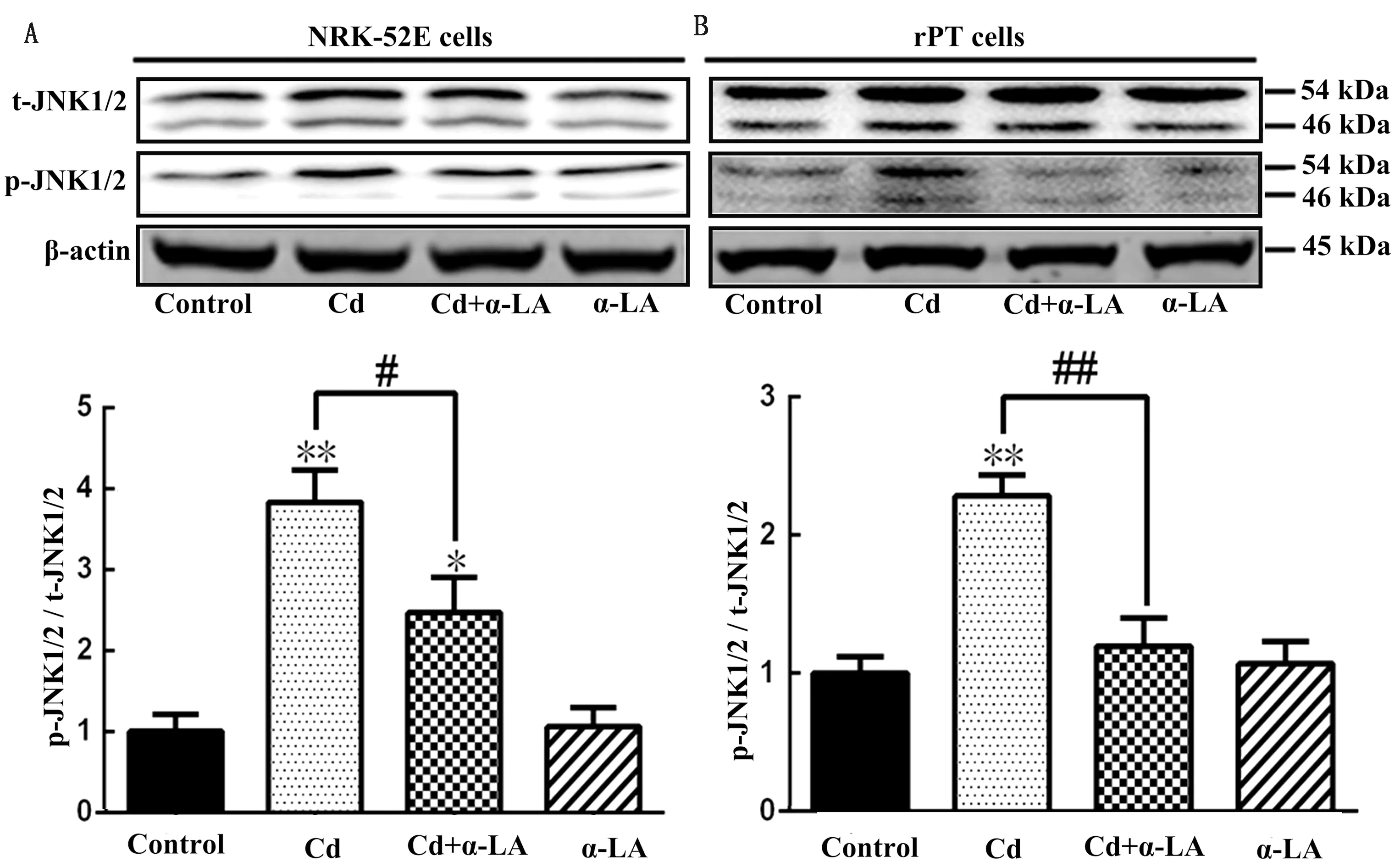
A.NRK-52E细胞JNK1/2蛋白的磷酸化水平;B.rPT细胞JNK1/2蛋白的磷酸化水平
2.5 Cd胁迫下α-LA对大鼠肾小管上皮细胞p38蛋白磷酸化水平的影响结果如图6所示,与Control组相比,Cd暴露后无论是NRK-52E还是rPT细胞p38的磷酸化水平都极显著升高(P<0.01)。Cd+α-LA组与Cd暴露组相比,NRK-52E细胞的p38磷酸化水平极显著降低(P<0.01),rPT细胞的p38磷酸化水平显著降低(P<0.05)。α-LA组与Control组相比无论是NRK-52E还是rPT细胞的p38磷酸化水平都无显著差异。

A.NRK-52E细胞p38蛋白的磷酸化水平;B.rPT细胞p38蛋白的磷酸化水平
3 讨论
当受到各种有害刺激时,机体内的氧化与抗氧化之间的平衡被打破,导致活性氧含量升高,从而引起组织细胞损伤,这一现象称为氧化应激。氧化应激是自由基在体内产生的一种负面作用,在一些疾病的发生发展过程中发挥着重要作用[21]。Cd作为一种广泛存在于自然界中的蓄积性毒物,当在动物机体内达到一定量时会造成多个组织器官的损伤,其中对肾脏的损伤尤为明显[22-23]。α-LA是一种有“万能抗氧化剂”称号的强抗氧化剂和自由基清除剂,在体内吸收进入细胞后可还原成二氢硫辛酸并释放到细胞外,可以消除大部分位置的自由基[18]。α-LA作为巯基供给体很容易与许多毒性物质特别是重金属离子直接反应,是机体抵御有毒物质的第一条防线,这些特点在所有抗氧化剂中是独一无二的,是已知天然抗氧化剂中效果最强的一种[24],近十几年来α-LA的药理特性备受关注。据文献报道以及本课题组前期的研究表明发生氧化应激是Cd致肾脏损伤的重要机制[25-27],当机体的抗氧化能力降低时,Cd引起的氧化损伤就会表现出来。因此,本研究选择抗氧化剂α-LA作为干预Cd毒性的药物进行研究,以期为α-LA的临床应用和Cd毒性的机制提供一定的理论基础。
MAPK激酶是广泛存在于真核细胞内的一类丝氨酸/苏氨酸蛋白激酶,MAPKs信号转导途径具有十分重要的作用,能够通过磷酸化靶蛋白激活级联反应从而参与细胞的增殖、生长、迁移和凋亡等重大生命活动[28-29]。当细胞受到外界不同的刺激后会激活不一样的 MAPK 信号通路进而使细胞产生不同的功能。据文献报道,JNK1/2和p38 MAPK的激活可以促使细胞凋亡,而ERK1/2的激活则会抑制细胞凋亡[30-31],本课题组前期在Cd暴露致大鼠肾小管细胞的毒性研究中也证实了这一点[32]。但是α-LA能否在Cd致大鼠肾细胞毒性损伤中通过调控MAPK信号通路发挥保护作用还不明确。因此,本研究通过体内和体外试验,重点围绕MAPK信号通路活化水平的检测进一步阐明α-LA在Cd致大鼠肾细胞毒性损伤中作用。
本研究中肾脏细胞超微结构和病理组织HE染色结果表明(图1,2),Cd暴露导致了大鼠肾脏组织的损伤,而α-LA的干预可以明显缓解Cd暴露所致的这种损伤,结合前期的研究其机制,推测很可能和α-LA发挥了抗氧化的能力有关。另外,Western blot的检测结果显示(图3~6),无论是体内还是体外Cd暴露时ERK1/2、JNK1/2和p38的磷酸化水平显著升高,α-LA干预后ERK1/2、JNK1/2和p38的磷酸化水平显著降低,但仍然高于Control组,表明Cd暴露激活了MAPK信号通路而α-LA干预在一定程度上可以抑制MAPK的激活。因为前期的研究已经表明Cd暴露导致大鼠肾小管上皮细胞中JNK1/2和p38 MAPK的激活上调了Cd诱导的细胞凋亡率,而ERK1/2 MAPK的激活则下调了Cd诱导的细胞凋亡率,细胞最终的凋亡情况取决于各条通路综合作用的结果。本研究中α-LA干预明显缓解Cd暴露所致的大鼠肾细胞损伤,在一定程度上说明α-LA对JNK1/2和p38 MAPK的综合抑制效果很可能强于对ERK1/2 MAPK的抑制。
综上所述,α-LA干预能够抑制Cd诱导的MAPK 信号通路激活,缓解Cd暴露导致的大鼠肾细胞损伤。本研究对进一步揭示Cd致肾毒性的机制具有一定的意义,也为临床α-LA 的应用扩展提供了试验依据。

