检测牛副流感病毒3型恒温隔绝式荧光RT-PCR方法的建立及应用
任云鑫,汤 承,2,岳 华,2*
(1.西南民族大学 畜牧兽医学院,四川 成都 610041;2.青藏高原动物遗传资源保护与利用教育部重点实验室, 四川 成都 610041)
牛副流感病毒3型(bovine parainfluenza virus type 3,BPIV3)为副黏病毒科(Paramyxoviridae)副黏病毒亚科(Paramyxovirinae)呼吸道病毒属(Respirovirus)的成员,是引起牛呼吸道综合征(bovine respiratory disease syndrome,BRDC)的重要病原之一[1]。BPIV3于1959年首次被分离到[2],根据系统发育分析可以将其分为BPIV3 A、B和C 3种基因型,多个国家都报道了存在不同基因型的BPIV3[3-6]。我国2008年首次报道BPIV3,已发现BPIV3 A、B和C基因型[4,7-8]。国内血清流行病学调查和分子流行病学调查资料显示BPIV3在我国广泛分布,并且在东北、西北和养牛业发达的中部地区具有较高的检出率[8-12]。目前,国内关于BPIV3分子流行病学资料仍然缺乏,阻碍了BPIV3的进一步防控。
BPIV3感染后会引起牛的呼吸道损伤和免疫功能抑制[13],而表现出对BRDC的其他相关病原体易感性增强,导致病牛更严重的危害,致使牛群死亡率增加[14]。由于引发BRDC的病原较多且症状相似,因此,准确、快速、有效的检测手段在BRDC的防控中显的格外重要。PCR方法被认为是传染病诊断的金标准[15],国内外已有根据BPIV3保守的N、M、HN、P基因设计的PCR检测方法[16-22],但仍未见能够基于现场快速诊断BPIV3的PCR方法,因此及时建立一种快速、灵敏、可靠地同时检测BPIV3 A、B和C 3种基因型的荧光PCR方法,对BPIV3的诊断防控具有重要的现实意义。
恒温隔绝式RT-PCR(insulated isothermal RT-PCR,iiRT-PCR)是一种基于贝纳尔对流原理的等温RT-PCR技术[23],配套使用PetNAD核酸提取试剂盒和POCKITTM系列核酸分析仪,无需设置反应程序,一键启动后60 min内即可报告结果,具备操作简单、检测速度快的优势,已广泛用于多种动物疫病的现场检测[24-27]。本研究根据GenBank中完整的102条P基因序列成功建立了BPIV3的现场检测方法并进行了方法之间的比较和初步应用,丰富了国内关于BPIV3分子流行病学资料;为BRDC的诊断和分子流行病学调查提供了有力的工具。
1 材料与方法
1.1 病毒(菌)株与临床样品BPIV3 C基因型阳性核酸由本实验室保存;用于通用性检验的BPIV3 A基因型(GenBank登录号:JQ063064)和BPIV3 B基因型(GenBank登录号:EU277658)毒株的目的序列片段由北京擎科生物科技有限公司成都分公司合成;用于特异性检验的病毒株、菌株的核酸阳性样本:牛冠状病毒(bovine coronavirus,BCoV)、牛呼吸道合胞体病毒(bovine orthopneumovirus,BRSV)、牛病毒性腹泻病毒(bovine viral diarrhoea virus,BVDV)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis,IBRV)、牛腺病毒3型(bovine adenovirus type 3,BAV3)、牛鼻病毒(bovine rhinitis virus,BRV)、多杀性巴氏杆菌(Pasteurellamultocida,P.multocida)、溶血性曼氏杆菌(Mannheimiahaemolytica,M.haemolytica)和牛支原体(Mycoplasmabovis,M.Bovis)的阳性核酸均由西南民族大学畜牧兽医学院分子生物学实验室保存。

P.BPIV3阳性对照;N.BPIV3 阴性对照;1~9.BCoV、BRSV、BVDV、IBRV、BAV3、BRV、多杀性巴氏杆菌、溶血性曼氏秆菌、牛支原体

P.阳性对照;N.阴性对照;-7~-12.4.23×103~4.23×10-2 copies/μL
141份BRDC肉牛鼻腔深部棉拭子样本于2020-2021年采自我国内蒙古、河南、宁夏、山西、四川和福建6个省份, 50份BRDC牦牛肺脏样本于2020-2021年采自四川省阿坝州红原县和若尔盖县的5个牧场。141份肉牛鼻腔深部棉拭子样本每份按照1∶5比例直接加入PBS溶液后进行充分涮洗,而50份牦牛肺脏样本则采用液氮冷冻研磨处理后,每份按照1∶5比例加入PBS溶液,所有样本经涡旋混匀,10 000 r/min离心5 min后取上清由本实验室保存于-80℃备用。
1.2 主要试剂和仪器Prime scriptTM反转录试剂盒、Premix Ex Taq(Probe qPCR)等购于TaKaRa 公司;pClone007载体、TrellefTM5α感受态细胞等购于擎科生物科技有限公司;Gel Extraction Kit和质粒提取试剂盒购自OMEGA BIO-TEK公司;高速冷冻离心机(5804)购自德国Eppendor公司;PetNAD核酸萃取试剂盒和POCKITTM系列核酸分析仪购于金瑞鸿捷生物科技有限公司。
1.3 引物、探针的设计与合成下载GenBank数据库中已登录的102条BPIV3 P基因序列,对比分析后选取高度保守的区域,使用Primer 5.0引物设计软件设计了1对检测BPIV3的特异性引物和1条特异性探针,扩增的目的片段位于基因组的2 830~2 954 bp处,长度为125 bp,引物序列:F:5′-ARAGGACACAGAAGAGAGCACT-3′,R:5′-TR-GCCACACATACAACTCTCT-3′;探针序列:FA-M-TTACAGAAAGGGCGATTACATTATTAC-AGA-BHQ1。引物和探针均由北京擎科生物科技有限公司成都分公司合成。
1.4 核酸的提取和反转录使用PetNAD核酸萃取试剂盒进行提取后,根据Prime scriptTM反转录试剂盒说明书对RNA进行反转录,cDNA保存于-20℃备用,而iiRT-PCR RNA的反转录和PCR检测反应在同一个PCR毛细反应管中完成。
1.5 BPIV3 C基因型毒株阳性标准品的制备以反转录得到的cDNA作为阳性模板,用1.3中设计的引物进行RT-PCR扩增,得到的PCR产物使用电泳鉴定后,将其纯化回收并用pClone007 载体、TrellefTM5α感受态细胞进行克隆转化构建重组质粒作为 BPIV3 C基因型阳性标准品,并使用核酸蛋白分析仪测定其浓度,按照下述公式计算核酸浓度:质粒拷贝数(copies/μL)=(6.02×1023copies/mol)×(质粒浓度 g/mL)×10-3/(质粒分子量 g/mol)。
1.6 iiRT-PCR反应体系的优化利用控制变量法,50 μL iiRT-PCR反应体系中Premix Ex Taq预混酶为25 μL,反应体系主要是优化探针浓度10 μmol/L(0.05~0.35 μL)、引物浓度10 μmol/L(1~4 μL)、模板量(0.5~3.5 μL)和反转录酶20 U/μL(0.5~2 μL),以iiRT-PCR反应前后荧光比值最高为确定各自最优浓度及用量的判定标准。
1.7 特异性试验采用反应体系优化后的BPIV3 iiRT-PCR方法对1.1中的病毒和菌株进行检测,以评价该iiRT-PCR方法的特异性。
1.8 灵敏性试验制备的BPIV3阳性质粒10倍递增稀释(1×100,1×10-1~ 1×10-12)后,使用优化后的iiRT-PCR方法进行检测,确定该方法检测下限。
1.9 重复性试验取3个稀释浓度(1×10-4~1×10-6)的BPIV3重组质粒标准品,用优化后的iiRT-PCR方法对每种浓度分别进行3次重复检测,进行批内重复性试验;对3个不同稀释梯度的标准品进行3次独立的重复检测,进行批间重复性试验,通过计算批内和批间变异系数评估该方法的重复性。
1.10 通用性试验用建立的iiRT-PCR方法对1.4合成的BPIV3 A基因型和B基因型阳性标准品进行检测并设立1.5制备的BPIV3 C基因型标准品为模板的阳性对照,另设置以ddH2O作为模板的阴性对照,用于评价该方法的通用性。
1.11 临床样本的检测采用本试验建立的iiRT-PCR方法和已报道的2种TaqMan-MGB荧光定量RT-PCR方法[16,28],分别对191份临床样本进行检测并比较检出率,以评价该方法的符合性,检测方法信息见表1。如果3种方法所检出的阳性样本编号不同,将其PCR产物进行双向测序后来验证结果的准确性。

表1 3种检测方法信息
1.12 iiRT-PCR预混试剂的制备与现场应用为了满足现场检测,对1.6中描述的反应体系进行预混。将检测4份样本需要的检测试剂按比例分装预混为一管进行冷冻真空冻干,然后避光保存于-80℃,使用时只需加入缓冲液和模板即可开始检测。取经1.11鉴定的2份阳性后和2份阴性BPIV3牛深部鼻腔棉拭子样品验证iiRT-PCR预混试剂的现场使用效果。将4份处理好的样品使用商品化核酸提取试剂盒提取样品总核酸后与溶解好的预混液一同加入到毛细PCR反应管中采用POCKITTM可充电式核酸分析仪(现场使用)进行检测,检验预混试剂现场应用的效果。同时采用TRIzol法提取的这4份肉牛深部鼻腔棉拭子样品的总RNA,将其与优化好的反应体系混匀后采用POCKITTM智能型核酸分析仪(实验室使用)检测,对比上述2种检测方式的检出率。
2 结果
2.1 重组质粒标准品的鉴定重组质粒经测序验证为BPIV3,成功构建的BPIV3的阳性质粒浓度为96 mg/L,换算拷贝数为4.23×1010copies/μL,保存于-20℃备用。
2.2 优化后的反应体系经过筛选优化的iiRT-PCR反应体系: Taq酶(预混酶)25 μL,10 μmol/L的上、下游引物各3 μL,10 μmol/L的探针0.25 μL,20 U/μL的反转录酶2 μL,模板1 μL,使用DEPC H2O补足至50 μL。
2.3 特异性试验结果通过使用本研究建立的iiRT-PCR方法对BPIV3的阳性cDNA和其他呼吸道病原核酸进行检测,结果显示:该方法只能特异性的检出BPIV3,而不能检出其他的牛呼吸道疾病相关病原(图1),将检测到的阳性产物进行测序,测序结果均为BPIV3,表明该方法的特异性较强。
2.4 灵敏性试验结果本研究制备的BPIV3阳性质粒拷贝数为4.23×1010copies/μL,10倍递增稀释样品,进行敏感性检测,结果显示建立的iiRT-PCR对BPIV3的检测范围是4.23×1010~4.23×100copies/μL,核酸最低检测下限为4.23×100copies/μL(图2)。
2.5 重复性试验结果用建立的BPIV3 iiRT-PCR方法对3个稀释度(4.23×104~4.23×106copies/μL)阳性标准品分别进行3次重复检测,批间变异系数(Cv)为2.16%~2.58%,批内变异系数(Cv)为1.37%~1.73%,表明本试验建立的BPIV3 iiRT-PCR方法重复性较好(表2)。
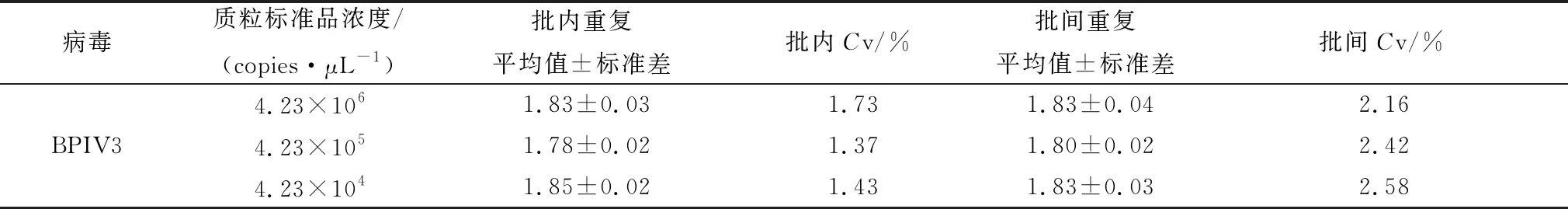
表2 iiRT-PCR方法的重复性试验结果
2.6 iiRT-PCR的通用性评价用建立的BPIV3 iiRT-PCR方法对A基因型、B基因型和C基因型阳性质粒进行检测,结果显示本研究建立的BPIV3 iiRT-PCR方法对3种基因型都可检出(图3),表明建立的BPIV3 iiRT-PCR方法通用性较好。

A.BPIV3 A基因型阳性质粒;B.BPIV3 B基因型阳性质粒;C.BPIV3 C基因型阳性质粒;N.阴性对照
2.7 临床样本的检测结果利用本研究建立的iiRT-PCR方法以及文献报道的另外2种BPIV3的检测方法对国内6个省份共191份呼吸道样本中的BPIV3进行检测,iiRT-PCR方法检测结果显示,141份肉牛鼻拭子样本中检出55份BPIV3阳性, 50份牦牛肺脏样本中检出22份BPIV3阳性,iiRT-PCR方法对BPIV3的检出结果可以覆盖另外2种方法的检测结果,符合率为88.48%~94.76%(表3),说明建立的iiRT-PCR方法可以实现对临床样本的检测。通过本研究建立的方法对6个省份样本中BPIV3检测结果显示,内蒙古、河南、宁夏、山西、四川和福建6个省份的肉牛鼻腔棉拭子样本检测到BPIV3阳性,阳性率为20.00%~80.00%,场阳性率为50.00%~100.00%;在牦牛肺脏样本中BPIV3的阳性率为44.00%(22/50),场阳性率为100.00%(5/5),表明BPIV3在我国上述的6个省份的肉牛和四川阿坝州地区的牦牛中均有存在(表4)。

表3 临床样品的检测结果 %

表4 BPIV3在6个省份的流行情况
2.8 iiRT-PCR方法的现场应用验证用预混试剂检测BPIV3,结果显示4份样本中具有2份阳性和2份阴性,该检测结果和TRIzol法提取核酸所进行的实验室检测方式结果一致,表明本研究建立的iiRT-PCR方法能够满足现场检测的条件。
3 讨论
BPIV3是牛呼吸道疾病的重要病原,感染BPIV3后造成牛的呼吸道损伤和免疫抑制[13],常继发引起其他病原的感染,造成患畜临床症状的相似,临床诊断较难,所以往往需要使用实验室诊断的方法进行确诊[29]。目前,国内外已有多种BPIV3的PCR检测方法[16,19,22,30],但仍未见能够现场诊断BPIV3的PCR方法。众所周知,病原的快速检测和检测方法的灵敏性对疾病的诊断具有重要影响,本研究通过对GenBank中102条P基因的对比后,选择高度保守区域设计了特异性引物和探针,并通过对反应体系的优化,成功建立了特异性强、灵敏性高和重复性好的BPIV3 iiRT-PCR检测方法,将优化好的反应体系预混冻干后,搭配现场核酸提取试剂盒POCKITTM系列核酸分析仪,从核酸提取到报告PCR结果仅需1 h,实现了BPIV3的现场检测,为BPIV3的快速诊断提供了有利工具。
本研究分别采用建立的iiRT-PCR和另外2种TaqMan-MGB 荧光定量 RT-PCR方法对内蒙古、河南、宁夏、山西、四川和福建6个省191份BRDC样本进行BPIV3的检测后发现,所建立的iiRT-PCR方法对BPIV3的检出率均高于其余2种检测方法,分析发现,其中1个TaqMan-MGB 荧光定量 RT-PCR方法选取M基因作为检测靶点进行引物和探针的设计,通过对比GenBank中已登录的34条M基因发现,该方法的引物和探针只能完全匹配34条M基因序列中的9条,与中国已上传至GenBank中的5条M基因全部不能完全匹配,这可能是导致该方法在本研究中检测率低于其余2种方法的重要原因。同样选取了P基因保守区域设计引物作为检测靶点的TaqMan-MGB 荧光定量 RT-PCR方法,检出率低于本研究建立的iiRT-PCR方法,可能是因为本研究所用方法有更低的核酸检测下限(4.23 copies/μL),而报道的TaqMan-MGB荧光定量RT-PCR方法检测下限为100 copies/μL。
近年来,随着我国养牛业的快速发展,肉牛贸易运输愈发频繁[31],BRDC已经成为了阻碍养牛业健康发展的主要疾病之一[4]。BPIV3是导致BRDC的重要病原,但国内关于BPIV3的分子流行病学调查资料仍尚不完整[10]。本研究通过建立的iiRT-PCR方法对6个省141份肉牛鼻腔棉拭子样本进行检测后发现,内蒙古、河南、宁夏、山西、四川和福建6个地区的样本均有BPIV3的检出,BPIV3平均阳性率为39.01%(55/141),平均场阳性率为76.92%(10/13),表明BPIV3已经在上述省份的养牛业中普遍存在,该结果丰富了国内BPIV3的分子流行病学调查资料。牦牛是我国青藏高原特有的经济物种和当地人民不可或缺的生活物资,而呼吸道疾病常发生于牦牛群体中[32]。本研究对四川省红原县和若尔盖县采集的5个牧场的50份牦牛肺脏样本进行BPIV3检测后发现,BPIV3平均阳性率为44.00%(22/50),场阳性率为100.00%(5/5),该结果表明BPIV3已经广泛流行于四川地区的牦牛群体中。因此,进一步加强牦牛群体内BPIV3的监测,对青藏高原地区牦牛BRDC的防控具有重要意义。
综上所述,本研究建立的BPIV3的iiRT-PCR方法具有特异性强、稳定性好和灵敏性高特点,可用于BPIV3的快速检测,为BPIV3的流行病学调查和现场诊断提供了新的方法。本研究结果丰富了国内BPIV3的分子流行病学资料,为牛呼吸道疾病的防控提供了参考。

