中国荷斯坦奶牛PDE10A基因多态性及其与乳品质性状的关联分析
陈佳怡,李嘉灵,刘娟,吴昊宸,范静,姜平,赵志辉,尹福泉
(广东海洋大学 滨海农业学院,广东 湛江 524000)
中国荷斯坦奶牛是19世纪末由中国的黄牛与当时引进中国的荷斯坦牛杂交,并通过不断选育逐渐形成的品种,其产奶性状(产奶量、乳蛋白、乳脂和乳糖等)是重要的经济性状,这类性状受微效多基因控制,并受到环境因素的影响[1]。传统的选育方法侧重于表型选择,世代间隔较长,选育进展缓慢。记录奶牛产奶量和测定相关乳品质性状进行数据收集,将其与现代分子生物学技术结合,找出真正地可用于分子标记辅助选择的关键基因SNPs位点应用于奶牛分子育种的标记辅助选择,可以加快中国荷斯坦奶牛分子育种和品种选育进程。
磷酸二酯酶10A基因(phosphodiesterase 10A,PDE10A)是PDE第10家族中的唯一成员,能够参与水解第二信使环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和环磷酸鸟苷(cyclic guanosinc monophosphate,cGMP)。由于第二信使在细胞内普遍存在且广泛地参与细胞内各种功能,使得PDE10A基因也能够通过调节第二信使进而参与细胞内许多信号转导通路。早在1975年就有研究表明,cAMP激活剂能够有效刺激母羊、兔和牛乳腺组织中酪蛋白的分泌[2-3],之后又有研究报道了静脉注射咖啡因(一种非特异性PDE抑制剂)能够提高奶山羊乳脂含量[4]。PDE10A被发现在大脑纹状体中高表达,因此大部分研究都集中于PDE10A抑制剂在各种精神和神经退行性疾病上的应用,包括神经分裂症[5-6]、亨廷顿病[7-8]等。但也有人提出PDE10A可能在牛乳腺中起作用[9]。同属于PDE家族的PDE3可能与牛奶脂肪的产生有关[10],且PDE4能够在牛乳腺组织和上皮细胞中对乳蛋白含量具有重要的调节作用[9]。因此推测,PDE家族的PDE10A可能对牛乳腺以及相关性状有着一定的调节作用。本课题组在前期研究中根据对高脂荷斯坦奶牛与低脂荷斯坦奶牛乳腺上皮细胞进行的miRNA测序筛选出一系列差异表达的miRNA,其中包括miR-485,经过进一步研究发现miR-485可靶向作用于PDE10A基因调节细胞脂质代谢[11],这个结果提示PDE10A基因可能作为直接或间接影响奶牛乳品质性状的关键基因而发挥生物学作用。但PDE10A基因对中国荷斯坦奶牛乳品质性状的影响研究鲜有报道。因此,本研究采用直接测序法研究中国荷斯坦奶牛PDE10A基因的多态性及其与乳品质性状的相关性,以期为中国荷斯坦奶牛的分子标记辅助选择提供重要的基因资源。
1 材料与方法
1.1 血液样本DNA选用黑龙江省某牛场的同一时期相同饲养状态下的中国荷斯坦奶牛104头,每头牛颈静脉取血10 mL,并用抗凝剂处理,-80℃ 保存。
1.2 主要试剂核酸染色剂购自Meilunbio公司;DL2000 DNA Marker、TAE Buffer均购自诺唯赞公司;琼脂糖、2× EasyTaq PCR SuperMix(+Dye)均购自北京全式金生物技术有限公司。
1.3 DNA混池构建随机选择45~50个DNA样本进行等量混合,制备成DNA混池样品。
1.4 引物设计根据NCBI数据库提供的PDE10A基因组序列(编号:ENSBTAT00000073673.1),使用Primer 5.0软件进行PDE10A基因的引物设计,上游引物:5′-TAGTTTGTGATACGGGATGC-3′;下游引物:5′- AAGCGTGGTACGAATGC -3′,由生工生物工程(上海)股份有限公司合成。
1.5 目的基因PCR扩增及验证PCR反应体系20 μL:2×Taq Master Mix (Dye Plus) 10 μL,上、下游引物各0.5 μL,模板1 μL,ddH2O 8 μL。反应程序:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,30个循环;72℃ 5 min。PCR产物经1.5%琼脂糖凝胶电泳验证后,送至生工生物工程(上海)股份有限公司测序。
2 结果
2.1 PDE10A基因PCR扩增产物的验证PCR扩增中国荷斯坦奶牛PDE10A基因产物经1.5%琼脂糖凝胶电泳检测,结果显示,PCR产物扩增特异性良好,无杂带,条带清晰,可直接用于测序鉴定(图1)。

M.DL2000 DNA Marker;1~10.分别为不同个体的PCR扩增产物
2.2 测序结果PDE10A基因内含子12、外显子13和内含子13中发现3处SNP位点,分别为I12-3228 A>G、E13-106 C>T、I13-13 A>G。3个SNPs位点各基因型测序结果如图2~4所示。

Ⅰ~Ⅲ.基因型分别为AA、GG、AG的个体


表1 PDE10A基因3个SNPs的群体遗传特性
2.4 PDE10A基因SNPs与中国荷斯坦奶牛乳品质性状的相关性分析使用SPSS 22.0单因素方差分析PDE10A基因SNPs与中国荷斯坦奶牛乳品质性状的相关性。结果如表2所示,I12-3228 A>G位点的GG基因型及AG基因型的奶量极显著高于AA基因型(P<0.01),AA基因型的乳脂肪含量显著高于AG基因型(P<0.05),极显著高于GG基因型(P<0.01),AA基因型乳蛋白含量极显著高于GG基因型(P<0.01),AA基因型的乳糖含量显著高于AG基因型(P<0.05)并极显著高于GG基因型(P<0.01),AA基因型干物质含量显著高于AG基因型(P<0.05)极显著高于GG基因型(P<0.01),AA基因型的体细胞数显著高于GG基因型(P<0.05),GG基因型和AG基因型的校正奶量极显著高于AA基因型(P<0.01); I13-13 A>G位点的AG基因型和GG基因型的奶量极显著高于AA基因型(P<0.01),AA基因型的乳脂肪含量显著高于AG基因型(P<0.05)并极显著高于GG基因型(P<0.01),AA基因型的乳蛋白含量极显著高于GG基因型(P<0.01),GG基因型的乳糖含量极显著高于AA基因型(P<0.01),AG基因型的乳糖含量显著高于AA基因型(P<0.05),AA基因型干物质含量显著高于AG基因型(P<0.05)并极显著高于GG基因型(P<0.01),AA基因型的体细胞含量显著高于GG基因型(P<0.05),AG基因型及GG基因型的校正奶含量极显著高于AA基因型(P<0.01);E13-106位点基因型间与相关乳品质性状均无显著差异。

表2 PDE10A基因3个SNPs与中国荷斯坦奶牛乳品质性状相关性分析
2.5 PDE10A基因单倍型与中国荷斯坦奶牛乳品质性状的关联分析使用Haploview 4.2软件对3个SNP位点进行连锁分析,如图5所示,I12-3228 A>G、E13-106 C>T、I13-13 A>G这3个位点存在强连锁遗传,3者构成了1个结构域。共有6种不同单倍型,其中5种单倍型具有生物学统计意义(n>3),分别为:H1H1(AACCAA)、H1H2(AGCCAG)、H1H3(AGCTAG)、H2H2(GGCCGG)、H3H3(GGTTGG)。使用SPSS 22.0单因素方差分析以上5种单倍型与中国荷斯坦奶牛乳品质性状的相关性,结果如表3所示,H1H1单倍型的乳脂肪含量显著高于H1H3单倍型(P<0.05),极显著高于H2H2单倍型(P<0.01);H3H3单倍型的乳脂肪含量显著高于H2H2单倍型(P<0.05);H1H1单倍型的乳蛋白含量极显著高于H2H2单倍型(P<0.01);H3H3单倍型乳蛋白含量显著高于H2H2单倍型(P<0.05);H2H2单倍型和H3H3单倍型的乳糖含量显著高于H1H1单倍型(P<0.05);H1H1单倍型的乳中干物质含量显著高于H1H3单倍型(P<0.05),极显著高于H2H2单倍型(P<0.01),H3H3单倍型的干物质含量显著高于H2H2单倍型(P<0.05);H1H2单倍型、H1H3单倍型和H2H2单倍型的校正奶含量显著高于H1H1单倍型(P<0.05)。其余单倍型中国荷斯坦奶牛性能均无显著性差异(P>0.05)。
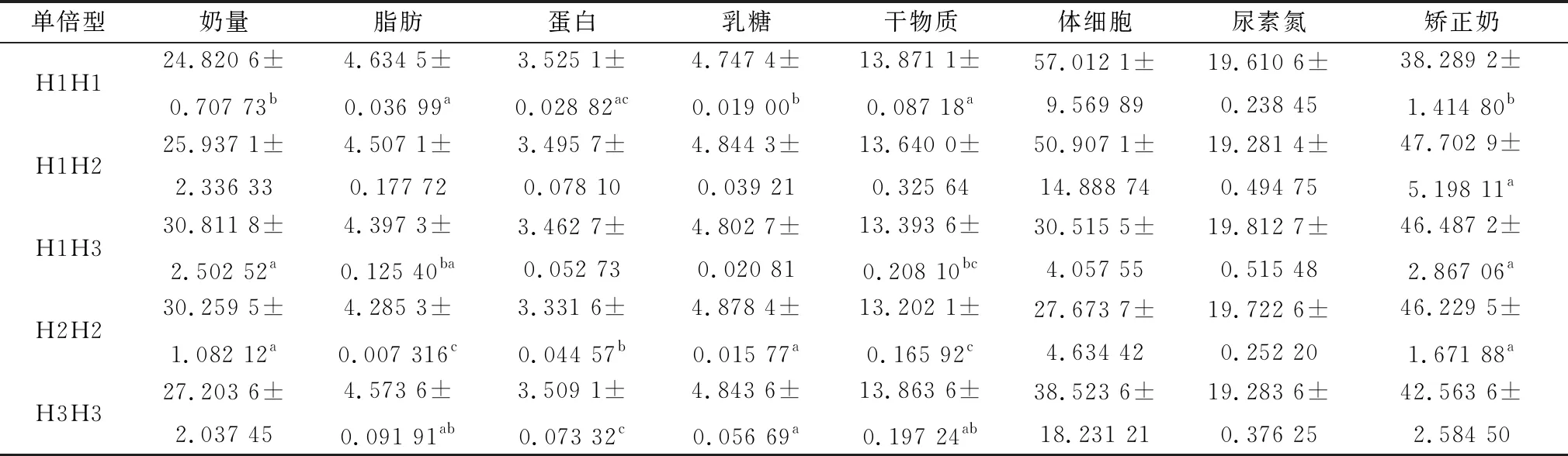
表3 PDE10A基因单倍型与中国荷斯坦奶牛乳品质性状相关性分析
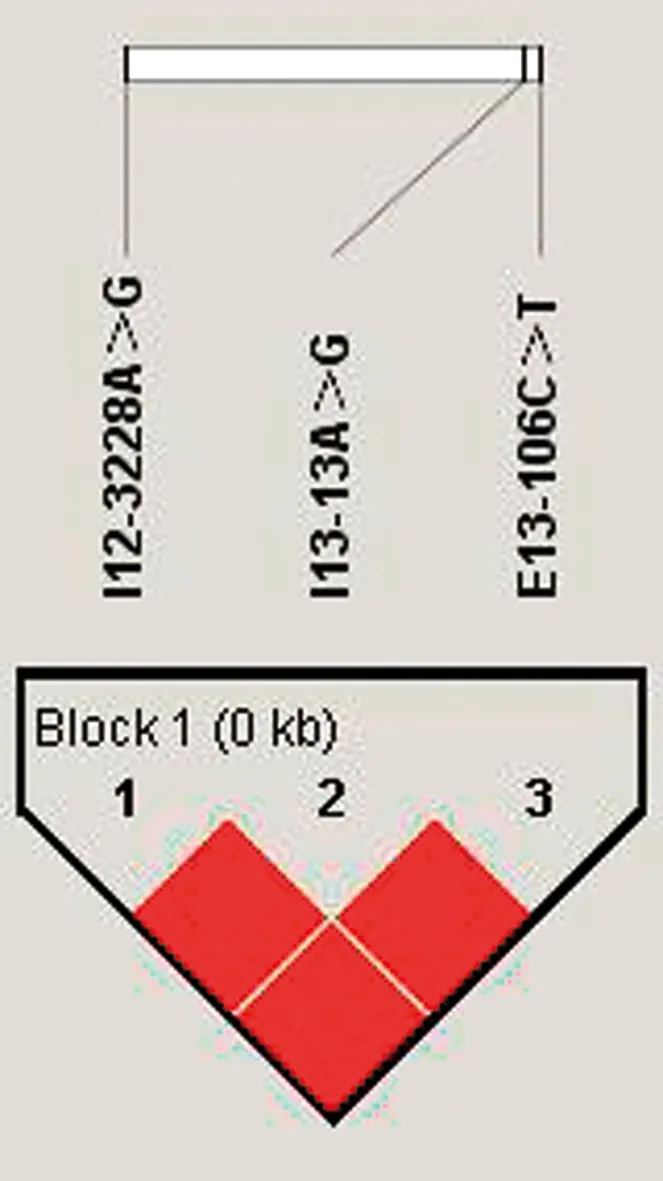
图5 PDE10A基因的奶牛群体SNPs位点连锁反应
3 讨论
近年来,越来越多的研究关注于基因多态性对中国荷斯坦奶牛乳品质性状的影响。有研究发现中国荷斯坦奶牛EEF1D基因5′侧翼区存在2个SNPs位点,且与奶牛乳脂率、乳蛋白率显著相关[12];还有研究表明中国荷斯坦奶牛PIN1基因 g.14432394G>A位点的突变显著影响奶牛在第一泌乳期和第二泌乳期的产奶量、乳脂率和乳蛋白率[13]。因此,本研究采用直接测序法对104头中国荷斯坦奶牛进行SNP位点筛选并分析其与乳品质性状的关联性。在检测样本中发现PDE10A基因存在3个SNP位点,其中I12-3228 A>G和I13-13 A>G 2个位点在试验牛群中多态性相对较高,可以很好地利用这2个位点在本试验群体中表现出的多态性进行选择。3个SNPS在试验群体中不符合哈代温伯格平衡,这可能是由于本试验样本均来自同一奶牛场,冷冻精液的使用及高选择强度导致基因表达受到人工选择的影响,群体间没有进行自然交配,等位基因与基因型比例没有保持遗传平衡状态。
对基因多态性的研究多集中于编码区和5′侧翼区而忽略了对内含子多态性的研究,随着人们研究的不断深入,内含子的调控功能逐渐被发现。有研究发现,人SLC2A9基因内含子7中的1个SNP与血清尿酸和慢性肾脏疾病的进展密切相关[14]。还有研究表明,中国西门塔尔牛MAT2B基因内含子2中存在1个SNP位点与肉品质性状显著相关[15];奶牛ECHS1基因中有6个内含子SNPs与牛奶脂肪酸显著相关[16]。在本研究中,I12-3228 A>G、I13-13 A>G位点与乳品质性状显著相关,其AA基因型表现出产奶量及乳糖量低于AG及GG 2种基因型而营养成分(乳脂肪、乳蛋白等)和体细胞数均高于AG及GG基因型的特性。造成这种现象的原因可能是由于奶牛产奶量减少而引起的“浓缩效应”导致的;同时,按照国际奶牛联合会制定的标准,对乳汁中体细胞进行计数,以每毫升50万个体细胞为界,高于此数值即判定为患有奶牛乳房炎。I12-3228 A>G和I13-13 A>G位点的AA基因型的体细胞数均大于50万个,因此也有可能是机体为了应对奶牛乳房炎,血液中血清蛋白和免疫球蛋白增加,最终导致乳蛋白率增加[17]。体细胞数的上升还会使乳糖含量显著下降[18],这可能是由于随着体细胞数的增加,乳腺上皮细胞大量脱落,血乳屏障受损,通透性改变,影响葡萄糖的吸收导致乳糖合成率降低。AG基因型相较于AA基因型体细胞数更少,乳中营养物质含量也较GG基因型更多。可以对PDE10A基因I12-3228 A>G和I13-13 A>G位点 AG基因型个体进行分子标记选择。
单个SNP的基因型可能会影响到临近SNP位点的基因型,复合基因型能够反应多个SNP间的互作[19]。因此,复合基因型的效应要优于单个基因型。本试验对中国荷斯坦奶牛PDE10A基因的3个SNPs位点进行了连锁不平衡分析,发现3个位点存在强连锁遗传,形成了5种有生物学统计意义的单倍型,且与奶牛生产性状显著相关。其中H1H3单倍型组合个体在乳脂肪、乳糖、乳蛋白、干物质方面与H1H1单倍型组合个体间没有显著性差异,且奶量显著高于H1H1单倍型组合个体,提示在本试验群体中H1H3单倍型组合个体可能为最优选择,在实际应用中可不断提高该单倍型组合在群体中的比例,以加快中国荷斯坦奶牛产奶性状的改良。
本研究发现PDE10A基因在中国荷斯坦奶牛中存在3个SNP位点,即I12-3228 A>G、E13-106 C>T和I13-13 A>G。其中I12-3228 A>G和I13-13 A>G位点的突变显著影响了中国荷斯坦奶牛的产奶量、乳脂肪、乳蛋白、乳糖、干物质和体细胞。可尝试将PDE10A基因作为影响中国荷斯坦奶牛乳品质性状的候选基因用于标记辅助选择,为中国荷斯坦奶牛选育工作提供科学依据。

