HIF-1α通过炎性小体ASC结构域调控膝骨关节炎的分子机制研究
杨学钰,郭文帆,郑雪君,卢吉高,杨勇,李会东
(河北省张家口市第二医院运动医学科,河北 张家口 075000)
膝关节骨性关节炎是一种复杂的关节疾病,由多种危险因素。膝关节骨关节炎在老年人中非常普遍[1-3]。治疗方法包括锻炼、体重管理、自我效能训练和疼痛应对技巧,以及药物治疗。骨关节炎的分子基础已被普遍接受,但确切的发病机制尚不清楚[4]。缺氧诱导因子1(hypoxia-inducible factor 1,HIF-1)是对缺氧应答的主要调节因子,是一种异二聚体转录因子复合物,参与机体的多种生理过程,例如代谢、增殖、凋亡和血管生成,并且在炎症相关疾病相关[5-7],但在膝骨关节炎中的研究较少。炎性小体是多种蛋白质组成的复合体,在感知外界病原体或损伤后传递信号给免疫系统,启动炎症。目前已发现的炎症小体有多种,凋亡相关微粒蛋白ASC是重要的成员,调节Caspase-1依赖的细胞焦亡,诱导细胞在炎性和应激的条件下死亡[8-9],但是HIF-1是否可以调节ASC的表达尚不清晰。因此本研究将建立大鼠膝骨关节炎模型,探究HIF-1对炎性小体ASC的调控作用,并分析其在炎性小体磷酸化修饰中的作用,为临床研究骨性关节炎提供分子机制。
1 材料与方法
1.1材料
1.1.1SPF级SD大鼠 8周龄SPF级雄性SD大鼠,体重180~220 g,购于斯贝福生物技术有限公司,许可证号(SCXK 2019-0010)饲养环境温度20~25 ℃,湿度55%,自由饮食、饮水。
1.1.2药品与试剂 苏木素,伊红购买于北京中杉金桥生物技术有限公司;引物由上海生工合成;HIF-1α-agomir及NC-agomir购于上海吉玛基因公司;Rat IL-6 ELISA Kit(RAB0311),Rat TNF-α ELISA Kit(RAB0479)购于美国sigma公司,Rat IL-1β(H002)Elisa kit检测试剂盒,购自南京建成生物工程研究所;Anti-Wnt3a抗体(ab219412,稀释比1∶1 000),Anti-beta Catenin抗体(ab32572,稀释比为1∶5 000),Anti-GAPDH抗体(ab82451:5000)及Goat Anti-Rabbit IgG H&L(HRP)(ab6721稀释比为1∶5 000)购于abcam公司。
1.1.3主要仪器 超低温台式离心机(Biofuge Primo R),美国Thermo Scientific;脱色转移摇床,海门市其林贝尔有限公司;组织切片机(RM2335),德国徕卡公司;恒温烤片机,广西亿创仪器设备有限公司;光学显微镜(Eclipse Ts2),日本尼康公司;全波长酶标仪(Multiskan Sky High),美国Thermo Fisher公司;Western电泳仪,美国Bio-Rad。
1.2实验方法
1.2.1大鼠膝骨关节炎模型建立 将40只SPF级SD大鼠随机分为对照组(n=10)、模型组(n=10)、阳性对照(negative control,NC)组(n=10)和si-HIF-1α组(n=10)。模型组、NC组与si-HIF-1α组建立大鼠膝关节炎模型,NC组和si-HIF-1α组分别尾静脉注射5 nmol NC质粒和si-HIF-1α质粒,对照组和模型组给与等量生理盐水。具体方法为:随机抽取10只大鼠为空白对照组,其余大鼠采用0.5 mL胰岛素针在膝关节腔内一次注射1 g/L碘乙酸钠构建膝关节炎大鼠模型的造模,每只大鼠注射0.1 mL/只。正常对照组注射等量的生理盐水,其他操作一致。造模后NC组给予5 nmol NC agomir,si-HIF-1α组给与5nmol si-HIF-1α尾静脉注射,1周后进行各组检测。
1.2.2大鼠关节取材、HE染色及病理评分标准 分离大鼠后肢膝关节,去除皮毛及肌腱组织,10%的多聚甲醛中浸泡固定48 h,10%EDTA脱钙液中1个月,重新于10%的多聚甲醛中固定,石蜡包埋、切片,用于HE染色。病理学评分,关节周围炎症评分标准为:没有炎症细胞浸润为0分;20个炎症细胞(100×)为1分;20~50个炎症细胞(100×)为2分;>50个炎症细胞(100×)为3分。骨破坏评分:正常为0分;少量软骨丢失为1分,骨破坏局限在独立的区域;大片软骨破坏,由血管翳导致的大片骨侵蚀为2分;关节结构完全破坏为3分;病理总评分:病理总评分=关节周围炎症评分+骨破坏评分。
1.2.3酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测 外周血炎症因子对各组大鼠进行毛细管眼眶采血,每只大鼠1 mL,3 000 r/min 3min后,获取上清,分别加入酶标抗体,37 ℃,30 min,加入底物液,每孔100 μL,置37 ℃避光放置5min,加入终止液显色,每孔加入反应终止液50 μL终止反应,于20 min内测定实验结果,酶联检测仪测定吸光度OD值,每组实验设置3个复孔。
1.2.4各组大鼠mRNA表达水平的检测 采用cDNA Synthesis Kit试剂盒逆转录试剂盒和SYBR Green PCR Master Mix Kit PCR试剂盒逆转录并进行HIF-1α的表达水平。使用PCR仪系统进行实时荧光定量PCR,循环40个PCR,使用GAPDH分别作为mRNA的对照,所有操作在冰上进行并避免RNA酶污染,以2-△△Ct计算mRNA相对表达量[7],引物顺序见表1。

表1 引物序列Table 1 The sequence of primers
1.2.5Western blot检测膝关节组织Wnt3a及β-catenin蛋白表达 采血后切开各组大鼠膝关节并纵形分离周围软组织,PBS清洗2遍,液氮匀浆,匀浆后冰上裂解细胞提取总蛋白,蛋白提取后进行SDS-PAGE电泳80 V 10 min,120 V 1.5 h,转至PVDF膜,5%脱脂奶粉封闭2 h,TBST漂洗4次每次5分钟,按照各抗体稀释浓度稀释抗体后分别加入一抗重组Anti-ASC抗体(ab283684,英国abcam,1∶1 000),Anti-HIF-1 alpha antibody(ab1,英国abcam公司,5 mg/L),4 ℃孵育过夜,二抗常温孵育2 h,TBST漂洗4次每次5分钟,ECL显色,发光仪曝光、拍照,蛋白相对定量采用photoshop对蛋白灰度进行统计,各统计3次[10]。
1.3统计学方法 应用SPSS 23.0统计软件分析数据。计量资料比较采用单因素方差分析、SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1下调HIF-1α对大鼠膝关节的影响 对照组大鼠关节未见明显炎细胞浸润,未见明显关节周围炎症和骨破坏。模型组和NC组大鼠组织内有大量炎细胞浸润,关节面出现大量骨破坏,病理学评分高(P<0.01)。si-HIF-1α组可见部分炎性细胞浸润,存在不同程度的增生,部分出现骨质的破坏。病理总评分下降,但仍高于对照组(P<0.05)。见图1,表2。

图1 各组大鼠膝关节HE染色
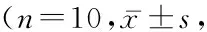
表2 各组大鼠HE染色病理评分Table 2 Pathological score of rats in each group after HE staining 分)
2.2下调HIF-1α对各组大鼠关节组织炎症因子的影响 与对照组相比,模型组和NC组大鼠外周血IL-1β、IL-6、TNF-α分泌显著升高(P<0.01),而si-HIF-1α组组大鼠外周血炎症因子IL-1β、IL-6、TNF-α分泌相对于模型组NC组大鼠显著降低(P<0.01),但仍显著高于对照组和模型组(P<0.05)。见表3。
表3 下调HIF-1α对各组大鼠关节组织炎症因子的影响Table 3 Effect of down-regulation of HIF-1α on serum inflammatory factors in rats

表3 下调HIF-1α对各组大鼠关节组织炎症因子的影响Table 3 Effect of down-regulation of HIF-1α on serum inflammatory factors in rats
组别IL-1βIL-6TNF-α对照组45.717±2.731106.441±13.122104.410±10.817模型组112.921±5.124*175.144±17.136*140.108±16.713*NC组104.041±6.411*177.140±12.262*139.116±15.816*si-HIF-1α组55.182±7.616*#123.168±12.342*#111.163±16.376*#F值31.22118.97922.860P值 <0.001<0.001<0.001
*P值<0.01与对照组比较 #P值<0.05与模型组比较(SNK-q检验)
2.3下调HIF-1α对各组大鼠骨关节组织JUN及ASC mRNA表达的影响 与对照组相比,NC组合模型组大鼠骨关节组织JUN及ASC mRNA表达上调,差异有统计学意义(P<0.01),而si-HIF-1α组大鼠大鼠骨关节组织的JUN及ASC mRNA表达水平均显著低于模型组,同时显著低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 下调HIF-1α对各组大鼠关节组织炎症因子的影响Table 4 Effect of down-regulation of HIF-1α on inflammatory factors in joint tissues of rats

表4 下调HIF-1α对各组大鼠关节组织炎症因子的影响Table 4 Effect of down-regulation of HIF-1α on inflammatory factors in joint tissues of rats
组别JUNASC对照组1.127±0.1130.439±0.014模型组1.533±0.05*0.835±0.011*NC组1.507±0.063*#0.81±0.002*#si-HIF-1α组1.281±0.013*#△0.40±0.012*#△F值17.11113.119P值<0.001<0.001
*P值<0.01与对照组比较 #P值<0.05与模型组相比 △P值<0.01与NC组比较(SNK-q检验)
2.4下调HIF-1α对各组大鼠骨关节组织JUN及ASC蛋白表达的影响 与对照组相比,NC组合模型组大鼠骨关节组织JUN及ASC蛋白表达上调,结果具有显著的统计学意义(P<0.01),而si-HIF-1α组大鼠大鼠骨关节组织的JUN及ASC蛋白表达水平均显著低于模型组,同时显著低于对照组,结果差异有统计学意义(P<0.05)。见图2,表5。

图2 下调HIF-1α对各组大鼠骨关节组织JUN及ASC蛋白表达的影响
表5 下调HIF-1α对各组大鼠骨关节组织JUN及ASC蛋白表达的影响表5 Effects of down-regulation of HIF-1α on the expression of JUN and ASC proteins in bone and joint tissues of rats in each group
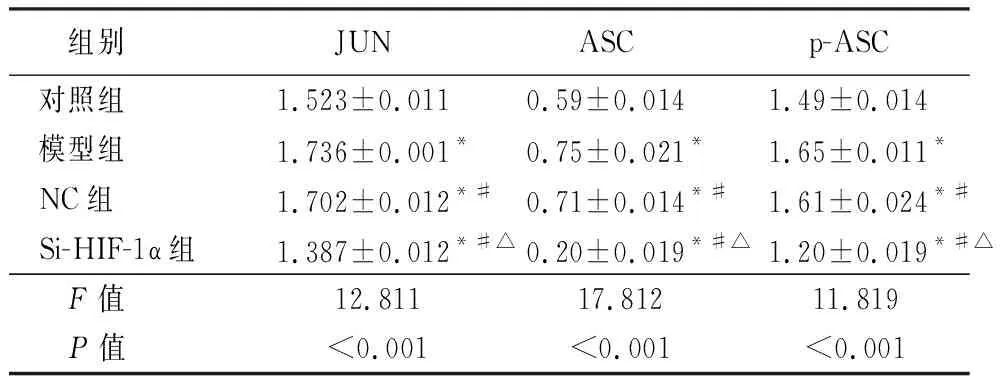
表5 下调HIF-1α对各组大鼠骨关节组织JUN及ASC蛋白表达的影响表5 Effects of down-regulation of HIF-1α on the expression of JUN and ASC proteins in bone and joint tissues of rats in each group
组别JUNASCp-ASC对照组1.523±0.0110.59±0.0141.49±0.014模型组1.736±0.001*0.75±0.021*1.65±0.011*NC组1.702±0.012*#0.71±0.014*#1.61±0.024*#Si-HIF-1α组1.387±0.012*#△0.20±0.019*#△1.20±0.019*#△F值12.81117.81211.819P值<0.001<0.001<0.001
*P值<0.01与对照组比较 #P值<0.05与模型组比较 △P值<0.01与NC组比较(SNK-q检验)
3 讨 论
骨关节炎(osteoarthritis,OA)被认为是一种软骨疾病,其发展缓慢常被视为一种慢性病,病程通常超过10~15年,对日常活动和工作能力造成较大影响,严重者会发生关节残疾、影响患者生活质量[10-12]。OA的临床表现主要为关节的红、肿、热、痛、功能障碍及关节畸形,病理变化最初发生于关节软骨,以后侵犯软骨下骨板及滑膜等关节周围组织,以关节面及其边缘的软骨变性以及新骨形成为主要特征。发病机制较为复杂,一般认为与衰老、创伤、炎症、肥胖、自身免疫反应、代谢和遗传、退行性病变等因素有关,但精确的分子机制尚不清晰[13-14]。低氧诱导因子HIF-1参与体内环境氧浓度的平衡,当暴露于厌氧或低氧环境中,机体会立即产生应激或耐氧适应。在氧浓度正常情况下,HIF-1特定位置脯氨酰残基羟基化后会立即引起泛素化,在低氧条件下,HIF-1以细胞特异性表达方式调控数百个基因的转录[15]。研究表明HIF-1可以抑制剂治疗肺动脉高压,也有研究表明HIF-1参与了氧化应激对肾损伤时的纤维化变化过程,但是HIF1在膝骨关节炎中的作用尚不清晰[16-17]。因此本研究通过建立大鼠膝骨关节炎模型发现,膝骨关节炎过程中大鼠膝关节损伤及病理评分均显著升高,而下调HIF-1α后,骨关节损伤程度显著降低,提示出HIF-1α可能参与到骨关节组织的病理损伤修复过程,由于膝骨关节炎是一种炎症疾病,因此本研究通过ELISA探究了骨关节组织内部的炎症因子表达水平,结果表明膝骨关节炎过程中,关节组织IL-1、IL-6、TNF-α显著升高,而下调HIF-1α后,关节组织IL-1、IL-6、TNF-α显著降低,提示出HIF-1α可以发挥一定的抑制炎症因子释放的作用,从而降低骨关节组织的炎性损伤。
ASC是NLRP3炎症小体的重要组成部分,参与多种炎性疾病,在此过程中JUN/ASC 泛素化和磷酸化等修饰促进 NLRP3炎性体激活[18-19],但是HIF-1是否可以调控ASC尚不清晰。因此本研究通过Western blot实验探究HIF-1α是否可以通过影响炎性小体ASC结构域及其磷酸化修饰来调控炎症因子释放,结果表明HIF-1α下调后,JUN表达水平下降,由于JUN是调控ASC磷酸化的重要分子,因此本研究分析了ASC的表达和磷酸化水平,结果表明ASC表达和磷酸化修饰均显著降低。
综上所述,本研究证实HIF-1可以通过调控炎性小体ASC发挥膝骨关节的保护作用,其机制与ASC的磷酸化修饰有关。本研究可以通过临床样本探究HIF-1和ASC在骨关节组织中的表达,为临床HIF-1α及炎性小体的研究提供有力数据支撑。

