LncRNA NBAT-1抑制IL-1β对结直肠癌细胞迁移、侵袭作用的研究
叶静华 沈预程 朱娅
结直肠癌(colorectal cancer)是世界第三大常见癌症,>90%的患者死于其转移、复发[1]。原发性结直肠癌源于胃肠道上皮细胞,癌细胞获得间质细胞表型后能够离开原发肿瘤部位,侵入周围组织,并迁移到远处器官[2]。这种上皮细胞转化为具有间充质表型的转换过程称为上皮-间充质转化(epithelial-to-mesenchymal transition,EMT)。有研究报道,炎症能够促进癌细胞EMT过程的发生[3]。白介素1β(Interleukin-1,IL-1β)是促炎因子的重要成员,在促进癌症(包括结直肠癌)恶化中占有重要地位[4]。长链非编码RNA(lncRNAs)在结直肠癌的生长和转移中起着重要作用[5,6],如lncRNA FLVCR1-AS1、lncRNA XIST[7,8]。LncRNA 神经母细胞瘤相关转录本-1(neuroblastoma associated transcript-1,NBAT-1)在人类的大部分癌症中均扮演抑癌基因的角色[9-11],但是其在结直肠癌中的作用研究甚少。本实验观察IL-1β对结直肠癌细胞增殖、迁移侵袭的调控,探讨lncRNA NBAT-1在结直肠癌细胞EMT过程的功能及机制。
1 材料与方法
1.1 材料 重组人白介素1β(IL-1β)购自美国AbMole;结肠癌细胞HCT116购自上海科学研究院细胞库;pcDNA3.1载体购自上海吉满生物公司;LipofectamineTM3000购自美国Invitrogen;兔抗E-cadherin单克隆抗体、兔抗N-cadherin单克隆抗体、Vimentin单克隆抗体和辣根过氧化物酶标记的二抗均购自上海艾博抗;细胞计数试剂盒(cell counting kit,CCK8)购自日本同仁;Trizol液购自上海华舜生物;荧光定量反转录聚合酶链式反应(qRT-PCR)试剂盒购自日本TAKERA;Transwell小室、Matrigel基质胶均购自美国Corning。
1.2 方法
1.2.1 细胞培养:使用含有10%胎牛血清的DMEM培养基培养结直肠癌细胞HCT116。培养时,将细胞置于37℃、5%CO2、饱和湿度的恒温培养箱中培养,隔天更换一次培养液。
1.2.2 分组与处理:将正常培养的HCT116细胞标记为正常组。对IL-1β稀释至0、0.10、1.00、10.00 ng/ml的细胞培养液培养HCT116细胞标记为对照组、0.10 ng/ml组、1.00 ng/ml组、10.00 ng/ml 组。筛选最适浓度1.00 ng/ml IL-1β处理48 h的HCT116细胞记为IL-1β组。pcDNA组(转染空载体pcDNA3.1)、pcDNA-lncRNA NBAT-1组(共转染pcDNA3.1和lncRNA NBAT-1)、IL-1β+pcDNA组(转染空载体pcDNA3.1并用1.00 ng/ml IL-1β处理)、IL-1β+pcDNA-lncRNA NBAT-1组(共转染pcDNA3.1和lncRNA NBAT-1并用1.00 ng/ml IL-1β处理)细胞使用LipofectamineTM3000转染HCT116细胞,转染12 h后,更换培养液并继续培养48 h。qRT-PCR法检测转染的效率,确定成功转染后再用于后续研究。
1.2.3 CCK8法检测细胞增殖:将各组需要检测的细胞调整至105个/ml。取200 μl置于96 孔板中,分别培养24、48、36、72 h。结束后,取10 μl CCK8溶液,检测细胞在490 nm波长下的吸光值(OD490)。
1.2.4 Transwell小室检测细胞迁移侵袭:收集需要检测的细胞,将细胞培养液更换为不含血清的培养液,进行饥饿处理12 h。结束后调整细胞值5×105个/ml,取200 μl均匀平铺小室的上室表面。检测细胞侵袭是需要先将上室平铺一层Matrigel基质胶,然后再加入细胞,检测细胞迁移则不需要加入Matrigel基质胶。再将小室下室中加入500 ml含有血清的培养液。然后将小室置于37℃恒温细胞培养箱中常规培养12 h。结束后,轻轻取出小室,用4%甲醛固定细胞,0.1%的结晶紫染色,最后在显微镜下观察计数细胞。
1.2.5 qRT-PCR检测细胞lncRNA NBAT-1表达:收集各组细胞,使用Trizol液提取细胞总RNA,并将其反转录为cDNA。使用qPCR试剂盒检测上述cDNA中lncRNA NBAT-1的表达水平。GAPDH为内参,2-ΔΔCt法计算lncRNA NBAT-1相对表达量。反应程序为:95℃变性2 min进入扩增循环;循环包括95℃先变性30 s再60℃退火30 s,72℃延伸50 s扩增进行41个循环;最后72℃保持5 min。引物信息:lncRNA NBAT-1,上游引物5’-ATTTCTGCTCCTGGGTCTTAC-3’,下游引物5’-AGTGGCTTGTCTGTTAGAGTC-3’;GAPDH ,上游引物5’-CACCCACTCCTCCACCTTTG-3’,下游引物5’-CCACCACCCTGTTGCTGTAG-3’。
1.2.6 WB实验检测细胞E-cadherin、N-cadherin和Vimentin蛋白表达:收集各组需要检测的细胞,置于冰上用RIPA裂解液裂解30 min。提取充分裂解的细胞总蛋白。按照BCA蛋白定量试剂盒要求操作,对蛋白定量。使用100℃沸水,煮沸处理10 min,对蛋白进行变性。取变性后的蛋白上清用于SDS-PAGE蛋白电泳。将凝胶上的蛋白使用转膜仪转移至PVDF膜上,整个转膜过程需在0℃低温条件下进行。转膜结束后使用2.5%的脱脂奶粉将膜37℃封闭处理2 h。结束后充分洗膜,将膜转移至稀释好的E-cadherin(1∶1 000)、N-cadherin(1∶500)和Vimentin(1∶1 000)一抗溶液中,4℃孵育过夜。次日,取出膜,充分洗涤后,将膜转移至稀释好的辣根过氧化物酶标记的二抗溶液(1∶500)中,37℃孵育2 h。最后将膜用ECL电化学发光试剂盒显影、曝光。
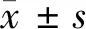
2 结果
2.1 IL-1β促进结直肠癌细胞增殖 与对照组比较,0.10 ng/ml组在36、72 h的增殖显著升高,1.00 ng/ml组在24、36、72 h的增殖显著升高,10.00 ng/ml组在24、36、72 h的增殖显著升高(P<0.05)。选用IL-1β的最适浓度是1.00 ng/ml。见表1。
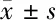
表1 不同浓度IL-1β对结直肠癌细胞增殖的影响 n=9,
2.2 IL-1β抑制结直肠癌细胞lncRNA NBAT-1表达 与对照组比较,1.00、10.00 ng/ml组细胞中lncRNA NBAT-1表达均显著降低(P<0.05)。见表2。
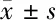
表2 不同浓度IL-1β对结直肠癌细胞lncRNA NBAT-1表达的影响 n=9,
2.3 IL-1β促进结直肠癌细胞迁移和侵袭 与对照组比较,0.10、1.00、10.00 ng/ml组迁移细胞数和侵袭细胞数均显著升高(P<0.05)。见表3,图1。

对照组 0.10 ng/ml组 1.00 ng/ml组 10.00 ng/ml组
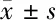
表3 不同浓度IL-1β对结直肠癌细胞迁移和侵袭的影响 n=9,个,
2.4 过表达lncRNA NBAT-1抑制结直肠癌细胞增殖、迁移和侵袭 与pcDNA组比较,pcDNA-lncRNA NBAT-1组癌细胞中lncRNA NBAT-1表达显著升高(P<0.05),24、36、72 h的增殖均显著降低(P<0.05),且迁移细胞数和侵袭细胞数均显著降低(P<0.05)。见表4。
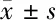
表4 过表达lncRNA NBAT-1对结直肠癌细胞增殖、迁移和侵袭的影响 n=9,
2.5 过表达lncRNA NBAT-1部分逆转IL-1β对结直肠癌细胞的促进作用 与对照组比较,IL-1β组癌细胞中lncRNA NBAT-1表达显著降低,24、36、72 h的增殖均显著升高,迁移细胞数和侵袭细胞数均显著升高(P<0.05);与IL-1β+pcDNA组相比,IL-1β+pcDNA-lncRNA NBAT-1组癌细胞中lncRNA NBAT-1表达显著升高,24、36、72 h的增殖均显著降低,迁移细胞数和侵袭细胞数均显著降低(P<0.05)。见表5。
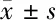
表5 过表达lncRNA NBAT-1和IL-1β诱导结直肠癌细胞增殖、迁移和侵袭的影响 n=9,
2.6 IL-1β、lncRNA NBAT-1对结直肠癌细胞上皮-间质转化的影响 与对照组比较,IL-1β组癌细胞中E-cadherin、N-cadherin蛋白表达均显著升高(P<0.05),Vimentin蛋白表达显著降低(P<0.05);与IL-1β+pcDNA组相比,IL-1β+pcDNA-lncRNA NBAT-1组癌细胞中E-cadherin、N-cadherin蛋白表达均显著降低(P<0.05),而Vimentin蛋白表达显著升高(P<0.05)。见表6,图2。

图2 WB实验检测结直肠癌细胞E-cadherin、N-cadherin、Vimentin蛋白表达
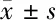
表6 过表达lncRNA NBAT-1和IL-1β对结直肠癌细胞上皮-间质转化的影响 n=9,
3 讨论
结肠上皮细胞中可检测到IL-1α和IL-1β的表达,而在结肠癌细胞中IL-1β的表达极大减少,但是与正常组织相比,结直肠癌中IL-1β表达升高,这可能与结直肠癌中的肿瘤引起的免疫细胞异常有关[12]。IL-1的促肿瘤功能已经得到世界的公认,尤其是IL-1β,其作为一种主要的促炎细胞因子,主要由天然免疫细胞表达[13]。IL-1β可能通过促进血管内皮生长因子的表达直接作用于人类结肠癌细胞,促进EMT、侵袭,激活促进癌症生长的Wnt信号和促肿瘤生长基因的表达。IL-1β和IL-1RA的多态性已被证明与Ⅱ期结肠癌的肿瘤复发相关,IL-1RA与结直肠癌风险相关[14,15]。Megan等[16]发现,IL-1β能够阻碍癌结肠细胞对营养物质丁酸的利用和氧化,并且抑制线粒体的基本呼吸,降低线粒体的能量储备量,揭示IL-1β在结直肠癌中阻滞基础代谢的作用,并暗示IL-1β抑制剂的治疗靶点价值。Cui等[17]通过实时定量PCR检测结直肠癌组织中IL-1β的表达发现,IL-1β的表达明显高于癌旁组织,其表达主要在IL-1β受体集中的结直肠癌上皮细胞和基质细胞中,揭示IL-1β受体免疫反应与结直肠癌进展的关系。本研究检测分析了不同浓度IL-1β处理不同时间的结直肠癌细胞的存活、迁移侵袭状况发现,IL-1β呈浓度、时间依赖性促进结直肠癌细胞的增殖、迁移和侵袭,这均与前人的结果相符合。重要的是,IL-1β还抑制结直肠癌细胞中lncRNA NBAT-1的表达水平,推测这可能与IL-1β促进结直肠癌细胞增殖、迁移侵袭有关。
越来越多的证据表明人类癌症中lncRNA失调贯穿肿瘤的起始、晚期发展、预后或死亡的全过程[18]。lncRNA NBAT-1在大多数癌症中扮演抑癌基因的角色,如神经母细胞瘤、乳腺癌、卵巢癌、肾癌、肺癌、肝癌、胃癌、舌鳞状细胞癌等[9-11]。有研究报道,lncRNA NBAT-1在胃癌组织中的表达水平降低,且与肿瘤的分化、分期、淋巴转移及预后不良密切相关;过表达lncRNA NBAT-1还可抑制胃癌细胞的增殖、迁移和侵袭,并抑制脐静脉内皮细胞的增殖、迁移和毛细血管形成[19]。但是,最近Mohadese等[20]在研究中报道,lncRNA NBAT-1 在结直肠癌组织中的表达水平上调,但是其表达水平随着肿瘤分期的增加而降低,遗憾的是其在结直肠癌中的功能及发挥作用的机制均未进行下一步研究。本研究检测lncRNA NBAT-1在IL-1β处理的结直肠癌细胞中的表达,发现其表达量随着IL-1β浓度的升高而降低。为探究lncRNA NBAT-1对结直肠癌细胞增殖、迁移侵袭的作用,本文建立了过表达lncRNA NBAT-1的结直肠癌细胞,并观察其增殖、迁移侵袭变化。结果发现,过表达lncRNA NBAT-1明显的抑制了结直肠癌细胞的增殖、迁移和侵袭能力,证实其具有抑制结直肠癌转移的功能。进一步研究还发现,过表达lncRNA NBAT-1还可显著抑制IL-1β对结直肠癌细胞增殖、迁移侵袭的促进作用,并且抑制E-cadherin、N-cadherin的表达,促进Vimentin表达,揭示了lncRNA NBAT-1抑制结直肠癌细胞迁移侵袭的机制与削弱IL-1β的作用,下调E-cadherin、N-cadherin,上调Vimentin有关。
综上所述,lncRNA NBAT-1抑制结直肠癌细胞的迁移和侵袭,产生这种作用的机制与抑制E-cadherin、N-cadherin,促进Vimentin有关,为结直肠癌患者的预后提供支持。

