转录因子TWIST1干扰神经发生对睡眠剥夺小鼠抑郁样行为的影响
白布加甫·高娃 热依汗古丽·阿不来提 林凯
重度抑郁症 (major depression disease,MDD) 是一类常见的精神疾病,该病影响着大约 20%的世界人口[1]。睡眠功能障碍是抑郁症患者的重要特征[2]。睡眠剥夺诱发抑郁样行为的小鼠前额叶皮层与海马体中都有检测出结构缺陷,伴随着树突棘密度与长度的降低[3]。此外,树突棘结构的动态变化也被发现与小鼠抑郁样行为表现密切相关[4]。因此,通过提高神经发生途径来提高神经元结构可塑性将有利于MDD治疗。TWIST1 是一种高度保守的碱性螺旋-环-螺旋(helix-loop-helix)结构转录因子[5]。此外,TWIST1是一种促癌基因,通过EMT作用,促进多类癌症侵袭,转移与恶化。由于癌症患者罹患抑郁症的风险提高[6],且TWIST1在神经元中亦存在表达,因此,TWIST1可能与神经元生理改变相关。一项研究表明,TWIST1 在神经元中的高度表达是突变亨廷顿蛋白诱导的神经元死亡的重要上游介质[7]。因此,本研究拟探索TWIST1是否通过抑制神经发生降低神经元结构可塑性,造成睡眠剥夺小鼠抑郁样行为。
1 材料与方法
1.1 实验材料与仪器 Lipofectamine 3000 试剂盒(美国Invitrogen公司,128231);5-溴脱氧尿嘧啶核苷(5-Bromodeoxyuridinc,BrdU,美国Sigma公司,135210);Anti-mouse BrdU抗体(英国abcam公司,ab7231);Anti-mouse TWIST1、Anti-mouse Wnt3a与Anti- mouse β-catenin抗体(北京博奥森生物科技公司,bs13598、bs13832、bs13384);Alexa flour 488 Goat anti-rat IgG(H+L) (武汉三鹰生物科技公司,193822);HRP conjugated goat anti mouse/rabbit IgG(H+L)(上海碧云天生物科技公司,b183237、b277372)。悬尾测试设备、强迫游泳测试设备、旷场测试设备、Morris水迷宫设备(江苏赛昂斯公司,SA210、SA209、SA224、SA204);倒置荧光显微镜(美国OLYMPUS公司,IX53);凝胶电泳装置(美国BioRad公司,Mini-protean Tetra);膜片钳系统(瑞士Axon公司,型号:MultiClamp 700B,MultiClamp 1550B);化学发光成像仪(上海天能生物公司,1600/1600R)。
1.2 实验动物来源与分组 48只C57BL/6小鼠,SPF级,雌性,5周龄,体重17~19 g,由新疆医科大学实验动物中心提供,生产许可证号:SCXK(新)2018-0002。所有小鼠入组后饲养于新疆医科大学SPF级动物房中,控制饲养环境恒温(22.0±2.0)℃,恒湿(60±5)%,自由饮食摄水。适应性喂养1周,将小鼠按数字随机法分为对照(Con)组,对照+LV-sh TWIST1(Con+ LV-sh TWIST1)组,睡眠剥夺(SD)组,睡眠剥夺+LV-sh TWIST1(SD+ LV-sh TWIST1)组,每组12只。
1.3 实验方法 慢病毒 shRNA (U6-MCS-Ubi-EGFP) 用于敲低小鼠内侧前额叶中 TWIST1 的表达,靶基因序列为 GCTGAGCAAGATTCAGACC,由南京金斯瑞公司设计与合成。将合成的靶基因序列核苷酸插入到慢病毒表达质粒中,进一步使用Lipofectamine 3000 试剂盒将质粒转染到HEK-293T细胞中。转染72 h后,收集含重组慢病毒的培养基,检测病毒滴度。取LV-shTWIST1 (1.0 × 109GC/ml),在 MCAO 前1周通过脑室内注射到左侧脑室,每只5 μl。脑室注射坐标如下:AP∶1.9 mm; ML∶± 0.4 mm; DV∶-2.4 mm。注射完成后,注射针停留2 min,注射孔使用骨蜡覆盖。参考文献[8]中方法构建睡眠剥夺模型。睡眠剥夺实验箱中放置多个直径3 cm,高8 cm的圆柱体金属平台,平台之间间隔5 cm,箱内注水2 cm。取睡眠剥夺组小鼠,小鼠可以在各平台间自由移动且自由进食、饮水。由于各平台之间存在较大间隔,小鼠进入睡眠时,会由于全身肌张力降低,节律性垂头而跌入水中,此时小鼠受水惊吓会苏醒并爬上平台,梳理皮毛,以此达到睡眠剥夺目的。模型构建时间为连续7 d,期间换水2次/d。对照组小鼠放置在柱体平台上,小鼠可以顺利进食、饮水,但平台底部无积水。小鼠模型构建期间,腹腔注射BrdU 0.9%氯化钠溶液1次/d,剂量50 mg/kg。完成睡眠剥夺模型构建后,开展小鼠行为学测试,包括糖水偏好测试,悬尾测试,强迫游泳测试,旷场测试与Morris水迷宫测试,分别用于评估小鼠抑郁样症状与学习、记忆能力。处死小鼠,取小鼠海马体用于Western blot实验,评估TWIST1对神经发生蛋白表达的影响,取小鼠全脑组织用于电生理检测与免疫荧光实验,检测长时程电位与BrdU蛋白表达的变化。
1.4 行为学测试
1.4.1 糖水偏好测试(sucrose preference test,SPT):将小鼠分笼饲养,每笼1只,开始糖水偏好适应性训练,每笼分别插入一瓶1%蔗糖溶液(w/v) 与白开水,小鼠自由饮用适应6 h。将小鼠禁食禁水12 h,开启糖水偏好测试,每笼重新放入1瓶1%蔗糖溶液和白开水,分别称量蔗糖水与白开水水壶质量。小鼠自由饮用测试12 h,再次称量蔗糖水与白开水质量。根据以下公式计算小鼠糖水摄取率,糖水摄取率=(蔗糖水消耗量)/(蔗糖水消耗量+白开水消耗量)×100%。
1.4.2 悬尾测试(tail suspension test,TST):距尾尖约 1 cm处,将小鼠用胶带固定悬挂在TST箱中,摄像机拍摄记录小鼠悬挂后6 min内行为,前2 min适应,后4 min测试,计算机软件分析小鼠中心不动时间。
1.4.3 强迫游泳测试(forced swimming test,FST):将小鼠投入FST水箱中,维持水温(22.0±2.0)℃,摄像机拍摄记录小鼠投入水中6 min内行为,前2 min适应,后4 min测试,计算机软件分析小鼠中心不动时间。
1.4.4 旷场测试:将小鼠置入旷场测试箱中,测试箱底部由4×4边长为10 cm的正方形构成,摄像机拍摄记录小鼠在箱体中的行为活动,前2 min适应,后4 min测试,计算机软件分析小鼠中心穿越各个正方形的次数(最高记录200次)。
1.4.5 Morris水迷宫测试:水迷宫主体是一个圆形水池高40 cm,直径120 cm,周围由50 cm高的水池壁,由遮光窗帘隔开。水池中注入约30 cm高清水,调控水温(22.0±2.0)℃。水迷宫分析系统将水面分为4个象限,第Ⅲ象限中央设置一个逃生平台。整个水迷宫测试分为定位巡航测试与空间探索测试期。定位巡航测试中,将各组小鼠自各个象限依次丢入水中,自由游泳,寻找逃生平台,训练时间90 s,4次/d,连续4 d。当小鼠登上平台,系统自动停止,记录这段时间为逃避潜伏期。若小鼠90 s内无法登上平台,则引导至平台,记逃避潜伏期为90 s。第5天开始空间探索测试,撤去逃生平台,将小鼠自第Ⅰ象限丢入水中,自由探索90 s。记录小鼠首次穿越逃生平台时间,穿越逃生平台次数及第Ⅲ象限中停留时间。
1.5 Western blot检验 4组小鼠脱脊椎处死,取出脑组织后分离出海马体,-80℃超低温冰箱中储存备用。称取约20 μg海马体,加入100 μl 含PMSF的RIPA裂解液,匀浆成细胞悬液,静置30 min待充分裂解。离心20 min(4℃/12 000 min),吸取上清液,加入上样缓冲液,沸水中加热10 min。取SDS-PAGE凝胶,每孔加入等体积样品开始凝胶电泳,设置条件为30 V/30 min,100 V/60 min,上样缓冲液达底部时停止。湿法转移凝胶上目标蛋白至PVDF膜,条件为2 mA/60 min。取PVDF膜放入3% BSA中封闭2 h,4℃孵育一抗稀释液过夜。次日,HRP标记二抗室温孵育2 h,加ECL超敏发光液,化学发光成像仪下获得目标蛋白条带。
1.6 电生理测试 将小鼠脱脊椎处死,取脑组织放入预冷且氧饱和的人工脑脊液(ACSF)中静置1 min,去除小脑,沿小鼠矢状线分开左右半脑,分离除去额叶,顶叶等组织,仅留下海马体固定于切片机浴槽中,切成350 μm厚切片并转移至氧饱和且30℃预热的ACSF中,持续通入氧气孵育2 h。转移海马体切片至记录浴槽中,持续泵入氧饱和ACSF维持神经元状态。将金属同心圆电极(MCE-100/200)插入海马Schaffer侧支处作为刺激电极。将玻璃微电极插入海马锥体神经元CA1区顶树突区域作为记录电极,充灌氯化钠溶液作为电极内液。采用细胞外场电位模式刺激,精确控制刺激电极与记录电极位置、深度,诱发场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP)。找到fEPSP最大信号强度,以最大信号强度相应的50%作为刺激基线。在基线稳定记录20 min后,用经典的高频刺激诱导方式进行刺激,诱发长时程单位增强(long term potentiation,LTP)。刺激条件:连续3串高频脉冲,100 Hz/串,共100次,每串间隔5 s,连续记录60 min作为原始数据。统计Rise slope对诱导前后进行比较,并进行标准化数据计算,对LTP是否发生及发生程度进行量化统计。
1.7 免疫荧光 将小鼠以CO2处死,打开胸腔,PBS心脏灌流,再用4%多聚甲醛溶液灌注。取出完整脑组织,截去小脑、嗅球等组织,放入4%多聚甲醛溶液中固定>24 h。梯度浓度乙醇脱水处理脑组织,再以聚乙二醇和聚乙烯醇混合液冷冻包埋。冰冻切片机将包埋组织切成5 μm厚切片,收集海马区位置明显的切片于PBST溶液中清洗,转移切片放入含10%驴血清的PBST溶液中封闭2 h,加入Anti-mouse BrdU抗体(1∶100),4℃孵育过夜。次日,PBST清洗切片,在Dylight 488标记二抗溶液中避光孵育1 h。PBST清洗切片,滴加DAPI染液,37℃避光孵育15 min,滴加抗荧光猝灭剂,荧光显微镜下观察并拍照记录。

2 结果
2.1 敲低TWIST1表达提高小鼠糖水偏好率与旷场测试评分,降低悬尾与强迫游泳不动时间 与Con组比较,Con+LV-sh TWIST1组小鼠糖水偏好率与旷场测试评分增加,悬尾与强迫游泳不动时间减少,但SD组糖水偏好率与旷场测试评分明显减少(P<0.05),悬尾与游泳不动时间明显增加(P<0.05);然而,与SD组比较,SD+LV-sh TWIST1组糖水偏好率与旷场测试评分明显增加(P<0.05),悬尾与游泳不动时间明显减少(P<0.05)。见表1。
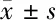
表1 4组小鼠行为学测试结果比较 n=12,
2.2 敲低TWIST1表达降低了小鼠逃避潜伏期,增加穿越平台次数与第Ⅲ象限停留时间 与Con组比较,Con+LV-sh TWIST1组逃避潜伏期没有明显变化,但SD组自第3天起明显增加(P<0.05);然而,与SD组比较,SD+LV-sh TWIST1组在第4天明显减少(P<0.05)。空间探索测试中,与Con组比较,Con+LV-shTWIST1组首次到达平台时间,穿越平台次数与第Ⅲ象限停留时间没有明显改变,但SD组首次到达平台时间与第Ⅲ象限平台时间明显增加(P<0.05),穿越平台次数明显减少(P<0.05)。然而,与SD组比较,SD+ LV-sh TWIST1组首次到达平台时间与第Ⅲ象限平台时间明显减少,差异有统计学意义(P<0.05),穿越平台次数明显增加,差异有统计学意义(P<0.05)。见表2、3。
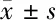
表2 4组小鼠水迷宫定位巡航时逃避潜伏期比较 n=12,s,
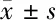
表3 4组小鼠水迷宫空间探索时的指标结果比较 n=12,
2.3 敲低TWIST1表达有助于激活Wnt3a/β-catenin信号通路 与Con组比较,Con+ LV-sh TWIST1组TWIST1表达明显降低(P<0.05),Wnt3a与β-catenin蛋白表达没有明显变化,但SD组TWIST1表达明显增加(P<0.05),且Wnt3a与β-catenin蛋白表达明显减少(P<0.05);然而,与SD组比较,SD-LV-sh TWIST1组TWIST1表达明显减少(P<0.05),且Wnt3a与β-catenin蛋白表达明显增加(P<0.05)。见图1,表4。
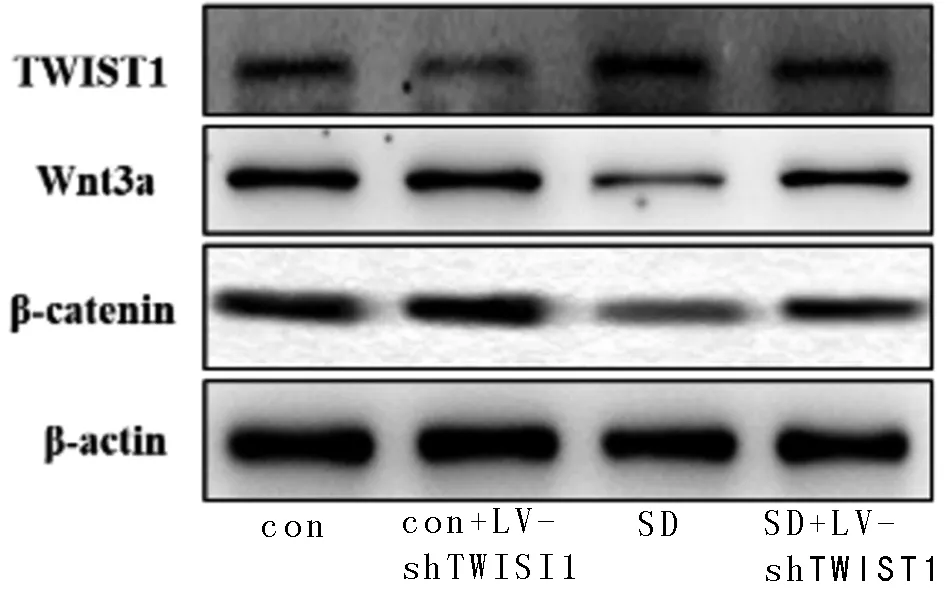
图1 4组小鼠TWIST1与Wnt3a/β-catenin蛋白表达
表4 4组小鼠TWIST1与Wnt3a/β-catenin蛋白表达 n=4,
2.4 敲低TWIST1表达有助于提高fEPSP斜率 与Con组比较,Con+ LV-sh TWIST1组fEPSP斜率没有明显变化,但SD组fEPSP斜率明显降低(P<0.05);然而,与SD组比较,SD-LV-sh TWIST1组fEPSP斜率明显增加(P<0.05)。见图2,表5。
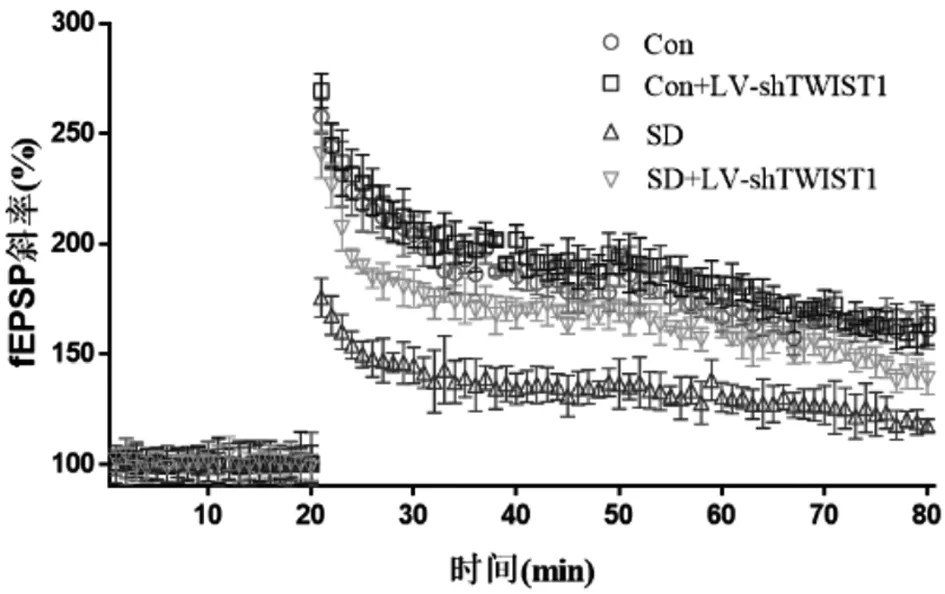
图2 4组小鼠fEPSP斜率
表5 4组小鼠fEPSP斜率比较 n=4,%,
2.5 敲低TWIST1表达有助于提高BrdU阳性细胞数 与Con组比较,Con+ LV-sh TWIST1组BrdU阳性细胞数增加,但无差异(P>0.05),SD组BrdU阳性细胞数减少(P<0.05);与SD组相比,SD-LV-sh TWIST1组BrdU阳性细胞数增加(P<0.05)。见图3,表6。
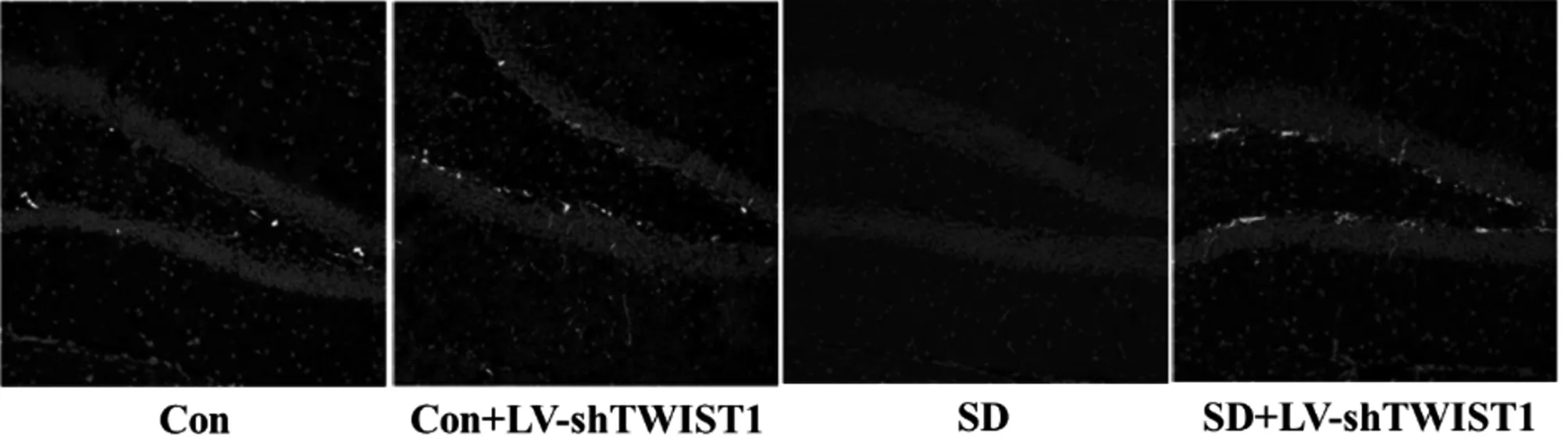
图3 4组小鼠BrdU阳性细胞染色
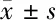
表6 4组小鼠BrdU阳性细胞量化统计比较 n=4,个,
3 讨论
随着社会经济高速发展带来的工作压力增大,越来越多城市工作者出现睡眠障碍,严重影响了生活质量。流行病学研究显示睡眠障碍者有50%~90%被诊断患有抑郁症[9]。此外,普通人群中,有20%抑郁症患者主观抱怨失眠[10]。因此,睡眠障碍不仅会造成抑郁症发病,也是抑郁症最常见伴随症状。主要表现有入睡困难、易惊醒、早醒以及总睡眠时间减少。完整的睡眠周期是人类生理活动必需,正相睡眠期是指机体由清醒进入睡眠状态,此时全身肌肉虽松弛但仍保持一定的紧张度。而异相睡眠期是指深睡状态,此时肌肉更加松弛,肌腱反射消失[11]。利用这一生理特性,本研究将小鼠放置在仅能满足紧张性肌肉行动的平台上,当小鼠进入异相睡眠状态时,由于肌肉松弛会跌入水中从而被惊醒,从而达到睡眠剥夺状态,连续7 d模型构建以造成小鼠出现抑郁样症状。以此模拟临床睡眠质量差,易惊醒的抑郁症患者状态。
不同周期的睡眠剥夺对抑郁症存在不同影响。短期、急性的睡眠剥夺能够在一定程度上缓解患者抑郁症状,增加脑内5-羟色氨酸神经递质传递,提高去甲肾上腺素转运体的表达,抑制HPA轴信号激活[12,13]。然而,长期、持久的睡眠障碍会造成体内多种神经递质传递、代谢紊乱,不仅可能诱发抑郁症,而且会加剧患者抑郁症状[14,15]。本研究观察到连续7 d的睡眠剥夺造成小鼠出现抑郁样行为。与Con组比较,SD组糖水摄取率降低,即小鼠表现出无喜感偏好现象。与此同时,SD组强迫游泳与悬尾测试不动时间明显增加,旷场测试评分明显减少,即小鼠表现出沮丧行为,且不愿意社交探索。此外,SD组小鼠水迷宫测试中首次到达平台时间增加,穿越平台象限次数减少,第Ⅲ象限停留时间减少,即小鼠表现出认知功能障碍行为。综合以上行为学结果表明小鼠出现了与临床患者类似的情绪低落、不愿社交、思维迟缓且运动受限症状。
TWIST1涉及的中枢神经系统研究较少,其下游信号通路主要涉及癌症相关研究。最近研究显示,TWIST1在大脑组织中包括嗅球、海马以及小脑区域都有表达,并且主要定位于神经元中[16]。长期的社交刺激应激模型会造成海马区TWIST1表达明显升高,且与小鼠抑郁样行为存在相关性[16]。本研究结果也显示,SD组TWIST1表达相比于Con组明显升高。我们采用了慢病毒沉默方式特异性降低了脑区TWIST1表达,行为学结果上显示,SD+LV-shTWIST1组小鼠抑郁样行为明显改善。
现阶段,抗抑郁治疗主要以单胺递质假说为基础,但对近1/2患者无效,反映了该假说缺乏普适性[17]。因此,不少学者提出抑郁症的发生可能与神经发生抑制相关。神经发生是新的神经元增殖过程,贯穿终生,成年哺乳动物神经发生主要发生在海马体齿状回颗粒下区和脑室下区。海马体作为边缘系统重要组成部分,不仅参与记忆的储存与提取,而且是调节情感的关键结构[18]。由于BrdU属于胸腺嘧啶类似物,能整合到细胞分裂增殖的DNA双链中,因此常用于标记内源性新生神经元。本研究结果显示,Con组小鼠海马齿状回区域存在部分新生神经元,但SD组几乎没有新生神经元。然而,TWIST1表达降低介导Con+LV-shTWIST1组新生神经元增加,且由于可能存在的神经元损伤,SD+LV-shTWIST1组新生神经元增加更加明显。学习、记忆能力降低是突触可塑性降低介导的结果,伴随着树突棘萎缩,密度降低。神经新生能够增强突触可塑性,长时程电位是主要的实验指标[19]。当给予海马体一个高频刺激,其fEPSP会出现持续增强现象[20]。Wnt/β-catenin信号通路是参与神经元增殖、分化,增强海马体突触可塑性的主要信号通路,敲低Wnt3a蛋白表达被发现会造成海马体生理结构缺陷[21]。GSK3β是一种普遍存在的丝氨酸/苏氨酸蛋白激酶,Wnt信号活化后发生磷酸化,促进细胞质中β-catenin蛋白累积并转移入核,调控与神经干细胞增殖、分化。本研究结果显示,TWIST1表达升高与fEPSP斜率降低,Wnt3a与β-catenin蛋白表达降低相关,无论是Con组还是SD组,通过慢病毒特异性敲低TWIST1表达则能够提高海马体fEPSP斜率,增加Wnt3a与β-catenin蛋白表达。
综上所述,本研究评估TWIST1对长期睡眠剥夺诱导抑郁症模型动物的影响。研究结果表明,降低TWIST1表达能够提高Wnt/β-catenin信号通路蛋白表达,促进神经元新生,增强长时程电位,起到改善小鼠抑郁样行为与学习、记忆能力的作用,这为抑郁症的治疗提供了新的理论基础。

