亚精胺下调AGE/RAGE信号通路改善糖尿病大鼠认知功能障碍
蒋淑娟 邢美艳
糖尿病 (diabetes mellitus,DM)作为常见的代谢性疾病会引发一系列并发症,当前全世界有3.66亿人患有DM,已严重威胁人类健康[1]。DM亦可累及大脑,患者脑部出现神经元丢失、轴突变性、突触形成受阻和突触可塑性障碍等,表现为慢性进行性加重的认知功能障碍,又称为“糖尿病性认知功能障碍(diabetes-associated cognitive dysfunction,DACD)”[2]。然而,当前对于治疗DACD尚无有效策略。因此,寻求开发有效的治疗药物对于临床上防治DACD至关重要。亚精胺(spermidine,Spd)是一种广泛分布在生物体内的天然多胺,对细胞稳态、细胞生长、细胞增殖、组织再生等具有关键的支持作用,在人体多种组织中扮演抗衰老的角色[3]。已有研究表明Spd对认知损伤具有一定改善作用[4],但Spd是否拮抗DACD尚未有人探索。在DM中,由高血糖引起的内皮细胞中晚期糖基化终产物 (advanced glycation end products,AGEs) 过度形成被认为是大脑认知能力下降的重要原因[5]。AGE通过晚期糖基化终产物受体 (the receptor of advanced glycation end products,RAGE) 控制血管内皮细胞的功能[6]。本研究以链脲佐菌素 (streptozocin,STZ) 诱导的DM大鼠为模型主要观察Spd对DACD的改善作用以及对海马AGE-RAGE信号通路的影响,旨在为Spd的临床应用提供实验依据。
1 材料与方法
1.1 实验动物 选取40只体重200~250 g的SPF级别的雄性SD大鼠(6~8周龄),购自安徽医科大学实验动物中心,动物合格证号为SCXK(皖)2017-001。大鼠单笼饲养,允许其自由进食与进水,室内空气、通风良好,人工光/暗周期为12/12 h(光照时间7∶00~19∶00),温度20~25℃,相对湿度50%左右,并每周更换垫料2~3次以保证大鼠舒适的环境。所有实验均遵循国家承认的《实验动物管理条例》和《动物伦理委员会管理条例》。
1.2 实验药物与试剂 Spd(批号:S0381)及STZ(批号:S0130,纯度>98%)粉末购自美国 Sigma 公司,血糖仪和血糖试纸购自德国罗氏 (ROCHE) 公司。AGE(批号:ab23722)Elisa试剂盒,RAGE(批号:ab37647) 和β-actin(批号:ab8226)蛋白特异性抗体,以及辣根过氧化物酶 (HRP) 标记二抗(批号:ab6721)均购于英国Abcam公司。BCA 蛋白检测试剂盒(批号:P0012)和SDS-PAGE凝胶制备试剂盒(批号:P0012A)均购于上海碧云天生物科技公司。
1.3 方法
1.3.1 糖尿病模型:大鼠禁食过夜 (12 h) 后,DM模型组用55 mg/kg剂量的STZ腹腔注射,对照组给予相同剂量的柠檬酸钠溶液。注射STZ后,禁食1 h后再喂食。STZ注射3 d后,用血糖仪检测大鼠尾静脉空腹血糖,血糖>16.7 mmol/L为DM大鼠,纳入正式实验。血糖不达标者,等大鼠恢复到正常血糖状态下重新造模。
1.3.2 动物分组及处理:大鼠随机分为4组(n=10):对照组、DM模型组、DM+低剂量Spd (5 mg/kg,腹腔注射)组、DM+高剂量Spd (10 mg/kg,腹腔注射) 组。在STZ处理的大鼠确认DM大鼠后,给予不同的药物处理:Spd组予以不同浓度的Spd,其余组予以等量的蒸馏水。所有大鼠连续处理4周后进行认知行为学试验,随后取海马组织检测相关指标。
1.4 观察指标
1.4.1 血糖与体重测定:STZ注射前当天,注射后第3天及第28天早晨进食前采集大鼠尾静脉血, 用血糖仪检测4组大鼠空腹血糖。在STZ注射当天及注射后第1~4周记录4组大鼠体重。
1.4.2 认知功能:药物干预结束后,所有大鼠经Morris水迷宫试验评估空间学习和记忆能力。实验分2个阶段:①定位航行 (place navigation):水池分为4个象限,将直径20 cm的平台放置于其中一个象限中央,水面下5 cm处。大鼠随机位置放入水中,每次记录找到平台的时间(逃避潜伏期)。每次试验最长120 s;若超过120 s未找到平台(逃避潜伏期记为120 s),则引导动物到平台,让动物在平台上停留20 s。每只动物每天训练4次(每次从不同的象限开始,每天的顺序不同),2次训练间隔15~20 min,连续训练5 d;每天取4次平均值为最终结果。②空间探索 (spatial probe):第6天去掉平台,将大鼠由原先平台象限的对侧放入水中,记录其在120 s内在目标象限(原放置平台的象限)所花的时间和跨越原平台次数。
1.4.3 Western blot检测大鼠海马RAGE蛋白表达:大鼠断头处死后取海马组织匀浆,4℃,12 000×g条件下离心,10 min,后取上清液,使用BCA蛋白定量试剂盒确定样本蛋白浓度。将海马蛋白样品加入制备好的SDS-page胶中,电泳分离蛋白质,用湿转法将蛋白转到聚二氟乙烯 (PDVF)膜上。转膜完成后将PVDF膜放于5%脱脂牛奶内,常温下摇床封闭孵育2~3 h,加入一抗 (1∶1 000) 于4℃冰箱孵育过夜。第2天将膜取出用T-BST清洗 (5 min ×5),加入相对应的二抗 (1∶5 000) 孵育2 h。最后将膜用T-BST漂洗干净后,加入化学发光液在凝胶成像仪 (tanon-5600 imaging system) 中显影。蛋白条带用AlphaImager 2200进行条带灰度值扫描,以β-actin蛋白为内在参照,分析各组蛋白的表达水平。
1.4.4 Elisa检测大鼠海马AGEs含量:大鼠断头处死后取海马组织匀浆,离心后收集上清液,使用BCA蛋白定量试剂盒确定样本蛋白浓度。随后遵照试剂盒说明书要求在96孔板上加入相同量的4组组织上清液及相应的试剂,在摇床上避光孵育30 min。最后用酶标仪在波长450 nm处检测每孔的吸光度,计算出海马中AGEs含量。

2 结果
2.1 亚精胺不影响STZ诱导的糖尿病大鼠血糖和体重水平 注射STZ (55 mg/kg) 后3 d,DM模型组、DM+低剂量Spd组和DM+高剂量Spd组大鼠血糖水平均显著高于对照组。第28天,3组大鼠血糖水平仍显著升高(P<0.05),同时DM模型组、DM+低剂量Spd组和DM+高剂量Spd组大鼠血糖水平无显著差异(P>0.05)。注射STZ后每周测量1次体重:与对照组比较,DM模型组、DM+低剂量Spd组和DM+高剂量Spd组大鼠体重明显降低(P<0.05),同时DM模型组、DM+低剂量Spd组和DM+高剂量Spd组大鼠体重无差异(P>0.05)。表明注射STZ导致大鼠DM状态,但Spd不影响DM大鼠血糖水平和体重。见表1、2。
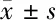
表1 4组大鼠空腹血糖水平比较 n=10,mmol/L,
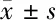
表2 4组大鼠体重水平比较 n=10,
2.2 亚精胺改善STZ诱导的糖尿病大鼠在水迷宫中的空间学习记忆 Morris水迷宫测试结果显示:在定位导航期间,与对照组比较,DM模型组大鼠在试验第2~5天的逃避潜伏期显著延长(P<0.05),而DM+低剂量Spd组和DM+高剂量Spd组大鼠逃避潜伏期较DM模型组明显缩短 (P<0.05),表明Spd给药能明显缩短DM大鼠的逃避潜伏期,改善DM大鼠的空间学习能力。在空间探索期:DM模型组大鼠在目标象限停留时间百分比和跨越平台的次数明显少于对照组,差异有统计学意义(P<0.05),而DM模型组、DM+低剂量Spd组和DM+高剂量Spd组的目标象限停留时间百分比和跨越平台的次数较DM模型组明显增加(P<0.05),表明Spd明显提高DM大鼠的空间记忆能力。见表3、4。
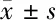
表3 水迷宫试验中4组大鼠空间学习能力比较 s,
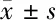
表4 水迷宫试验中4组大鼠空间记忆能力比较
2.3 亚精胺下调STZ诱导的糖尿病大鼠海马AGE/RAGE信号水平 Western blotting 和Elisa结果显示:与对照组比较,DM模型组大鼠海马组织中AGEs含量明显增加,RAGE蛋白表达水平显著上调(P<0.05);但DM+低剂量Spd组和DM+高剂量Spd组大鼠海马组织中AGEs含量显著减少,RAGE蛋白表达明显下调(P<0.05),表明Spd明显抑制DM大鼠海马AGE/RAGE信号水平。见表5。
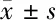
表5 4组大鼠海马组织中AGEs含量和RAGE蛋白表达比较
3 讨论
DM及其并发症和治疗可导致一过性或永久性的认知异常,这些异常是由急性和慢性血糖稳态紊乱引起的[2]。DM的患病率在全球范围内急剧增加,2030预计将有5.52亿患者[1]。随着糖尿病的日益流行和人口老龄化,DACD预计将上升,并成为未来健康影响的一个挑战。最近的研究表明,作为一种天然的促进自噬的多胺,饮食中的Spd具有保护健康和延长寿命的作用。Gupta等[7,8]发现膳食补充Spd可在果蝇中抑制年龄诱发的记忆损伤和保持突触灵活性;后续研究中Spd也被证明可逆转脂多糖诱导的小鼠记忆缺陷[9]。此外,腹腔或脑内注射Spd可显著增强啮齿动物在不同任务中的认知能力[10]。近期研究发现Spd影响老年小鼠在家庭环境任务中的行为,改善空间学习[11];并且在临床试验中Spd显著提升老年人群及阿尔兹海默症患者的认知表现[12,13]。
Morris水迷宫是主要用于测试实验动物对空间位置感和方向感(空间定位) 的学习记忆能力,被广泛应用于学习记忆、老年痴呆、海马/外海马研究等领域[14]。本研究中,我们通过一次性STZ腹腔注射构建DM认知障碍模型。水迷宫结果显示:与正常对照组比较,大鼠DM制模成功4周后出现了学习记忆障碍,表现为逃避潜伏期明显延长,在目标象限停留时间和跨越平台的次数明显降低;Spd干预后DM大鼠的逃避潜伏期明显缩短,目标象限停留时间和跨越平台的次数显著增加。这些结果表明Spd改善DM大鼠的空间学习记忆障碍,验证了Spd在预防DM模型记忆障碍方面的药理活性。同时,我们结论与上述前人研究基本一致,进一步拓展了Spd在不同疾病模型中的学习记忆改善作用。
已有研究发现,Aβ-AGE通过RAGE通路加重了大鼠的认知障碍[15]。同时,DM与几种脑血管内皮细胞功能障碍高度相关,如脑血管中脂质[16]和AGEs[17,18]过度积聚。随后,这些变化导致血流减少,神经血管解偶联,以及低氧应激引起的神经元损伤[19],最终导致脑梗塞和血管性痴呆的发病[20]。大量研究表明,AGE-RAGE通路的激活与DM患者的微血管和大血管功能以及认知功能障碍有关[21]。因此,我们推测Spd对DACD的拮抗作用可能涉及对AGE-RAGE通路的调控。结果显示:与正常对照组比较,DM大鼠海马组织中AGEs含量增加,RAGE蛋白表达上调;Spd干预后,DM大鼠海马组织AGEs含量明显减少,RAGE蛋白表达显著下调,表明Spd抑制DM大鼠海马AGE-RAGE信号通路。因此我们认为下调海马AGE-RAGE信号通路参与了Spd对DACD的改善作用,这也提示海马AGE-RAGE信号可能作为防治DACD的有效靶点。当前,炎性和氧化还原敏感的AGE-RAGE通路可作为阿尔茨海默病的治疗靶点[22],这也佐证了我们的观点。
综上所述,Spd对STZ 诱导的DM大鼠认知功能障碍具有改善作用,其机制与抑制海马AGE-RAGE信号通路有关。

