2型糖尿病患者腰椎骨髓水含量磁共振T2 mapping定量分析
崔凤珍 王世雷 曹江欣 张哲 赵月芹
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以糖代谢受损为特征的慢性代谢障碍性疾病,严重影响人类生活质量和生命健康,近年来发病率呈增加趋势,也备受研究者重视。T2DM作为一种代谢性紊乱的疾病,可以引起骨骼内环境的改变,从而影响骨骼的健康状态。T2DM与骨质疏松症之间也可能存在着一定的联系[1]。目前国内外对骨质疏松症的研究很多,大多集中在对骨密度(bone mineral density,BMD)的定量分析方面,而骨髓脂肪含量(bone marrow fat,BMF)的增多也会引起骨折的发病率增高,据报道,T2DM患者BMF较非糖尿病患者高[2]。T2DM患者腰椎骨髓脂肪成分增多,会引起相应的骨髓水含量减少[3]。随着年龄的增长,红骨髓向黄骨髓转换,同样会导致骨髓脂肪成分的增加和水成分的减少。而目前对腰椎骨髓水含量的研究甚少,Ishijima等[4]研究表明腰椎骨髓水含量与年龄相关,也有性别差异,女性(25~54岁)腰椎骨髓水含量较男性(25~34岁)高。进一步研究糖尿病患者腰椎骨髓水含量及其与年龄、性别的关系,可能会降低糖尿病患者骨折发病率。双能X射线吸收仪(dual-energy X-ray absorptiometry,DXA)和专用定量CT(quantitative CT,QCT)可以通过测定骨密度来评估骨质疏松症,进一步反映骨髓水含量的变化,但是该检查有辐射。MRI可以采用T2弛豫时间来评估骨髓的微结构和骨质疏松,组织T2值的改变也是反映组织微结构改变的敏感指标。目前随着MR功能成像技术的发展,可以通过无创的方式来测量骨髓水含量。MRI-T2 mapping成像可通过非侵入性的方法测量水分子T2弛豫时间,最早主要应用在对膝关节软骨的研究[5],现在国内外主要应用T2 mapping定量的方法进行椎间盘退变的相关性研究,分析椎间盘髓核水成分含量[6]。本研究通过T2 mapping定量的方法分析T2DM患者腰椎骨髓水含量及其相关影响因素。
1 资料与方法
1.1 一般资料 选择2021年7~11月在石家庄市第二医院行腰椎MRI检查经临床确诊的T2DM患者50例,以及非糖尿病患者55例作为对照,扫描过程中采用T2 mapping脉冲序列进行扫描。记录患者的年龄、性别、身高、体重。最后10例患者被排除本研究,包括血管瘤5例,贫血1例,终板炎1例,转移瘤1例,图像质量不合格2例。最终95例患者纳入本研究,其中男45例(年龄27~81岁,中位年龄57岁),女50例(年龄25~81岁,中位年龄63.5岁);年龄25~81岁,中位年龄60岁。按年龄将女性和男性分为2组,即≤50岁组(男15例,女12例)和>50岁组(男30例,女38例)。本研究经医院伦理委员会讨论通过。患者在检查前均签署了磁共振扫描知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准:①无腰椎外伤史、手术史,放疗病史;②无腰椎肿瘤、结核、感染病史;③无代谢和自动免疫性疾病;④无血液系统疾病及贫血病史;⑤无服用影响骨代谢的药物(如糖皮质激素、避孕药等)史;⑥无磁共振检查禁忌证。
1.2.2 排除标准:①不符合上述入选标准任意一条者;②图像质量不合格。
1.3 影像检查方法 采用美国GE1.5超导型MR机。信号采集选用体线圈,扫描序列包括矢状位T2WI(TR 2005 ms,TE 120 ms,FOV 32 cm×32 cm,层厚4.0 mm,层间距1.0 mm,矩阵320×256,采集次数4);矢状位T1WI(TR 556 ms,TE 12.9 ms, FOV 32 cm×32 cm,层厚4.0 mm,层间距1.0 mm,矩阵320×192,采集次数2);矢状位STIR(TR 3085 ms,TE 42 ms,FOV 32 cm×32cm,层厚4.0 mm,层间距1.0 mm,矩阵288×192,采集次数4);轴位T2WI(TR 2220 ms,TE 120 ms,FOV 22 cm×22cm,层厚4.0 mm,层间距1.0 mm,矩阵288×224,采集次数4)。矢状位T2 mapping:采用多回波SE序列,共采集8回波(TR 2000 ms,TE 12.3、24.6、36.8、49.1、61.4、73.7、86,98.2 ms,FOV 32 cm×20 cm,层厚4.0 mm,层间距1.0 mm,矩阵256×256,采集次数1,扫描时间为8 min 31 s)。
1.4 数据测量
1.4.1 将扫描的T2 mapping原始数据传到GE(ADW4.6)后处理工作站,利用自带的Function tool软件生成T2 mapping原始图及伪彩图测量。数据测量由1名有10年放射科工作经验不了解患者病情的放射科医师采用盲法进行,具体测量方法:打开Functool软件,选择对应选项 “T2 map”。①可信区间(confidence)及阈值选择(Threshold)选择:选用阈值10,可信区间双侧95%;②T2值范围选择:在彩色标尺中,T2值范围统一设置为0~200 ms。
1.4.2 感兴趣区(regions of interest,ROI)的标准化:测量包括L1~L5共5个椎体,测量均选取正中矢状面原始图像,测量面积范围为150~180 mm2。测量者在T2 mapping原始图像上手动绘制椭圆形ROI,ROI自动复制到T2 mapping彩图。ROI尽可能包括整个椎体骨部分,避开骨皮质、终板及椎间盘及血管,记录患者L1~L5椎体伪彩图上生成的T2 mapping值,计算L1~L5椎体骨髓平均T2 mapping值。见图1、2。

图1 矢状位T2 map 图2 T2 colored map
1.5 体重指数(body mass index,BMI)状况:BMI=体重(kg)÷身高(m)的平方。依据中国参考标准(因为专家认为WHO的标准不是非常适合中国人的情况),分为过轻:<18.5 kg/m2;正常:18.5~23.9 kg/m2;偏胖24~27.9 kg/m2;肥胖≥28 kg/m2;重度肥胖≥30 kg/m2;极重度肥胖≥40 kg/m2。本研究因为偏胖、肥胖、重度肥胖和极重度肥胖各组人数较少,都归为超重组,过轻组人数为0,所以将患者分为2组,正常组:18.5 ~23.9 kg/m2;超重组≥24 kg/m2。

2 结果
2.1 T2DM组与非糖尿病组L1~L5椎体骨髓平均T2 mapping值比较 T2DM组低于非糖尿病组,差异有统计学意义(P<0.05)。见表1。
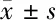
表1 T2DM组与非糖尿病组L1~L5椎体骨髓平均T2 mapping值比较 ms,
2.2 L1~L5各椎体T2DM组与非糖尿病组骨髓T2 mapping值比较 L1、L2、L3、L5各椎体T2DM组与非糖尿病组患者的骨髓T2 mapping值差异有统计学意义(P<0.05),L4椎体T2DM组与非糖尿病组患者的骨髓T2 mapping值差异无统计学意义(P>0.05)。见表2。
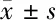
表2 L1~L5各椎体T2DM组与非糖尿病组骨髓T2 mapping值比较 ms,
2.3 T2DM组腰椎骨髓平均T2 mapping值不同性别和全部患者不同BMI比较 T2DM组女性和男性、全部患者BMI正常组和超重组腰椎骨髓平均T2 mapping值差异无统计学意义(P>0.05)。见表3。
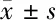
表3 T2DM组腰椎骨髓平均T2 mapping值不同性别和全部患者不同BMI比较 ms,
2.4 L1~L5椎体骨髓平均T2 mapping值与年龄的相关性 T2DM组、非糖尿病组及全部患者L1~L5椎体骨髓平均T2 mapping值与年龄均呈负相关(r=-0.413,P=0.000;r=-0.354,P=0.015。)。见图3、4。

图3 T2DM组L1~L5椎体骨髓平均T2 mapping值与年龄相关的散点图

图4 非糖尿病组L1~L5椎体骨髓平均T2 mapping值与年龄相关的散点图
2.5 不同性别患者腰椎骨髓平均T2 mapping值年龄≤50岁组与>50岁组比较 女性患者年龄≤50岁组腰椎骨髓平均T2 mapping值(146.44±13.04)ms高于>50岁组的(133.53±12.06)ms(t=3.172,P=0.003);男性患者年龄≤50岁组腰椎骨髓平均T2 mapping值(140.16±12.14)ms与>50岁组的(138.59±12.73)ms比较,差异无统计学意义(t=0.396,P=0.694)。
3 讨论
T2DM又称非胰岛素依赖型糖尿病或成人发病型糖尿病,是一种慢性代谢疾病,多在35~40岁之后发病,占糖尿病患者的90%以上。其病因主要是胰岛素分泌不足和胰岛素抵抗,可引起糖、脂肪、蛋白质代谢紊乱[7]。T2DM可通过不同环节影响骨代谢过程,从而影响骨髓成分,引起骨髓中脂肪含量增加,水成分减少,可能会导致骨质疏松,甚至引起骨折[8]。T2 mapping技术是一种多回波脉冲序列,可定量检测骨髓中水分子的微小变化,T2mapping值可反映骨髓中的水含量。姚晓龙等[9]采用T2 mapping序列测量了骶髂关节骨髓T2值的变化,发现强直脊柱炎患者骶髂关节的早期改变。本研究旨在采用T2 mapping序列定量分析T2DM患者腰椎骨髓的水含量及其相关的影响因素。
本研究发现T2DM患者腰椎骨髓平均T2 mapping值较非糖尿病患者低。L1、L2、L3、L5各椎体T2DM患者的T2mapping值也比非糖尿病患者低。T2DM患者血糖水平升高,破坏体内钙、磷代谢的平衡状态。由于渗透性利尿机制,糖尿病患者要排出大量葡萄糖,同时也造成体内钙、磷、镁等矿物元素被大量排出体外,从而导致低钙、低镁的状态。这种状态会刺激甲状旁腺素分泌增多,使人体的溶骨作用增强,于是骨就会被“溶蚀”出现孔洞,导致骨质疏松。骨骼中,成骨细胞引起骨骼的再生,即“骨构建”。胰岛素通过成骨细胞表面的胰岛素受体,对成骨细胞的“骨构建”功能进行调节。由于糖尿病患者的胰岛素绝对或相对缺乏,造成成骨细胞的“骨构建”作用减弱,所以人体容易出现骨质疏松[10]。骨质疏松会引起骨髓脂肪成分的增多以及水含量的减少[11]。这可能是造成糖尿病患者腰椎骨髓水含量较非糖尿病患者低的原因。对于腰椎骨髓成分的分析大多集中在对骨髓脂肪含量的定量测量方面,而对骨髓水含量的研究相对较少。
本研究发现T2DM组、非糖尿病组腰椎骨髓T2 mapping值与年龄呈负相关,与先前研究结果[12,13]相一致。随着年龄的增长,腰椎椎体的红骨髓逐渐向黄骨髓转换,至25岁时,基本完成全身的骨髓转换,但仍有骨髓存在于脊柱等中轴骨和四肢骨的近端,因此在成人腰椎椎体骨髓成分中,也存在着红骨髓向黄骨髓的生理性转换,只不过较成人之前,这种转换相对较慢。红黄黄骨髓的转换会引起骨髓成分中水、脂肪、蛋白质比例的变化。正常红骨髓含有40%水分、40%脂肪和20%蛋白质;黄骨髓含有15%水分、80%脂肪和5%蛋白质[14]。随着红黄骨髓的转换,骨髓中的含水量逐渐减少,脂肪成分逐渐增加,导致骨髓组织中的T2值逐渐减低。Ruschke等[12]对260例患者进行了MRS成像,所有数据均采用水-脂肪模型进行处理。研究发现,女性和男性L4或L5椎体骨髓水含量T2值均与年龄呈负相关(女性:r= 0.429,P<0.001;男性:r= 0.210,P<0.001。)。Cui等[13]研究也发现女性腰椎骨髓水含量T2 mapping值与年龄呈负相关(r=0.351,P= 0.003)。
本研究发现T2DM患者女性和男性、全部患者BMI正常组和超重组腰椎骨髓水含量T2 mapping值无差异。Ishijima等[4]对211例5~84岁的健康志愿者进行了椎体磁共振扫描,结果发现,25~54岁女性患者的腰椎骨髓水含量超过同年龄组男性的腰椎骨髓水含量,而55岁之后男女腰椎骨髓水含量没有显著差异,原因考虑与女性体内的雌激素水平有关系。本研究中比较的人群为2型糖尿病患者,年龄段为27~81岁,且50岁之前的女性2型糖尿病患者较少(10例),因此可能导致T2DM患者女性和男性腰椎骨髓水含量T2 mapping值无明显差异,以后需要更大样本的研究证实。目前尚未发现腰椎骨髓水含量与BMI的相关性研究,但是BMI增高对人体骨骼产生的是积极影响还是消极影响仍存在争议,还需要进一步研究。
女性患者年龄≤50岁组腰椎骨髓水含量T2 mapping值高于>50岁组。而男性患者年龄≤50岁组腰椎骨髓水含量T2 mapping值与>50岁组差别无统计学意义。推测可能与女性的雌激素有关。50岁正值中国女性绝经期年龄,50岁之前女性雌激素水平较男性高,雌激素刺激骨髓造血能力,引起骨髓水含量较高。女性绝经以后,卵巢功能退化,雌激素分泌逐渐减低,分化为成骨细胞能力减低,反而促进间充质干细胞分化为脂肪细胞,使腰椎骨髓的脂肪含量增加,水含量降低[15,16]。并且Cui等[13]研究也发现女性腰椎骨髓水含量T2 mapping值与雌激素成正相关(r=0.325,P=0.006)。而男性雌激素水平随年龄增长仅有轻度降低[17]。Ishijima等[4]研究发现5~44岁女性腰椎骨髓水含量变化幅度相对较小(5~14岁,78.9%;15~24岁,75%;25~34岁,69.3%;35~44岁,70.9%),而45~84岁腰椎骨髓水含量明显降低(45~54岁,61.1%;55~64岁,49.7%;65~74岁,46%;75~84岁,39.7%),而男性50岁前后腰椎骨髓水含量变化幅度相对较小(35~44岁,51.1%;45~54岁,52.9%;55~64岁,48.8%);与本研究结果一致。
综上所述,T2DM患者腰椎骨髓平均T2 mapping值较非糖尿病患者低。腰椎骨髓平均T2 mapping值与年龄呈负相关,与BMI无明显关系。女性50岁之前腰椎骨髓平均T2 mapping值高于50岁之后,而男性腰椎骨髓平均T2 mapping值50岁之前与50岁之后无明显差异,说明女性激素水平可能是影响腰椎骨髓水含量的一个重要因素。了解T2DM患者腰椎骨髓水含量及其相关影响因素,做到早期发现、早期干预、早期治疗,有助于临床医生降低T2DM患者腰椎骨折风险。此外在判断腰椎骨质疏松及骨髓水含量相关的病变中,要考虑到糖尿病、年龄、性别等因素的影响。同时本研究也进一步证实了T2 mapping技术用于评估腰椎骨髓水含量的可行性,是评价腰椎骨髓水含量无创、简单、便捷的检查方法。

