脑卒中病人Rasip1表达及其临床价值
高洪波,冯 硕,司丽芳,王晨娜,陈春雷,王玉波
急性缺血性脑卒中(acute ischemic stroke,AIS)是大脑特定部位血液循环丧失引起的多发脑血管疾病,约占脑卒中的80%[1]。AIS主要是由大脑动脉突然闭塞或血流短时间内流速过慢引起的脑动脉及脑供血动脉闭塞或狭窄,脑供血不足导致的脑组织坏死,神经、运动功能障碍是其主要临床表现[2-4]。2016年全球疾病负担研究数据显示,AIS在我国的患病率为1 762.77/10万,且随着人口老龄化进程的加快呈逐年上升趋势,给社会及家庭带来沉重的心理和经济负担[4-7]。实现早期诊断是AIS降低病死率、取得较好预后的关键。临床上多通过影像学手段观察脑结构及脑功能并进一步结合临床经验对AIS进行确诊。磁共振成像(MRI)技术在AIS早期诊断中可发挥重要作用,也是常用的检测手段。虽然多种影像学技术在AIS诊断中各具优势,但整体早期诊断准确率仍有待提升[8-10]。近年来,随着检验技术的发展,多种生物标记物被应用于AIS的诊治中以进一步提高其诊断准确率。Ras相互作用蛋白-1(Ras interacting protein-1,Rasip1)对内皮细胞具有黏附作用,是具有明显增强作用的仅在肺组织和血管中表达的组织特异性蛋白质,是Ras蛋白的作用靶点,在胚胎发育中可发挥关键作用[11-12]。研究表明,Rasip1可通过参与调控血管内皮细胞的迁移及极性,促进血管形成和发育,影响血管壁的完整性[13]。本研究分析Rasip1在AIS病人中的表达变化及与影像学指标的相关性,进一步探索Rasip1在AIS临床应用中的价值。
1 资料与方法
1.1 一般资料 选取2019年1月—2020年1月首都医科大学附属北京朝阳医院神经内科收治的AIS病人97例作为观察组,其中,男62例,女35例;年龄(56.32±4.01)岁;大动脉粥样硬化性脑卒中(LAA)30例,心源性脑卒中(CE)44例,小动脉栓塞(SAA)14例,不明因素引起的脑卒中(SUE)9例。根据脑卒中MRI检出情况分为检出组(85例)和未检出组(12例)。选取同期无既往心脑血管疾病史的100名健康体检者为对照组,其中,男57名,女43名;年龄(54.80±13.65)岁。本研究经医院伦理委员会批准。
1.2 纳入与排除标准 纳入标准:①符合AIS的临床诊断标准[14],且具有相关临床症状;②经CT、MRI检测确诊,且弥散加权成像(DWI)序列可见弥散受限的梗死灶;③首次确诊病例;④病人签署知情同意。排除标准:①合并其他脑器质性病变;②有相关影像检查禁忌证;③临床资料不完整;④合并凝血、肝、肾功能异常。
1.3 方法
1.3.1 实验室指标检测 采集所有受试者空腹8 h以上2 mL静脉血,以3 000 r/min离心10 min后取上清液。酶联免疫吸附法检测血清Rasip1含量,试剂盒购于西门子公司。
1.3.2 MRI检查 病人进行MRI平扫以及DWI后通过西门子MRI(prisma 3T)进行灌注加权成像,采用64通道相阵控线圈对病人头部进行横轴扫描,场强:3.0 特斯拉(Tesla),磁体孔径:60 cm,磁体长度:213 cm,射频通道数≥128,以1.7 mm层距、4.5 mm层厚、240 mm显示野(FOV)进行轴位扫描。具体操作程序为进行自旋回波T1加权,以重复时间(TR)/回波时间(TE)500 ms/7.8 ms为参数进行设置,采集2次;以90°为翻转角,自旋回波后进行T2加权,TR/TE 4 000 ms/100 ms为具体参数,采集4次;以150°为flip角度,后液体衰减反转恢复序列(FLAIR),TR/TE 9 000 ms/109 ms,TI 2 500 ms,256×256为具体参数,扫描次数为1。血管斑块增强成像(头、颈部血管)扫描序列为①DWI,1.1 mm×1.1 mm×5.5 mm,TR/TE 4 000 ms/86 ms进行参数设置,病人采用1次扫描;②三维时间飞跃技术(TOF-3DMRA),0.3 mm×0.3 mm×0.8 mm,TR/TE 21 ms/3.4 ms为具体参数,病人进行4次采集;③T2-磁共振成像FLAIR,0.9 mm×0.9 mm×5.5 mm,FOV 220 mm,TR/TE 9 000 ms/133 ms为参数设置,病人进行2次采集;④反转序列(IR-SPACE)平扫+增强扫描,0.5 mm×0.5 mm×0.6 mm,FOV 210 mm,TR/TE 900 ms/15 ms为参数进行设置,病人进行1次采集,扫描范围包括颈总动脉至胼胝体周围动脉;首先对病人进行预扫描,记录病人中心频率同时记录平均值。采集病人脑DWI所对应的T2加权像(T2WI)脂肪抑制序列图像,后解剖对比所得数据,以进一步实现病灶在病人的解剖定位。
1.3.3 CT检查 GE Revolution Frontier64排螺旋CT,窗宽为80 HU,窗位为40 HU,矩阵为512×512;扫描时间为5 s,管电流为150 mA,管电压为100 kV。层距、层厚为0.6 mm。头、颈部血管CT增强的参数为:窗宽为100~400 HU,窗位为35~40 HU,矩阵为512×512,扫描时间3~50 s,管电压为80~120 kV,管电流采用自动毫安(7~600 mA),层距、层厚均为0.625 mm。
1.3.4 图像分析 由本科室两名经验丰富的医师通过双盲法进行分析。同时记录CT、MRI不同时间的梗死检出率、脑卒中部位异常、脑卒中不同检查指标等信息。以大脑中线为轴测量患侧表观弥散系数(apparent diffusion coefficient,ADC)、患侧和对侧镜像区脑血流量(cerebral blood flow,CBF)值、脑室旁白质信号(periventricular hyperintensities,PVH)、深部脑白质高信号(deep white matter hyperintensities,DWMH)、内侧颞叶萎缩(medial temporal lobe atrophy,MTLA)。MTLA采用Schelten量表评估[15],该量表评分为5级,从没有萎缩至严重萎缩,依次计0~4分,左右侧分别记录,MTLA程度为双侧得分之和。DWMH及PVH根据Fazekas量表进行评估[16],该量表为4级评分量表,从无到严重,依次计0~3分,左右侧分别记录,以严重侧代表该部位的损害程度。

2 结 果
2.1 两组一般资料及血清Rasip1水平比较 观察组血清总胆固醇、三酰甘油、血尿酸、低密度脂蛋白水平较对照组高,高密度脂蛋白、Rasip1水平较对照组低,差异均有统计学意义(P<0.05)。详见表1。

表1 两组一般资料及血清Rasip1水平比较
2.2 不同类型脑卒中血清Rasip1水平比较 LAA、CE、SAA、SUE类型脑卒中血清Rasip1水平比较,差异无统计学意义(P>0.05)。详见表2。
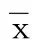
表2 不同类型脑卒中血清Rasip1水平比较(±s) 单位:μmol/L
2.3 检出组与未检出组临床资料比较 检出组脑卒中病灶体积、脑卒中病灶数量、脑皮质病灶数量、血管狭窄、斑块负荷、PVH评分、DWMH评分、MTLA评分明显高于未检出组,ADC、CBF、Rasip1明显低于未检出组(P<0.05)。详见表3。

表3 检出组与未检出组临床资料比较
2.4 观察组血清Rasip1水平与影像学指标的相关性分析 观察组血清Rasip1与ADC值、CBF值呈正相关(P<0.05);与脑卒中病灶数量、脑卒中病灶体积、脑皮质病灶数量、血管狭窄、斑块负荷、PVH评分、DWMH评分、MTLA评分呈负相关(P<0.05)。详见表4。

表4 观察组血清Rasip1水平与影像学指标的相关性分析
2.5 AIS的影响因素分析 以观察组MRI是否检出AIS为因变量,以单因素分析差异有统计学意义的因子为自变量进行多因素Logistic回归分析,结果显示,脑卒中病灶体积、脑卒中病灶数量、脑皮质病灶数量、血清Rasip1水平是AIS的影响因素(P<0.05)。详见表5。

表5 AIS影响因素的多因素Logistic回归分析
2.6 Rasip1预测AIS的ROC曲线 AIS病人中Rasip1检测诊断效能显示,曲线下面积(AUC)为0.805,灵敏度为82.0%,特异度为85.2%,95%CI为(0.840,0.911)。详见图1。

图1 Rasip1预测AIS的ROC曲线
2.7 CT、MRI联合Rasip1诊断效能比较 AIS诊断效能各检测方法间比较差异有统计学意义(P<0.05),其中,诊断准确度最高的为CT、MRI、Rasip1三者联合检测,其次为MRI联合Rasip1检测、CT联合Rasip1检测。详见表6。
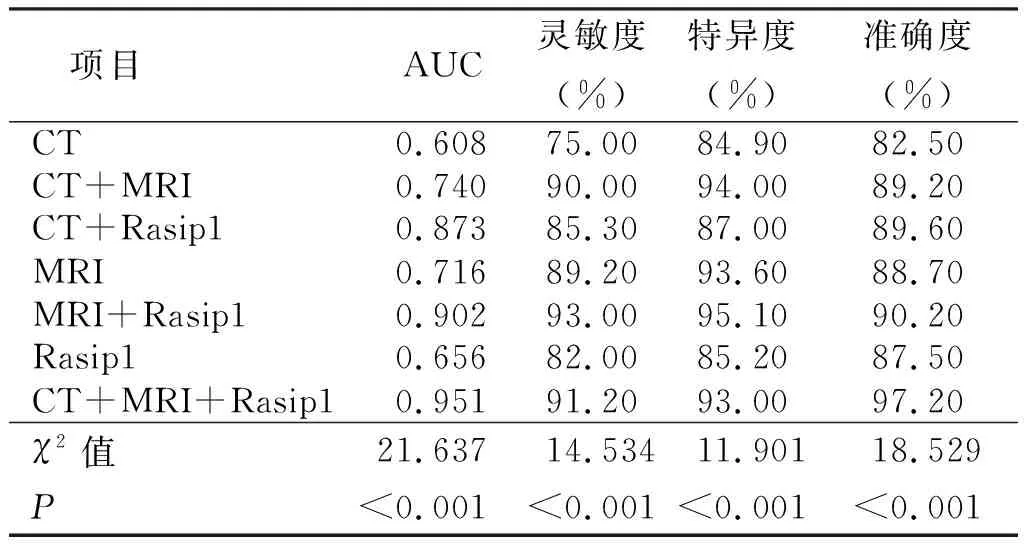
表6 检测方法诊断效能比较 (%)
3 讨 论
近年来,随着人口老龄化的增长,脑卒中发病率逐年上升,其中以AIS为主[17]。目前,AIS为我国居民死亡的首要原因,具有进展快且发病急骤等特点,且致死率、致残率以及复发率均较高[18]。因此,实现AIS的早诊断可有效缩短急救时间,进一步提高生存率,若诊断、救治不及时,较易引发各类神经系统疾病、偏瘫和记忆受损等,严重者会出现痴呆,对家庭和社会造成严重的经济负担[19]。临床上常采用CT和MRI检查进行诊断、MRI是一种磁场内原子核通过共振产生信号后重建成像的技术,在小型缺血性病灶和超急性脑卒中检出能力优于颅脑CT[20]。虽然MRI能够提供脑组织病变状况,也可用于了解脑血管,但其准确度和特异度还有待进一步提高,且等待时间长,病人易出现不良反应,因此结合灵敏度较高的血清标志物进行早期诊断和预后监测,对脑卒中的预防和降低不良预后具有重要意义。Rasip1是一个包含RA、DIL结构域、聚脯氨酸序列(PPP)的Ras结合蛋白,具有活化Ras蛋白结合的功能,可通过Racl、Cdc42信号通路实现对血管病变发生发展的调控[21]。AIS病人血液流动功能较差,而心脑血管血液流动功能依赖于内皮细胞(ECs)合并成线性聚集后组织形成中央腔,然后形成连续、稳定的血管,而Rasip1与早期胚胎连续血管腔的形成密切相关[22]。研究发现,Rasip1缺失表现为适当细胞极性和细胞形状的丧失,EC-EC连接定位中断,以及EC与细胞外基质的黏附缺陷[23]。以上可能是AIS病人Rasip1血清含量偏低的主要原因,这与本研究发现不同类型脑卒中病人血清Rasip1表达无明显差异,但较健康对照人群显著偏低的结果一致。Koo等[13]通过体外实验发现,Rasip1缺失可阻断血管形成,可能与Rasip1下游GTPase通路有关,Rasip1可有效增加Cdc42活性,进而影响血管管腔的扩张[24]。本研究结果显示,检出组脑卒中病灶体积、脑卒中病灶数量、脑皮质病灶数量、血管狭窄、斑块负荷、PVH评分、DWMH评分、MTLA评分均高于未检出组,Rasip1水平低于未检出组。因此,综合以上分析推测Rasip1可能与脑卒中的发生有关。
DWI可在病理生理状态下反映活体组织空间构成以及各成分之间分子的交换关系,在无创条件下完成弥散系数显示,AIS病人30 min内可提示有显著变化,可准确定位病变范围[25-26],ADC值对AIS具有较高的评估价值,但无法准确判断病灶情况。而灌注加权成像可有效反映脑梗死区的血流动力学变化。本研究结果显示,观察组血清Rasip1水平与ADC值、CBF值呈正相关,与脑卒中病灶数量、脑卒中病灶体积、脑皮质病灶数量、血管狭窄、斑块负荷、PVH评分、DWMH评分、MTLA评分呈负相关,且脑卒中病人Rasip1和病灶体积、脑卒中病灶数量、脑皮质病灶数量都是AIS的影响因素,提示Rasip1与AIS影像学指标密切相关,其对于AIS诊断具有较高的指导意义,其有望成为AIS的重要生物学标志物。
AIS的临床诊断主要采用CT、MRI诊断,其中CT诊断影像学表现主要为低密度的梗死灶,基于脑卒中病灶的影像学表现一般在梗死出现之后,与其发病引起的血管源性水肿、细胞内水肿相比,缺乏较明显的特异性,因此,CT诊断具有一定局限性[27]。MRI检测可从不同角度对病人进行全面观察,在一定程度上提高对病人早期诊断的准确率;且MRI对病人水分子弥散运动MRI较敏感,可实现DWI,而脑卒中病人卒中部位早期出现细胞毒性水肿、细胞容积增大,使扩散受限,因此MRI检测准确度高于CT[28]。杜续红[29]对比不同影像学方法对脑梗死的诊断准确率,结果显示,MRI诊断准确率显著高于CT诊断,MRI可对病变形态、大小、部位实现更清晰、有效的检测,与本研究结果类似。本研究通过对脑卒中诊断效能的比较发现,MRI显著优于CT,MRI或CT联合Rasip1检测可有效提高检测效能;且ROC曲线分析显示,Rasip1预测AIS具有较高的灵敏度和特异度,提示Rasip1联合影像学分析对提高脑卒中诊断的准确性及对脑卒中相关血管疾病早期筛查可能具有重要的临床指导价值。
综上所述,Rasip1在AIS病人血清中的含量明显低于健康人群,同时其与脑卒中病灶数量、脑卒中病灶体积以及脑皮质层病灶呈负相关。脑卒中病灶数量、脑卒中病灶体积、脑皮质病灶数量、血清Rasip1是MRI检出ASI的影响因素。影像学检查联合血清标志物Rasip1检测可有效提升AIS的诊断准确率,其对AIS的早期诊断可能具有重要的临床指导价值。

