基于TLR4/NF-κB信号通路探讨丹参酮ⅡA对病毒性心肌炎模型小鼠的心肌保护作用
陶斯阳
病毒性心肌炎(viral myocarditis,VMC)是由柯萨奇病毒、埃可病毒等多种病毒感染诱发的,以局限性或弥漫性炎症改变为主要病理表现的感染性心肌病,为常见的心脏疾病之一[1]。病毒性心肌炎好发于40岁以下的青壮年人群,资料显示,其在世界范围内的发病率为0.12%~12.00%,我国发病率略高,为5%~15%,并且呈逐年上升趋势[2]。该病起病隐匿,病情复杂,大部分可痊愈,但有研究显示,若治疗不当,10%~20%的病人可发展为扩张型心肌病[3],而8%~12%的病人会发生心源性猝死[4],严重威胁病人的生命健康。目前,病毒性心肌炎尚无特异性疗法,西医临床治疗以自由基清除剂为主,抗病毒药、免疫抑制剂等及其他对症疗法为辅,疗效并不理想。因此,寻找更为安全有效的药物成为研究的热点,而中医药以其独特的优势日益受到关注。丹参酮ⅡA为中药丹参活性成分之一,其注射剂治疗病毒性心肌炎有显著的临床疗效,且安全性较高[5]。本研究主要通过观察丹参酮ⅡA对Toll样受体4(TLR4)/核转录因子κB(NF-κB)信号通路的影响,探讨其对病毒性心肌炎小鼠的保护作用。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级4~6周龄雄性健康BALB/C小鼠75只,由第三军医大学第三附属医院野战外科研究所提供,动物生产许可证号:SCXK(渝)2017-0005,体质量16~20(18.25±1.13)g。所有小鼠饲养于动物实验室,保证环境恒温21~23 ℃,恒湿50%~60%,有良好的通风和采光,自然光线,自由饮用灭菌纯水,进食普通饲料,适应性饲养5 d。
1.2 实验药品与试剂 柯萨奇病毒B3(CVB3)Nancy病毒、人宫颈癌细胞(Hela细胞)购自美国ATCC公司。丹参酮ⅡA,CAS号:568-72-9,纯度:高效液相色谱(HPLC)≥98%,规格:每瓶20 mg,购自南京道斯夫生物科技有限公司,采用0.9% NaCl配成浓度2.5 mg/mL、5.0 mg/mL的丹参酮ⅡA溶液,现用现配;利巴韦林颗粒,规格:每袋0.1 g,国药准字H10970280,生产批号:20190314,沈阳药科大学制药有限公司生产,采用0.9% NaCl溶解配成浓度为6.7 mg/mL的利巴韦林溶液,现用现配。磷酸盐缓冲液(PBS)、含吐温的Tris缓冲盐溶液(TBST)购自北京凯瑞基生物科技有限公司;苏木精-伊红(HE)染色试剂盒购自爱必信(上海)生物科技有限公司;大鼠肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白T(cTnT)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)酶联免疫吸附试验(ELISA)检测试剂盒购自武汉维克赛思科技有限公司;TNF-α、IL-6、IL-1β免疫组化试剂盒购自上海雅吉生物科技有限公司;3,3-二氨基联苯胺(DAB)显色试剂盒购自北京伊塔生物科技有限公司;蛋白裂解液(RIPA)购自北京百奥莱博科技有限公司;考马斯亮蓝法蛋白含量测试盒购自上海瑶韵生物科技有限公司。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒、电化学发生(ECL)法超敏发光液购自上海烜雅生物科技有限公司。兔抗鼠TLR4/NF-κB、肌动蛋白(β-actin)多克隆抗体、辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗购自北京泽平科技有限责任公司。
1.3 实验仪器设备 2406-2型CO2培养箱,美国SHELLAB公司产品;4200型离心机,日本Kubota公司产品;Primo Star iLED型光学显微镜,蔡司Zeiss公司产品;TKA Teknolabo Miro型全自动酶免分析系统,意大利TKA Teknolabo公司产品;Sub-Cell192型电泳槽、Trans-Blot SD 型半干转印槽,美国BIO-RAD公司产品。
1.4 病毒溶液制备 采用CVB3感染Hela细胞,于CO2培养箱内培养48 h,后置于-70 ℃冰箱15 min,室温融化,重复上述操作3 次后,1 500 r/min离心30 min,取上清液,即CVB3病毒液;稀释病毒液,取10-10~1的10个滴度的病毒液各30 μL分别滴加到含有Hela细胞的96孔板内,每个滴度设3个复孔,连续5 d观察细胞病变情况,其中浮起且折光性增强的细胞为病变细胞,若病变细胞比例>50%即为病变孔。采用Reed等[6]的方法测得CVB3致半数细胞感染量(TCID50)。
1.5 造模及给药方法[7]将所有小鼠按随机数字表法分为对照组、模型组、丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组,每组15只。模型组、丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组分别给予100的TCID50病毒液0.1 mL腹腔注射,对照组给予不含病毒的Eagle′s氏液0.1 mL腹腔注射。病毒接种30 min后,模型组和对照组分别给予0.9% NaCl溶液10 mL/kg灌胃,每日1次;丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组分别给予2.5 mg/mL、5.0 mg/mL丹参酮ⅡA溶液10 mL/kg灌胃,每日1次;阳性对照组给予6.7 mg/mL利巴韦林溶液灌胃,每日1次。各组小鼠均连续给药14 d。
1.6 标本采集与处理[8]末次给药后,每组选取13只小鼠,称量体质量(BM)后摘眼球采血1 mL,室温静置60 min,用低温离心机3 000 r/min离心15 min,分离血清,保存于-20 ℃冰箱备检。处死小鼠,完整取出心脏,吸净表面血液后称量心脏重量(HM),沿左心室长轴分为两部分,其中一部分心肌组织置于10%甲醛内固定24 h,常规经上行梯度乙醇逐级脱水、二甲苯透明、石蜡包埋,制成厚度为4 μm的切片,60 ℃烤片30 min,保存于4 ℃冰箱内,用于HE染色、免疫组化染色;另一部分心肌组织保存于-80 ℃冰箱,用于蛋白免疫印迹(Western Blot)检测。
1.7 观察指标及检测方法
1.7.1 心脏指数计算 计算公式为:心脏指数=HM/BM。
1.7.2 HE染色法观察小鼠心肌组织病理变化 将心肌组织切片取出,经二甲苯脱蜡、下行梯度乙醇(100%→95%→90%→80%→70%)水化后,参照文献[9]以及HE染色试剂盒说明书进行HE染色,之后常规上行梯度乙醇逐级脱水、二甲苯透明、中性树胶封片。在×400光学显微镜下观察心肌组织变化,每张切片随机采集5个不重复视野的图像,计算心肌病理积分并取平均值,评分标准[10]:无组织坏死或炎性浸润,计0分;组织坏死或炎性浸润面积<25%,计1分;组织坏死或炎性浸润面积为25%~50%,计2分;组织坏死或炎性浸润面积为51%~75%,计3分;组织坏死或炎性浸润面积>75%,计4分。
1.7.3 ELISA法检测小鼠血清心肌损伤指标及炎性因子水平 将血清恢复至室温,依据ELISA检测试剂盒说明书中的步骤进行操作,采用TKA Teknolabo Miro型全自动酶免分析系统测定血清CK-MB、cTnT、TNF-α、IL-6及IL-1β水平。
1.7.4 免疫组化染色观察小鼠心肌组织TNF-α、IL-6、IL-1β表达水平 心肌组织切片脱蜡、水化后,置于枸橼酸盐缓冲液进行微波抗原修复,按照免疫组化试剂盒的说明书进行染色,分别依次采用1∶50稀释的TNF-α、IL-6、IL-1β一抗4 ℃孵育16 h、生物素化二抗37 ℃孵育30 min,然后采用DAB试剂盒显色,苏木精复染,结束后常规脱水、透明、封片。在×400倍光学显微镜下观察染色情况,阳性细胞被染成棕褐色或棕黄色,每张切片随机采集5个不重复视野的图像,采用IPP 6.0软件分析TNF-α、IL-6、IL-1β表达的积分光密度值(IOD),并取平均值。
1.7.5 蛋白免疫印迹(Western Blot)法测定小鼠心肌组织TLR4、NF-κB表达水平[11]取出心肌组织100 mg,加入RIPA裂解液(含苯甲基磺酰氟)1 mL,于冰上研磨并裂解30 min,4 ℃、15 000 r/min离心15 min,上清液采用考马斯亮蓝试剂盒测定总蛋白浓度;根据测定结果加入相应体积4×蛋白上样缓冲液,95 ℃加热变性10 min;采用试剂盒制备SDS-PAGE凝胶固定在电泳槽上,加样后,以恒压50 V开始电泳,至目的蛋白刚跑出分离胶停止,用半干转膜仪将蛋白条带转印至100%甲醇处理过的PVDF膜上,置于封闭液内室温摇床封闭2 h,然后将PVDF膜置于1∶500稀释的TLR4、NF-κB及内参β-actin一抗工作液内,4 ℃摇床反应过夜,取出后用TBST洗涤10 min×3次,将PVDF膜置于1∶3 000稀释的二抗工作液内,室温摇床反应90 min,再次用TBST洗涤10 min×3次,将配制好的ECL超敏发光液铺于暗盒内聚偏二氟乙烯(PVDF)膜表面,曝光、显影、定影。采集蛋白条带图像,采用Image J软件分析TLR4、NF-κB及β-actin蛋白条带灰度值,并分别计算TLR4、NF-κB相对内参β-actin的表达量。

2 结 果
2.1 各组小鼠心肌组织病理观察结果 HE染色结果显示,对照组小鼠心肌组织结构、纤维排列无异常,未见炎性细胞浸润或组织坏死(见图1A);模型组小鼠心肌组织存在心肌纤维溶解,大片组织坏死,大量巨噬细胞、淋巴细胞等炎性细胞浸润(见图1B);丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组小鼠心肌组织坏死和炎性细胞浸润较模型组不同程度缓解,其中丹参酮ⅡA高浓度组及阳性对照组改善更为明显(见图1D、图1E)。

图1 各组小鼠心肌组织病理变化(HE染色,×400)(A为对照组;B为模型组;C为丹参酮ⅡA低浓度组;D为丹参酮ⅡA高浓度组;E为阳性对照组)
半定量分析显示,与对照组比较,模型组小鼠心肌组织病理积分明显升高,差异有统计学意义(P<0.05);与模型组比较,丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组小鼠心肌组织病理积分降低,差异均有统计学意义(P<0.05);与丹参酮ⅡA低浓度组比较,丹参酮ⅡA高浓度组和阳性对照组小鼠心肌组织病理积分降低,差异均有统计学意义(P<0.05)。详见表1。
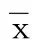
表1 各组小鼠心肌组织病理积分比较(±s) 单位:分
2.2 各组小鼠心脏指数及血清心肌损伤指标比较 与对照组比较,模型组小鼠心脏指数及血清CK-MB、cTnT水平明显升高,差异均有统计学意义(P<0.05)。与模型组比较,丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组小鼠心脏指数及血清CK-MB、cTnT水平降低,差异均有统计学意义(P<0.05);与丹参酮ⅡA低浓度组比较,丹参酮ⅡA高浓度组和阳性对照组小鼠心脏指数及血清CK-MB、cTnT水平降低,差异均有统计学意义(P<0.05)。详见表2。
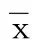
表2 各组小鼠心脏指数及血清CK-MB、cTnT水平比较(±s)
2.3 各组小鼠血清炎性细胞因子水平比较 与对照组比较,模型组小鼠血清TNF-α、IL-6、IL-1β水平明显升高,差异均有统计学意义(P<0.05);与模型组比较,丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组小鼠血清TNF-α、IL-6、IL-1β水平降低,差异均有统计学意义(P<0.05);与丹参酮ⅡA低浓度组比较,丹参酮ⅡA高浓度组和阳性对照组小鼠血清TNF-α、IL-6、IL-1β水平降低,差异均有统计学意义(P<0.05)。详见表3。
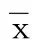
表3 各组小鼠血清TNF-α、IL-6、IL-1β水平比较(±s)
2.4 各组小鼠心肌组织TNF-α、IL-6、IL-1β表达水平比较 与对照组比较,模型组小鼠心肌组织TNF-α、IL-6、IL-1β表达水平明显升高,差异均有统计学意义(P<0.05);与模型组比较,丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组小鼠心肌组织TNF-α、IL-6、IL-1β表达水平降低,差异均有统计学意义(P<0.05);与丹参酮ⅡA低浓度组比较,丹参酮ⅡA高浓度组和阳性对照组小鼠心肌组织TNF-α、IL-6、IL-1β表达水平降低,差异均有统计学意义(P<0.05)。详见表4、图2~图4。
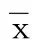
表4 各组小鼠心肌组织TNF-α、IL-6、IL-1β表达水平比较(±s) 单位:×102IOD值

图2 各组小鼠心肌组织TNF-α表达结果(免疫组化染色,×400)(A为对照组;B为模型组;C为丹参酮ⅡA低浓度组;D为丹参酮ⅡA高浓度组;E为阳性对照组)

图3 各组小鼠心肌组织IL-6表达结果(免疫组化染色,×400)(A为对照组;B为模型组;C为丹参酮ⅡA低浓度组;D为丹参酮ⅡA高浓度组;E为阳性对照组)

图4 各组小鼠心肌组织IL-1β表达结果(免疫组化染色,×400)(A为对照组;B为模型组;C为丹参酮ⅡA低浓度组;D为丹参酮ⅡA高浓度组;E为阳性对照组)
2.5 各组小鼠心肌组织TLR4、NF-κB表达水平比较 与对照组比较,模型组小鼠心肌组织TLR4、NF-κB表达水平明显升高,差异均有统计学意义(P<0.05)。与模型组比较,丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组小鼠心肌组织TLR4、NF-κB表达水平降低,差异均有统计学意义(P<0.05);与丹参酮ⅡA低浓度组比较,丹参酮ⅡA高浓度组和阳性对照组小鼠心肌组织TLR4、NF-κB表达水平降低,差异均有统计学意义(P<0.05)。详见表5、图5。
表5 各组小鼠心肌组织TLR4、NF-κB蛋白表达水平比较(±s)

图5 各组小鼠心肌组织TLR4、NF-κB蛋白表达条带图(A为对照组;B为模型组;C为丹参酮ⅡA低浓度组;D为丹参酮ⅡA高浓度组;E为阳性对照组)
3 讨 论
在中医理论中病毒性心肌炎属“风温”“心悸”“胸痹”“怔忡”等范畴,多因素体亏虚,温邪趁虚而入,犯肺伤心所致,核心病机不外乎“虚”“毒”“瘀”,治疗应以补虚祛邪、活血化瘀为主[12]。丹参为临床常用活血化瘀药,有活血祛瘀、凉血消痈、养血安神之效,是中医治疗病毒性心肌炎的高频用药[13]。丹参酮ⅡA为提取自丹参的脂溶性非醌类衍生物成分,在丹参内含量最高,其代谢产物能够在机体内发生多种生物化学反应从而产生相应药理作用,研究显示,其具有抗炎症反应、抗菌、抗病毒、抗脂质过氧化、提高心功能、提高血管内皮功能及心脏保护、抗肿瘤等多方面的药理活性,在临床广泛用于心脑血管病的治疗[14-15]。王德坤等[16]研究显示,丹参酮ⅡA可能通过下调TNF-α、IL-6的表达来减轻病毒性心肌炎小鼠的心肌损伤,减少病死率,达到治疗病毒性心肌炎的目的。研究发现,丹参酮ⅡA磺酸钠注射液可以通过抑制诱导型一氧化氮合酶表达,促进血管内皮因子表达,来减轻CVB3 Nancy病毒感染小鼠引起的冠状动脉血管内皮损伤,并改善心肌灌流,促进受损心功能恢复[17]。可见,丹参酮ⅡA能够从多个途径干预病毒性心肌炎的进展,但具体的作用机制尚未明确。本研究采用CVB3 Nancy病毒腹腔内接种,结果显示,模型组小鼠心脏指数、血清CK-MB、cTnT水平及心肌组织病理积分等指标均高于对照组,心肌组织病理观察也出现结构异常、大量炎性细胞浸润及坏死灶,表现与人类病毒性心肌炎类似,成功建立了病毒性心肌炎小鼠模型。经不同浓度的丹参酮ⅡA或利巴韦林干预后发现,用药组上述指标均较模型组降低(P<0.05),且具有一定的量效关系,表明丹参酮ⅡA能够呈剂量依赖性地改善病毒性心肌炎小鼠心肌组织的病理变化,减轻心肌损伤,对病毒性心肌炎发挥有效的治疗作用。
作为一种炎症性心肌病,炎症反应贯穿病毒性心肌炎的始终,故炎症反应相关的信号通路、细胞因子等也成为病毒性心肌炎发病机制及药物治疗靶点研究的重要方面。关于丹参酮ⅡA治疗病毒性心肌炎的具体作用机制,本研究从TLR4/NF-κB信号通路入手进行了研究。TLR4属于病原模式识别受体中的一员,对多种病毒抗原具有识别作用,可介导抗病毒固有免疫。研究显示,TLR4可介导心肌组织炎症反应,机体被CVB3等病毒感染时,分布于心肌细胞膜上的TLR4能够对病毒或心肌细胞被损伤后释放的因子进行识别,然后将相关刺激信号传入细胞内,诱发级联反应,激活下游的NF-κB,NF-κB为快反应转录因子,被TLR4激活后进入细胞核内,启动相关基因表达,促进细胞因子合成释放,产生免疫应答,诱发炎症反应[18]。病毒性心肌炎病毒感染后NF-κB活性增强,研究发现,NF-κB抑制剂吡咯烷二硫代氨基甲酸(PDTC)能够抑制NF-κB活性,下调A型流感病毒感染导致的病毒性心肌炎小鼠心肌促炎性细胞因子TNF-α、IL-6、IL-1β等表达,减轻心肌炎症浸润[19-23]。本研究结果显示,与模型组比较,丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组及阳性对照组小鼠血清TNF-α、IL-6、IL-1β水平降低,心肌组织TLR4、NF-κB表达水平也降低,且丹参酮ⅡA高浓度组和阳性对照组与模型组的差异最明显(P<0.05),表明丹参酮ⅡA能够有效降低病毒性心肌炎小鼠心肌TLR4/NF-κB信号通路活性,降低血清TNF-α、IL-6、IL-1β水平,这可能是丹参酮ⅡA降低病毒性心肌炎小鼠炎症反应程度的作用机制之一。
综上所述,丹参酮ⅡA能有效减轻病毒性心肌炎小鼠心肌损伤和炎症反应,且呈现一定量效关系,其心肌保护作用可能与抑制TLR4/NF-κB信号通路的活性、减少炎性细胞因子释放有关。

