FXR 通过调控脂滴蛋白PLIN5 延缓纤维化的调控机制
黄晓霞,郑志民,庞碧滢,黄娜娜,李 馨,熊文婷,孔 波,刘吉升
(广州大学生命科学学院,广东 广州 510006)
非酒精性脂肪肝病 (non-alcoholic fatty liver disease,NAFLD)是目前世界范围内最常见的肝脏疾病,目前世界上约有25% 的人患有NAFLD,NAFLD 与2 型糖尿病和肥胖密切相关,其特征是由于脂肪在肝细胞的过度堆积而造成的肝损伤[1]。肝纤维化是NAFLD 进展中的生理过程,是肝脏受到损伤后的一种自我修复,其病理特征为汇管区和肝小叶内有大量的细胞外基质沉积和纤维组织增生。酒精、脂质代谢失衡、病毒等因素都会造成肝纤维化[2]。在肝纤维化过程中,肝细胞、肝窦内皮细胞、巨噬细胞和肝星状细胞(hepatic stellate cell,HSC)等相互作用,产生多种细胞因子和氧化活性产物,进一步刺激炎症和纤维化的发展[3]。如果不加以干预,会恶化为肝硬化甚至肝癌[4]。
肝纤维化的标志是HSC 的激活[5]。HSC 位于肝细胞和肝窦内皮细胞的Disse 间隙中,约占所有肝脏细胞的10%。在健康生理状态下,HSC 处于不增殖的静息状态,贮存大量含维生素A 的脂滴。当受到外界刺激因素时,HSC 分化为肌成纤维细胞,转变为增殖的活化状态,随后脂滴丢失。其中α-SMA 蛋白表达增加,产生大量的细胞外基质和胶原纤维[6]。由于肝纤维化是可逆的,因此阻断和逆转HSC 激活是预防肝纤维化的关键手段[7]。
HSC 的激活与脂滴的丢失紧密相连,PLIN5 属于脂滴蛋白家族的一员,PLIN5 在心肌、骨骼肌和肝星状细胞中高表达,具有维持脂滴稳态的作用[8]。研究表明,外源性PLIN5 能逆转HSC 的激活并恢复脂滴的形成,这种作用是通过调节脂质代谢和减少氧化应激来实现的[9,10]。通过课题组前期研究发现小鼠的Plin5 启动子区存在多个法尼醇X 受体(farnesoid x receptor,FXR)的顺式调控元件FXRE(FXR response element,FXRE)。FXR 属于核受体超家族的一员,在肝脏,肠道和肾脏高表达,胆汁酸是FXR 的生理配体[11]。FXR 作为一种转录因子,具有调控胆汁酸稳态和脂质代谢、减少纤维化等多重生理功能[12]。因此,FXR 是针对肝病的热门研究靶点[13]。已有文献报道,小鼠缺乏FXR 会导致肝脏胆固醇和甘油三酯增加,促进动脉粥样硬化的发展,以上结果强调了FXR 在调节脂质和脂蛋白代谢中的作用[14]。但FXR 是否能通过调控PLIN5 减缓脂肪肝病的纤维化进程,尚未报道。本研究中选择用人肝星状细胞系LX-2,通过双荧光素酶报告基因体系,验证生物信息学预测的人PLIN5 FXRE 位点能否与FXR 结合;用TGF-β1 刺激LX-2 构建肝纤维化细胞模型,探究FXR 和PLIN5 过表达对脂滴形成和抑制LX-2 活化的影响,以期为FXR 调控脂质代谢和抑制肝纤维化的机制提供科学理论支持。
1 材料与方法
1.1 细胞和试剂
人胚胎肾细胞HEK293T 由广州大学精准基因编辑中心乔云波课题组馈赠,由本实验室保存;人肝星状细胞系LX-2 购自武汉普诺赛公司;报告基因质粒pGL4-Luc (101788)购自addgene 平台;过表达质粒pCI-GFP 由广州大学精准基因编辑中心王刚课题组馈赠;2×Taq Master Mix PCR,T4 DNA连接酶、Exfect 转染试剂、M-MLV (H-)逆转录酶、RNA-easy 总RNA 提取试剂盒、ChamQ 实时荧光定量PCR 试剂盒、DH5α 感受态细胞和BCA 试剂盒均购自南京诺唯赞公司;TGF-β1 细胞因子购自美国PeproTech 公司;opti-MEM 培养基,血清FBS,DMEM 高糖培养基,胰酶均购自Invitrogen 公司;ECL 化学发光试剂盒,蛋白酶抑制剂,磷酸酶抑制剂,兔二抗,鼠二抗,β-actin 一抗,4%的多聚甲醛固定液和改良油红O 试剂盒均购自上海碧云天公司;组织细胞甘油三酯酶法测定试剂盒购自普利莱公司;α-SMA 一抗,Collagen Ⅰ一抗购自abcam 公司,PLIN5 一抗购自Proteintech 公司。
1.2 主要仪器
Nanodrop 微量分光光度计,Thermofisher 公司;ABI miniAMP PCR 扩增仪,Thermofisher 公司;ABI QuantStudio 3 定量PCR 仪,Thermofisher 公司;CO2细胞培养箱,Thermofisher 公司;SW-CJ-1FD 型超净工作台,苏州苏净集团安泰公司;Infinite M Plex 多功能酶标仪,Tecan 公司;Biospectrum Imageing System 化学发光成像仪,UVP公司;SCILOGEX SLK-O3000-S 水平摇床,Scilogex 公司。
1.3 细胞培养
LX-2 细胞培养于含10% FBS 高糖DMEM 培养基中,在37 ℃,5% CO2的环境下生长。细胞肝纤维化体外模型诱导条件:使用TGF-β1(10 ng/mL)诱导LX-2 细胞,分别在 24 h 和48 h 用于mRNA 和蛋白检测。
1.4 qPCR
参考总RNA 提取试剂盒说明书进行总RNA提取,用Nanodrop 进行RNA 定量分析,用于后续逆转录。参考反转录试剂盒说明书进行逆转录得到cDNA。参考ChamQ Universal SYBR qPCR Master Mix 说明书配置反应体系,采用ABI QuantStudio 3 进行qPCR 检测。引物由擎科生物合成,qPCR 所用引物如表1 所示。
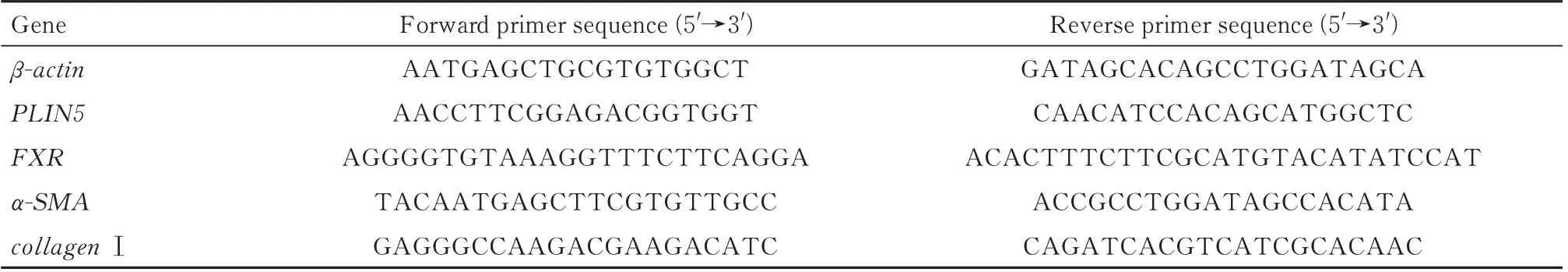
表1 qPCR 所用引物序列Tab 1 Primer sequences for qPCR
1.5 PLIN5 FXRE 位点预测
通 过 在 线软 件 UCSC genomic browser(https://genome.ucsc.edu/),确定人和小鼠PLIN5基因的调控区域DNA 序列信息。进一步通过在线软件工具NubiScan(https://www.nubiscan.unibas.ch/)预测这些DNA 片段中可能含有的顺式作用元件FXRE,预测结果如图1 A 中所示。

图1 FXRE 位点预测(A)和构建的质粒示意图(B-C)Fig 1 Prediction of FXRE sites(A)and constructed reporter gene plasmid(B-C)
1.6 质粒构建
参考诺唯赞 2×Taq Master Mix PCR 试剂说明书进行PCR 克隆得到目的片段,所用引物如表2 中所示。参考内切酶、T4 DNA 连接酶、DH5α 感受态细胞的说明书进行酶切、连接和转化,在pGL4-Luc的荧光素酶基因上游插入FXRE 片段得到pGL4-PLIN5 FXRE wt-Luc、pGL4-PLIN5 FXRE mut-Luc 和pGL4-3×PLIN5 IR-1-Luc 质粒(图1 B)。在过表达质粒pCI-GFP 的CMV 启动子下游切除原有的GFP 基因,插入对应基因的编码序列(Coding sequence,CDS),构 建 得 到 质 粒pCI-PLIN5 和pCI-FXR(图1 C)。

表2 DNA 克隆引物序列Tab 2 Primer sequences for DNA cloning
1.7 细胞转染
将LX-2 接种于6 孔板中,待细胞聚合度为70%~80%时,参考转染试剂的说明书,按照每孔共1.5 μg 质粒与 3 μL 转染试剂进行瞬时转染,质粒和转染试剂分别用200 μL opti-MEM 培养基稀释后混匀,静置15 min 后,滴加到六孔板中并摇匀,转染6 h 后换液。HEK293T 转染条件如上所述。
1.8 油红O 染色
细胞处理后,按照碧云天制造商的说明进行固定和染色,在倒置显微镜下进行观察。
1.9 双荧光素酶报告基因检测
GW4064 是常用的FXR 激动剂,本实验室用于激活FXR 的使用浓度为2 μmol/L。HEK293T 细胞按1.6 方法转染6 h 后,将细胞用胰酶消化并离心,均匀接种到96 孔板,以保证转染效率一致。设置相同体积的DMSO 溶剂组和2 μmol/L GW4064处理组,每组3 个重复,分别在18 h 和42 h 进行双荧光素酶报告基因检测。诱导细胞完成后,吸除培养基,用PBS 漂洗2 次后弃去,96 孔板每孔加入50 μL报告基因裂解液,室温静置裂解5 min,吹打并吸取细胞裂解产物至1.5 mL EP 管中,4 ℃,12 000×g 离心3 min,取上清液进行检测。吸取10 μL 上清液至96 孔检测板中,将50 μL 孵育至37 ℃的Luciferase Substrate 加入检测孔中,迅速混匀后立即用酶标仪检测萤火虫荧光素荧光值。另取10 μL 上清液,加入50 μL 孵育至37 ℃的Renilla 工作液,迅速混匀后立即用酶标仪检测海肾荧光素荧光值。以检测的萤火虫荧光素酶数值和海肾荧光素酶数值的比值(Fluc/Rluc)表示荧光素酶活性的强弱,从而显示转录活性的强弱。在转染相同质粒的组中,继续用GW4064 处理组相对于溶剂组的比值(GW/DMSO)表示相对荧光素酶活性,作为本底活性诱导效率。
1.10 Western blot
使用RIPA 裂解液对细胞进行裂解,4 ℃离心后,取上清。通过BCA 法测定样品蛋白浓度。样品加入蛋白上样缓冲液后,在100 ℃金属浴中加热10 min 进行变性。根据不同蛋白的分子大小,配置8%,10%,12%的SDS-PAGE 胶,在80 V/30 min,120 V/60 min 条件下进行电泳,在230 mA/90 min条件下将蛋白转移到提前被甲醇激活的PVDF 膜上,5%的脱脂奶粉室温封闭1 h 后,加入一抗4 ℃孵育14~18 h,用TBST 缓冲液洗膜3 次,每次10 min;加入辣根过氧化物酶标记的二抗(1∶10 000)在室温下孵育1 h 后,用TBST 缓冲液洗膜3 次,每次10 min;加入ECL 发光液反应3 min,进行显影成像。
1.11 TG 检测
细胞处理后,按照制造商的说明进行TG 含量的检测;用BCA 法对剩余样品进行总蛋白定量,以蛋白浓度校正TG 含量。
1.12 统计学处理
用 Graphpad Prism 9.0 进行统计分析和作图 。结果用(±s)表示。采用t检验来统计分析两组间的差异显著性,采用单因素方差分析(ANOVA)统计分析多组间差异显著性。P<0.05 为差异具有统计学意义。
2 结果
2.1 FXR 与PLIN5 IR-1 结合
FXR 作为转录因子能识别并结合下游靶基因的FXR 反应元件,典型的FXRE 片段为IR-1,即被1个核苷酸分隔形成的反向重复序列[15]。图1 A 中,NUBIScan 分析显示,小鼠和人PLIN5 基因上游调控序列均存在IR-1 片段,同时将包含IR-1 片段及其上下游部分序列进行了比对。为了确定FXR 结合PLIN5 启动子的能力,将含有IR-1 序列的起始转录位点-176/+179 的序列克隆到荧光素酶基因的上游,构建了pGL4-PLIN5 FXRE wt-Luc,命名为FXRE wt 组。类似地构建了包含IR-1 突变序列的荧光素酶载体pGL4-PLIN5 FXRE mut-Luc(图1 B),命名为FXRE mut 组。在HEK293T 细胞中进行瞬时共转染,将pGL4-Luc 组作为对照组,命名为Vec 组。FXRE wt 组和FXRE mut 组的相对荧光素酶活性(GW/DMSO)无显著差异(图2 B)。在FXRE wt 组和FXRE mut 组中,无论是DMSO 处理组还是GW4064 处理组的荧光素酶活性,都相比于Vec 组高150 多倍(图2 A)。这可能是由于该片段存在LX-2 细胞中其它调控因子调控的位点,GW4064 激活FXR 后无法进一步地激活报告基因。因此重新构建了包含3 段PLIN5 IR-1 重复相连的质粒,命名为3×IR-1 组。在图2 B 中,3×IR-1 组的相对荧光素酶活性(GW/DMSO)相对于Vec 组增加10 倍(P<0.000 1)(图2 B)。以上结果表明,PLIN5 启动子上游含有FXR 的反应元件IR-1,能与FXR 结合并调控下游靶基因。

图2 PLIN5 FXRE 片段与FXR 的结合效应Fig 2 Binding effect of PLIN5 FXRE fragments with FXR
2.2 FXR 在LX-2 细胞中低量表达
验证LX-2 细胞中FXR 是否能被激活。图3 A表明GW4064 处理LX-2 细胞后,已知的FXR 靶基因SHP 的转录水平相较于DMSO 处理组没有显著差异。进一步的qPCR 检测发现LX-2 细胞中的FXR 表达量低(未显示),GW4064 处理无法激活FXR 的靶基因。通过进一步向LX-2 细胞中转染FXR 过表达质粒和双荧光报告基因体系来检测FXR 的激活,pCI-GFP 转染组作为阴性对照(Vec组),GW4064 处理LX-2 细胞24 h 和48 h 后,FXR过表达组的相对荧光素酶活性(GW/DMSO)相比Vec 组分别升高12 倍(P<0.001)(图3 B)和6 倍(P<0.01)(图3 C)。上述的结果表明在LX-2 细胞中过表达FXR 能够被FXR 激动剂GW4064 激活。

图3 qPCR 和双荧光报告基因体系检测LX-2 中FXR 的激活Fig 3 Detection of FXR activation by qPCR and dual luciferase reporter gene system in LX-2 cells
2.3 FXR上调PLIN5的mRNA转录水平和蛋白水平
在LX-2 细胞中过表达FXR,用GW4064 处理后,检测PLIN5 的表达水平。Control 组未转染质粒,pCI-GFP 转染组作为阴性对照(Vec 组)。结果显示,过表达FXR 组相比于Control 组和Vec 组,PLIN5 的mRNA 转录水平和蛋白表达水平显著增加(P<0.01)(图4)。这些结果表明FXR 激活能够上调PLIN5 的基因表达。
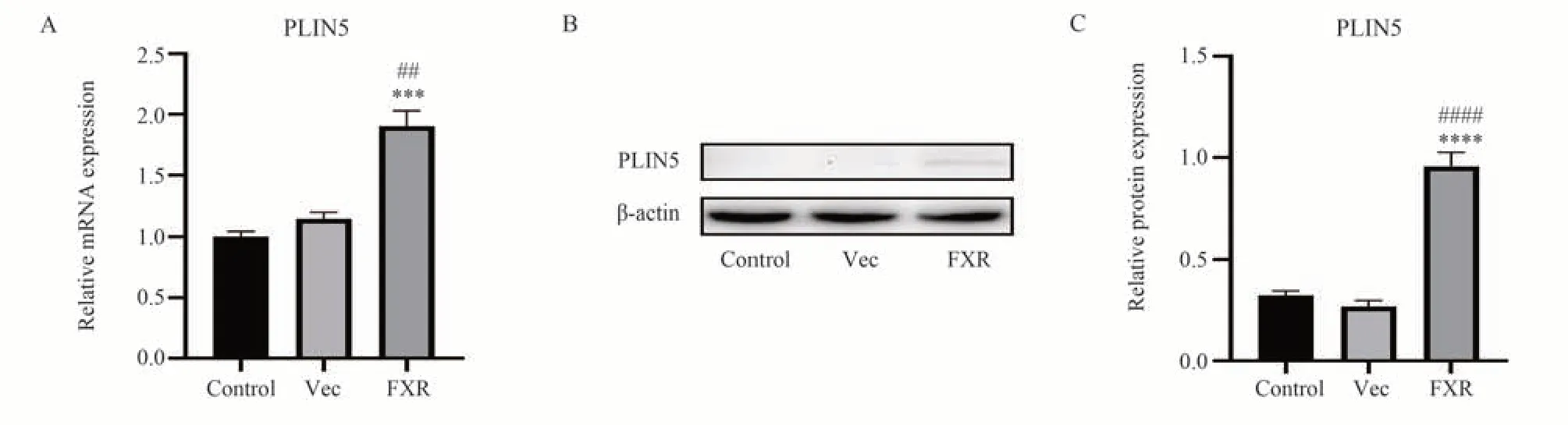
图4 FXR 激活上调PLIN5 的表达Fig 4 Activation of FXR up-regulates PLIN5 expression
2.4 FXR 激活无法进一步促进脂滴的形成和抑制LX-2 的活化
在体外模型中,通常用油酸来提供游离脂肪酸(free fatty acids,FFA)的来源[16]。油酸处理在LX-2 细胞形成微小脂滴,脂滴的形成和维持与HSC 的活化可能相关。图5 A 的油红O 染色结果和图5 B 的TG 含量检测结果显示,30 μmol/L 油酸处理不足以形成能被油红O 染色的脂滴,FXR 过表达和GW4064 激活后并不能进一步地促进细胞中的脂滴形成。TGF-β1 是诱导HSC 激活的强效细胞因子,用来刺激LX-2 以构建肝星状细胞活化模型。图5 C 中,FXR 在激活的条件下,对TGF-β1 上调的纤维化基因α-SMA 和Collagen Ⅰ的mRNA 水平没有显著的抑制作用。
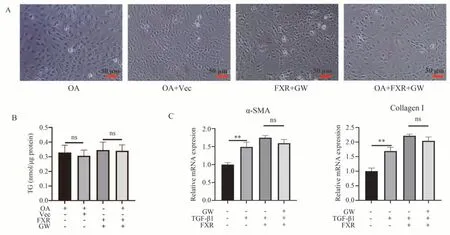
图5 过表达FXR 对脂滴和纤维化基因的影响Fig 5 Effect of FXR over-expression on lipid droplet and genes of fibrosis
2.5 过表达PLIN5 促进脂滴的形成并抑制LX-2 的活化
已有研究显示,PLIN5 的基因表达在活化的HSC 细胞中显著降低甚至消失[10]。LX-2 在体外已经是高度活化的状态。根据2.4 的结果,验证过表达PLIN5 能否通过促进脂滴的形成并抑制LX-2 的活化。图6 A 和B 中,由油红O 染色和TG 含量检测结果可知,PLIN5 过表达后,在30 μM 油酸处理条件下促进脂滴的形成。图6 C-D,PLIN5 过表达能显著抑制TGF-β1 上调的纤维化基因α-SMA 和Collagen Ⅰ的mRNA 水平(P<0.001)和蛋白水平(P<0.05)。
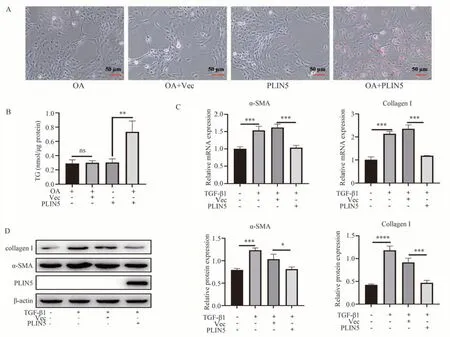
图6 过表达PLIN5 对脂滴和纤维化基因的影响Fig 6 Effect of PLIN5 over-expression on lipid droplet and genes of fibrosis
3 讨论
FXR 作为核受体,通常与配体结合后被激活,FXR 通过与RXRα 形成异源二聚体,识别并结合其下游靶基因的FXRE,从而调控靶基因的转录。通常与FXR 结合最强的FXRE 片段为IR-1。本课题组通过生物信息学预测,发现人的PLIN5 启动子区域可能存在FXRE 位点,通过构建双荧光素酶报告基因体系证明了PLIN5 FXRE 位点。并且FXR 激活能够增加PLIN5 的mRNA 水平和蛋白水平,这可能是FXR 激活抑制肝纤维化的部分机制。
图2 A 中的FXRE wt 组和FXRE mut 组的结果显示,构建的FXRE 上下游片段在LX-2 细胞中存在其它调控因子调控的位点,即使是DMSO 处理组,仍显示出较高的荧光素酶活性,GW4064 激活FXR后无法进一步地激活报告基因。3×PLIN5 IR-1 组的相对荧光素酶活性(GW/DMSO)相比于Vec 组增强10 倍,这表明了PLIN5 IR-1 能与FXR 结合。双荧光素酶报告基因体系是一种高灵敏的检测手段,尽管通过此体系显示,FXR 激活后结合PLIN5 IR-1,并上调荧光素酶的表达,但这种结合活性对PLIN5 转录水平上的调控还未知。
在过表达FXR 并激活的条件下,发现在LX-2中能增加PLIN5 的mRNA 水平和蛋白水平(图4)。推测增加的PLIN5 的表达可能会影响脂滴的形成和LX-2 的活化,但图5 的结果表明,FXR 过表达并用GW4064 激活后,未能恢复脂滴的形成和抑制纤维化基因α-SMA 和CollagenⅠ的mRNA 水平。以往的研究表明,FXR 能在大鼠HSC 及2 种细胞系HSC-T6 和LX-2 中表达,FXR/SHP 通过减少胶原蛋白CollagenⅠ表达、抑制AP-1 下游促纤维化信号、抑制Timp-1 的表达并增加MMP-2 的活性来促进HSC 静息态的发展并增加HSC 的凋亡,从而防止肝纤维化的发展,FXR 配体可能会有利于治疗肝纤维化[17,18]。而结果未能支持上述研究,可能存在以下原因:一方面,在验证LX-2 细胞中FXR 激活条件时发现,FXR 在LX-2 中的表达量很低,导致GW4064 处理后,检测FXR 靶基因SHP 的mRNA水平无显著变化(图3 A)。推测可能是由于体外模型LX-2 的活化程度存在差异,活化程度太高导致其丧失在静息态时的某些基因功能,而获得了肌成纤维细胞的某些功能,FXR 可能在此过程中也下调了表达,发挥的生物学功能有限。另一方面,图4 中过表达FXR 诱导的PLIN5 蛋白处于低水平,相比图6 中过表达PLIN5 检测的蛋白水平,存在显著的差距。因此,这种FXR 诱导的PLIN5 水平还不足以发挥PLIN5 恢复脂滴和抑制LX-2 的活化的功能。
已有证据表明FXR 在HSC 中存在,并发挥抗纤维化的作用[19,20]。Plin5 在新鲜分离的小鼠原代HSC 中也有表达,在分离后的活化过程中,Plin5 伴随着脂滴迅速丧失,过表达Plin5 能恢复脂滴的形成并延缓HSC 的活化[9]。在图6 的结果中,也支持PLIN5 抑制LX-2 活化的作用。尽管在研究体外模型中,FXR 表现出的参与肝纤维化的作用有限,但体外用于研究的LX-2 细胞系和体内HSC 存在差异,FXR 结合PLIN5 FXRE 参与HSC 活化的作用在体内未知,需要进一步研究。
综上所述,本研究发现FXR 激活能结合PLIN5 IR-1,并上调PLIN5 的mRNA 水平和蛋白水平;同时,过表达PLIN5 能够下调肝纤维化基因的表达。尽管在本研究的体系中,FXR 上调PLIN5 后参与肝纤维化的作用有限,但结合目前的研究结果,仍不能排除FXR 参与肝纤维化的作用。这些数据补充了FXR 调节脂质代谢基因PLIN5 的空白,为今后进一步的体内研究揭示FXR 参与HSC 活化和保护肝纤维化的机制提供了理论支持。
作者贡献度说明:
黄晓霞:思路设计,数据获取分析,起草或修改文章关键内容;孔波:思路设计,数据获取分析,起草或修改文章关键内容;郑志民,庞碧滢,黄娜娜,李馨,熊文婷,刘吉升:参与实验评估。
所有作者声明不存在利益冲突关系。

