胆木抗肝癌活性的网络药理学及初步细胞筛选研究
陈维佳,周明艳,胡继成,祝 哲,徐 剑
(1.海南医学院第二附属医院器官移植科,海南 海口,570105;2.海南医学院第二附属医院临床医学研究所,海南 海口,570105;3.海南省器官移植研究所,海南 海口,570105)
肝癌是我国第5 位常见恶性肿瘤及第2 位肿瘤致死病因,对我国人民的生命健康及财产安全产生极大影响[1]。早期肝癌细胞(hepatoma carcinoma cell,HCC)无远处转移,肿瘤手术切除是主要的治疗手段。但是多数患者一经确诊,已经属于肝癌晚期,错过手术治疗最佳时期,往往只能通过药物治疗。目前临床上抗肝癌主要使用的是索拉非尼等一线治疗药物,但长期使用患者容易产生耐受性和腹泻、手足综合征、高血压等不良反应[2]。因此,研究有效的肝癌防治药物已经迫在眉睫。中药作为我国的瑰宝,许多临床研究已经证明其在改善晚期肝癌患者的症状和提高生活质量,减少肿瘤复发,控制疾病进展及药物耐受性等方面具有很好的效果[3,4]。
胆木又称药乌檀,是我国唯一原产的茜草科乌檀属植物品种[5],主产于海南琼中、白沙等黎族区域,其味苦、性寒,主要活性成分是生物碱类[6]。生物碱类抗肝癌具有低毒性、效性强和特异性高的特点,其抗肝癌机制并不是直接杀死肝癌细胞,而是通过改变肝癌细胞形态、抑制癌细胞转移、促进细胞凋亡及引起细胞周期阻滞等发挥抗肝癌作用[7]。已有研究发现,胆木中的短小蛇根草苷、3-表短小蛇根草苷、喜树果苷等生物碱具有抗肿瘤作用[8,9]。
目前胆木抗肝癌的作用及机制尚不十分明确,因此本研究对胆木抗肝癌的作用及机制进行预测并初步验证。网络药理学是现代中药研究的新手段,利用化合物与疾病相互作用的靶点,探索药物的作用机制[10,11]。而中药强调药物对机体网络的整体作用,网络药理学与中药作用的整体观吻合,故网络药理学对于研究中药具有独特优势[12]。本研究利用网络药理学方法,对胆木抗肝癌作用的药效成分、潜在靶点和通路机制进行了系统地预测,并通过体外细胞实验初步验证胆木主要成分异长春花苷内酰胺抗肝癌药理活性,为后续深入探究及临床应用提供理论依据。
1 材料与方法
1.1 胆木化学成分筛选及预测靶点获取
通过检索PubMed、CNKI 得到胆木的主要化合物成分,检索PubChem 数据库(http://pubchem.ncbi.nlm.nih.gov)获取胆木化学成分的分子结构及CanonicalSMILES 号,通过SwissTargetPrediction(http://swisstargetprediction.ch/)网站,预测胆木化学成分的靶点,采用 UniProtKnowledgebase(http://www.uniprot.org/)校正后,以SwissTarget-PredictionProb≥0.10、TargetNetProb≥0.60 或者PharmMapperFit≥0.60 为条件筛选预测靶点。
1.2 肝癌靶点获取
以“liver cancer”及“hepatocarcinoma”为关键词,种属限定为“Homo sapiens”,搜索PharmGKB(https://www.pharmgkb.org)、DisGeNET(http://www.disgenet.org)、OMIM(http://www.omim.org)、GeneCards(https://www.genecards.org/)数据库,以GeneCards 得分≥15 分,DisGeNET≥0.10为筛选条件,并集后删除重复靶点得到肝癌的靶点。
1.3 胆木抗肝癌的作用靶点的获得
将胆木的靶点与肝癌靶点使用Venny2.1(http://bioinformatics.psb.ugent.be/webtools/Venn/)取交集,获得胆木抗肝癌作用靶点。
1.4 PPI 网络构建与分析
将上述胆木抗肝癌作用靶点上传到STRING11.5 数据库,设置物种为“Homo Sapiens”及置信度为0.9,隐藏游离靶标,下载TSV 格式文件导入Cytoscape3.9.1 软件绘制PPI 网络图。运用“Network Analyze”对网络中基因节点度值、介数等进行分析并筛选核心靶点。
1.5 胆木抗肝癌作用靶点的生物学功能和通路富集分析
将胆木抗肝癌的作用靶点导入David 数据库(https://david.ncifcrf.gov/),设置物种为“Homo Sapiens”,阈值P<0.05,进行生物学功能和通路富集分析,通过OMishare Tools(https://www.omicshare.com/tools/)将结果可视化。
1.6 胆木抗肝癌“药物-成分-靶点-通路-疾病”相互作用网络构建
将胆木抗肝癌靶点和成分及前14 富集的信号通路导入到Cytoscape3.9.1,绘制“药物-成分-靶点-通路-疾病”网络图。节点代表药物、成分、靶点、通路、疾病,通过度值筛选胆木抗肝癌活性成分。
1.7 胆木抗肝癌关键成分与核心靶点的分子对接
活性成分作为配体,在PubChem 中下载关键成份的3D 结构;核心靶点作为受体,从ProteinData-Bank 数据库(https://pubchem.ncbi.nlm.nih.gov/)下载核心靶点的3D 分子结构。将活性成分和核心靶点导入Discovery Studio2019 Client 软件,再去水、加氢等处理后,用DOCKLigand 进行分子对接,得到活性成分与核心靶点作用关系图。
1.8 体外细胞实验
1.8.1 材料 LX-2 人正常肝细胞、HepG2 肝癌细胞、DMEM 和RPMI-1640 培养基、10%胎牛血清、1% 青霉素/链霉素、0.25% 胰酶、PBS 缓冲液、CCK8 试剂盒(APExBIO)、异长春花苷内酰胺(购自MedBio,纯度≥98%)、Annexin V-APC/PI 双染细胞凋亡检测试剂盒(凯基公司)、GAPDH、SRC、STAT3、MAPK3 引物(生工生物工程公司)。
1.8.2 仪器与试剂 可调量程移液枪、0.22 μm 微孔滤膜、96 孔板、24 孔板、恒温CO2细胞培养箱和水浴锅、精密电子天平、超净工作台、流式分析仪(Beckman 公司,型号:cytoflex)、实时荧光定量PCR仪(美国ABI 公司)。
样品溶液的配制:异长春花苷内酰胺用培养基配成浓度为100 mmol/L 的母液,4 ℃冰箱保存备用。
1.8.3 细胞培养与分组 细胞培养:将LX2、HepG2 细胞接种到新的25 cm2培养瓶中,加入约4 mL 含10%胎牛血清和1%链霉素的RPMI-1640、青霉素或DMEM 培养液,于37 ℃、5% CO2条件下培养,每隔两天换一次培养液。直至细胞贴壁率约80%~90%,状态良好时对细胞进行后续试验。
细胞分组:空白组(不含异长春花苷内酰胺)、给药组(异长春花苷内酰胺不同浓度组)。
1.8.4 CCK8 测定 取对数生长期细胞,制成单细胞混悬液,调整细胞浓度,将细胞以10 000 个/孔的密度接种于96 孔板中,每组设置5 个复孔,用无菌PBS 填充边缘。37 ℃、5% CO2条件下孵育,次日给药干预。12 h 后,吸弃96 孔板内液体,每孔加入100 μL 含CCK8 培养基,37 ℃、5% CO2孵育1 h。孵育结束后,在酶标仪450 nm 处测吸光度。
1.8.5 流式细胞仪检测细胞凋亡 取人肝癌HepG2 细胞,以2×105个每孔接种于6 孔板,用0、40、80、120、160 μmol/L 浓度异长春花苷内酰胺溶液处理12 h 后,经预冷的磷酸缓冲盐溶液(PBS)漂洗,用500 μL 的Binding Buffer 重悬细胞。加入Annex-in V-FITC 轻轻吹匀,再加入5 μL 的PI 混匀,室温避光反应15 min,采用流式细胞仪检测细胞凋亡情况。
1.8.6 Real-time PCR 检测 取人肝癌HepG2 细胞,以2×105个每孔接种于6 孔板,用0、40、80、120、160 μmol/L 浓度异长春花苷内酰胺溶液处理,12 h后样本中提取RNA 后利用反转录试剂盒,按照说明书,以37 ℃,15 min;85 ℃,5 s 进行反转录。PCR扩增根据仪器说明书:95 ℃预变性5 min;95 ℃变性10 s,57.5 ℃退火20 s,延伸20 s,循环反应40 次,95 ℃,15 s,60 ℃溶解持续60 s。采用溶解曲线,最后统计Ct 值,结果以GAPDH 为参照,采用2-ΔΔCt相对定量法比较各组目标mRNA 表达差异,引物序列见表1。
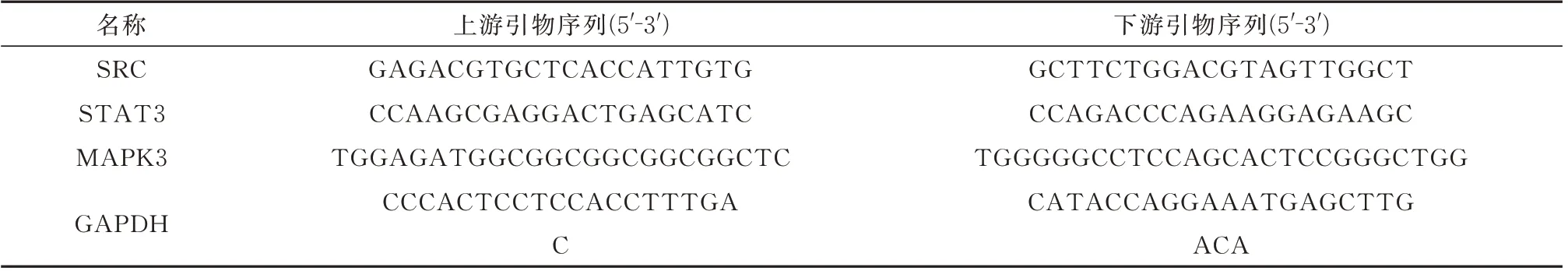
表1 引物序列Tab 1 Primer sequence
1.9 统计学处理
用统计学软件GraphPad Prism 9.0 整理分析数据,实验数据用均值±标准差(±s)表示。组间差异比较用t检验,方差不齐用非参数检验,多组间比较用单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 胆木成分的筛选及靶点的获取
使用化学专业数据库以及查找文献[13-15],收集胆木的化学成分,再通过检索PubChem 数据库得到含有分子结构的化合物14 个,主要为:异长春花苷内酰胺(DM1)、喜果苷(DM2)、短小蛇根草苷(DM3)、NaucleamideG(DM4)、山奈酚-3-O-芸香糖苷(DM5)、阿魏酸乙酯(DM14)、芦丁(DM6)、3,4,5-三甲氧基苯酚(DM7)、二氢猕猴桃内酯(DM8)、2,4-二羟基-3,6-二甲基苯甲酸甲酯(DM9)、4-羟基-3,5-二甲氧基苯甲醛(DM10)、VinmajineI(DM11)、3-醛基吲哚(DM12)、狭花马钱碱(DM13)、阿魏酸乙酯(DM14)。按筛选条件将各个数据库预测的胆木靶点合并,得到胆木靶点587 个。其中异长春花苷内酰胺是黎药胆木中主要的活性成分,属于吲哚类生物碱[6,16]。
2.2 肝癌靶点获取
按筛选条件,得到的肝癌靶点为GeneCards 数据库1 981 个、OMIM 数据库507 个、DisGeNET 数据库1 396 个、PharmGKB 数据库284 个,取并集后得到肝癌的靶点3 319 个,见图1。
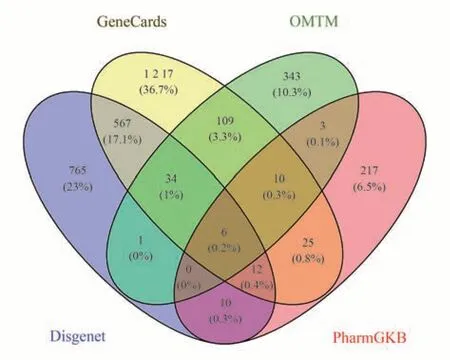
图1 肝癌对应靶点匹配维恩图Fig 1 Venn diagram of targets of HCC
2.3 胆木抗肝癌作用靶点获取
将587 个胆木靶点与3 319 个肝癌靶点导入Venny 2.1,得到288 个共有靶点见图2,这288 个共有靶点即为胆木抗肝癌作用靶点。
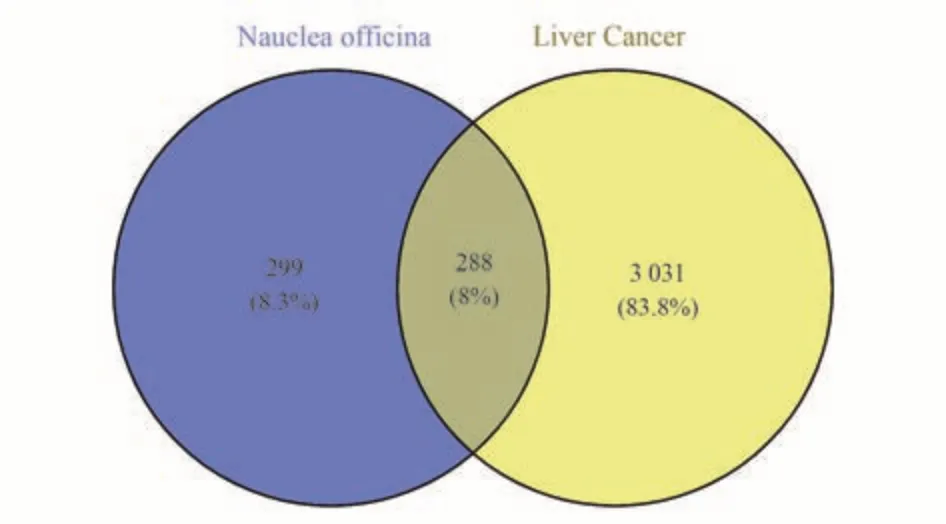
图2 胆木与肝癌对应靶点匹配维恩图Fig 2 Venn diagram of Nauclea Officinalis and corresponding targets of HCC
2.4 PPI 网络构建与分析
将共有靶点导入STRING 数据库后,再导入Cytoscape 3.9.1 软件中构建PPI 网络图,包括98 个节点,794 条边,见图3。并在软件进行网络拓扑分析,结果表明TP53、SRC、STAT3、HSP90AA1、PIK3R1、MAPK3 等邻接节点最多,且在表2 中胆木抗肝癌PPI 网络靶点自由度值排名靠前,可能为核心靶点。
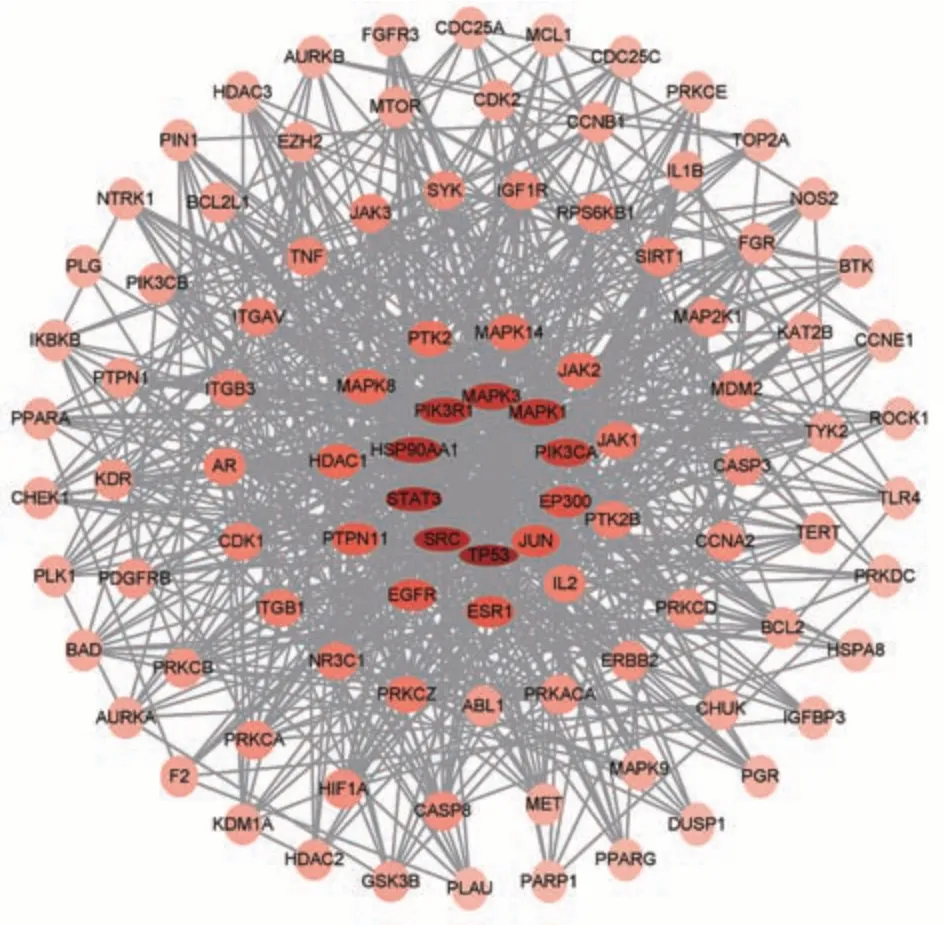
图3 胆木抗肝癌靶点PPI 图Fig 3 PPI diagram of anti-HCC targets of Nauclea Officinalis
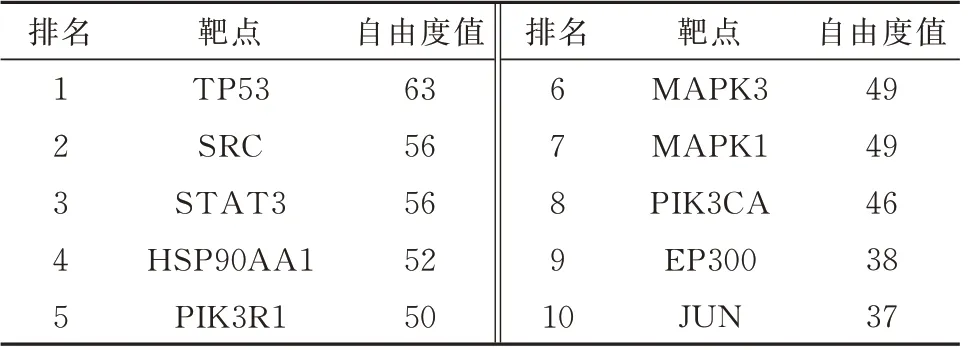
表2 胆木抗肝癌PPI 网络靶点自由度值排名Tab 2 Ranking of the degree of PPI network targets of Nauclea Officinalis against HCC
2.5 胆木抗肝癌作用靶点的生物学过程和通路富集分析
将胆木抗肝癌靶点进行分析GO、KEGG 富集分析(P<0.05)。GO 功能富集分析中生物过程(BP)相关的条目994 个,主要涉及蛋白质磷酸化、蛋白质自身磷酸化、凋亡过程的负调控等;细胞成分(CC)相关的条目125 个,关于胞液、受体复合体、质膜、高分子复合物、核浆等方面;分子功能(MF)相关的条目238 个,主要涉及激酶活性、酶的结合、相同的蛋白质结合等,将富集基因数多的前10 名BP、CC、MF 的生物学过程可视化分析结果见图4。KEGG 通路富集分析,胆木抗肝癌靶点主要作用于癌症通路、乙型肝炎、EGFR 酪氨酸激酶抑制剂抵抗、PI3K-Akt 等信号通路,前20 的KEGG 通路可视化分析结果见图5。
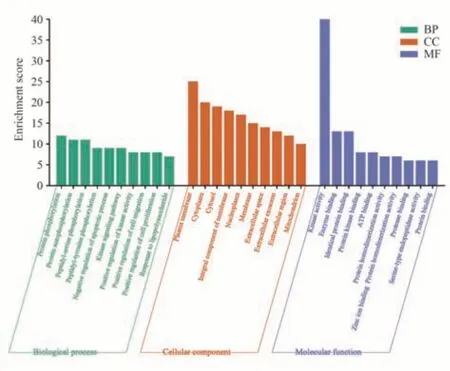
图4 胆木抗肝癌GO 富集分析图Fig 4 GO function enrichment analysis of anti-HCC targets of Nauclea Officinalis
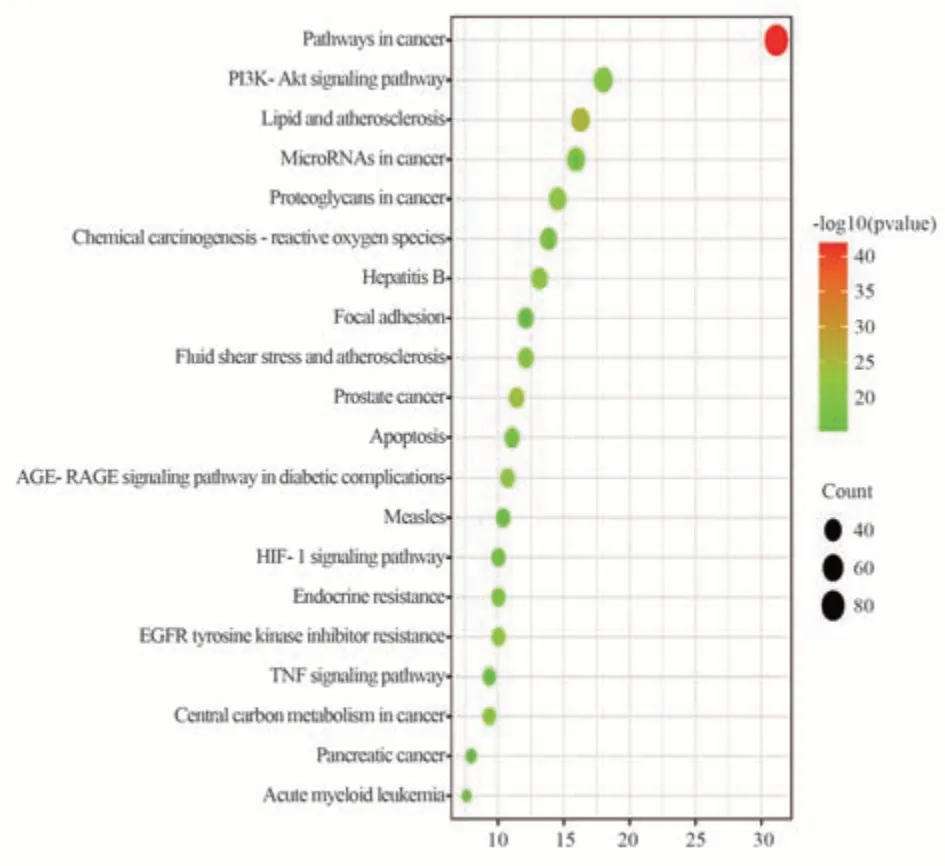
图5 胆木抗肝癌靶点KEGG 通路富集图Fig 5 KEGG pathway enrichment diagram of anti-HCC targets of Nauclea Officinalis
2.6 胆木抗肝癌“药物-成分-靶点-通路-疾病”相互作用网络构建
将相关信息导入Cytoscape3.9.1 构建 “药物-成分-靶点-通路-疾病”相互作用网络,该网络由99 个节点和406 条边构成,见图6,经分析后,活性成分按照自由度值进行排序,见表3。网络中胆木可通过多成分作用于多靶点、调控多条信号通路,发挥抗肝癌的作用特点。
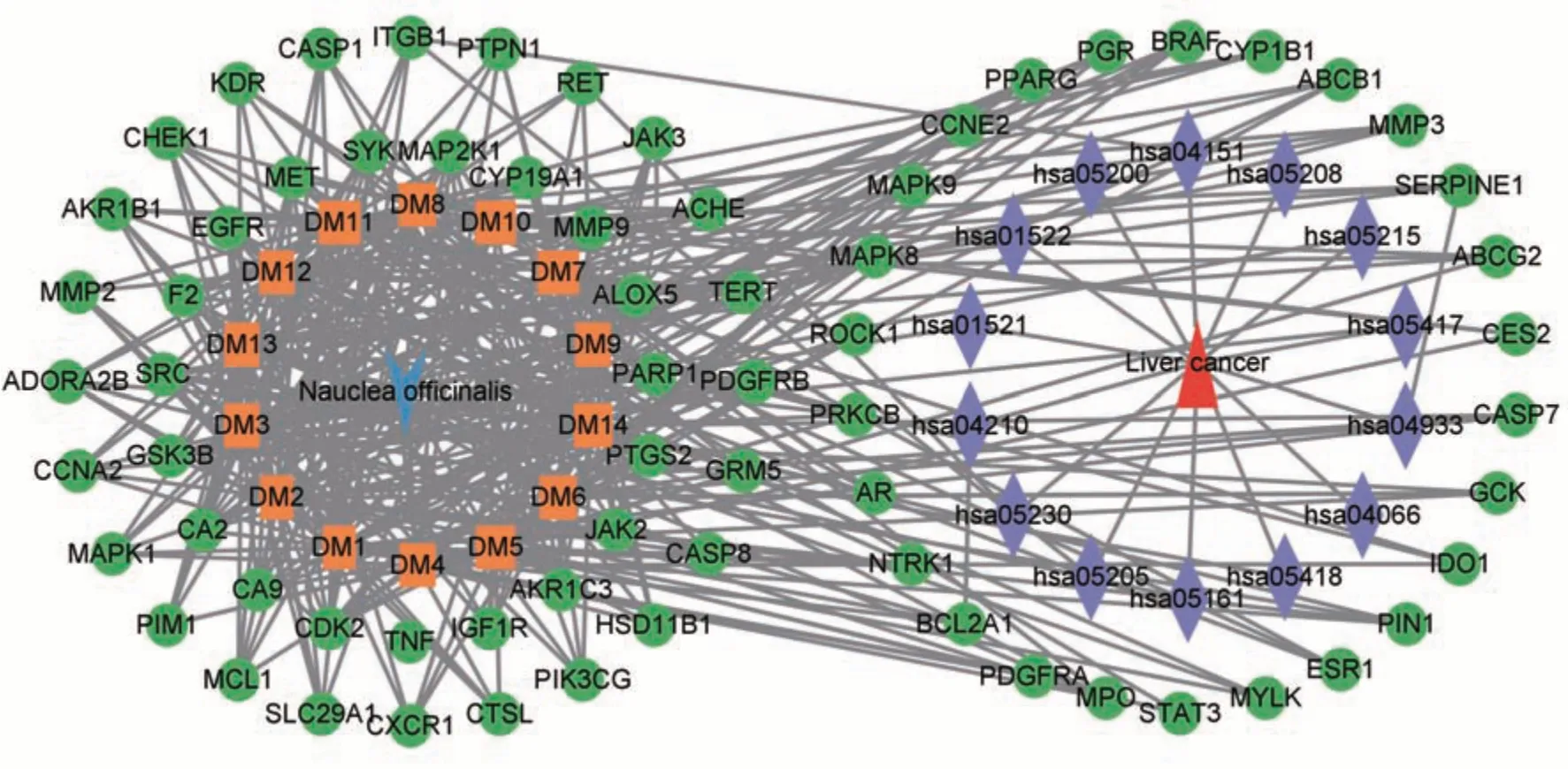
图6 胆木-成分-通路-疾病-靶点网络图Fig 6 Network diagram of Nauclea Officinalis-ingredient-pathway-HCC-target
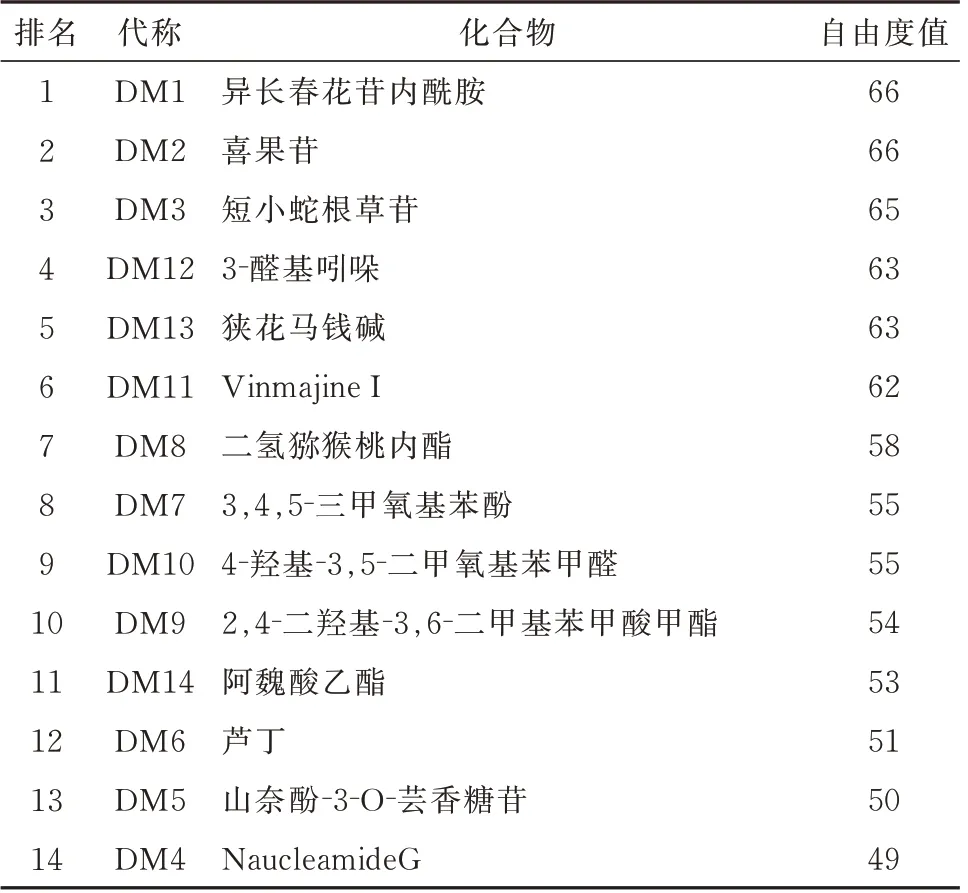
表3 胆木-活性成分-抗肝癌靶点网络自由度值排名Tab 3 Ranking of degree value of drug-active ingredientanti-HCC target network of Nauclea Officinalis
2.7 胆木活性成分与核心靶点的分子对接
将活性成分和核心靶点导入DiscoveryStudio2019Client 软件,再加水、去氢等处理后,进行分子对接验证,当LibDockScore 大于105 分,认为该成分与靶标具有较好的结合活性[17],取排名靠前的有效活性成分与核心靶点TP53、SRC、STAT3、HSP90AA1、PIK3R1、MAPK3 进行对接验证,发现其中TP53、HSP90AA1、PIK3R1 与异长春花苷内酰胺、喜果苷、短小蛇根草苷结合能力差。核心靶点SRC、STAT3、MAPK3 与排名靠前的有效化合物的LibDockScore 均高于105 分,说明胆木中的关键成分与核心靶点SRC、STAT3、MAPK3 具有较好的亲和性,能发生相互作用。活性成分与核心靶点的对接分数较高的结果见表4,分子对接可视化见图7~9。
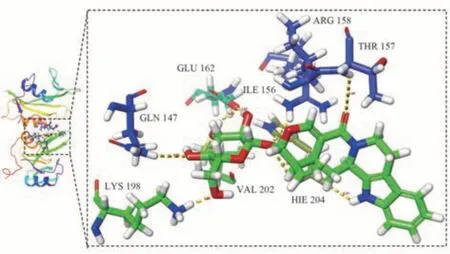
图7 喜果苷与SRC 靶点的分子对接图Fig 7 Molecular docking diagram of vincosamide and SRC target
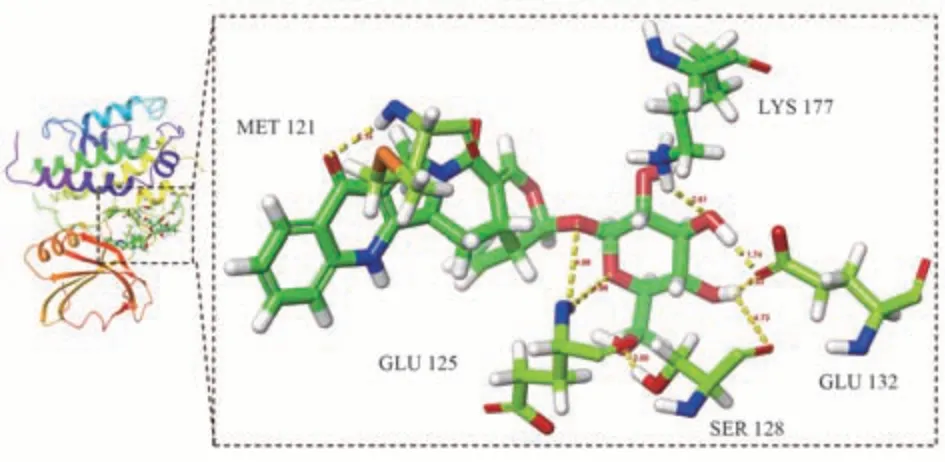
图8 短小蛇根草苷与MAPK3 靶点分子对接图Fig 8 Molecular docking diagram of pumiloside andMAPK3 target
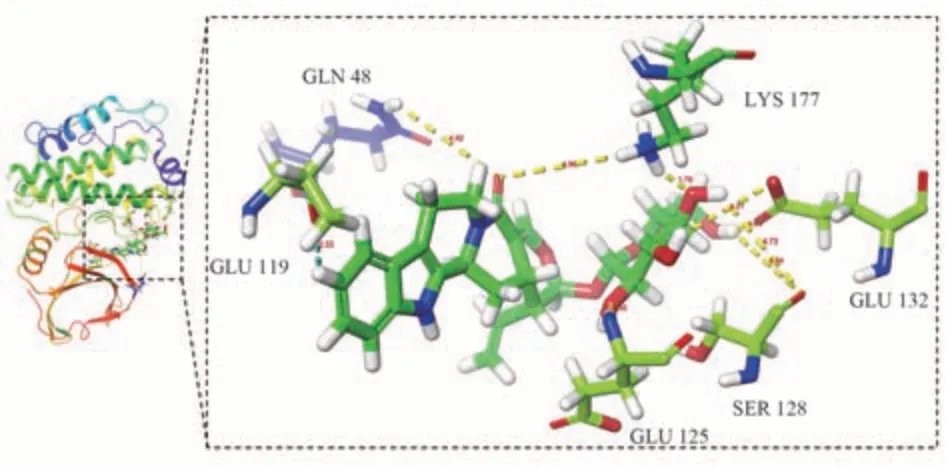
图9 异长春花苷内酰胺与MAPK3 靶点分子对接图Fig 9 Molecular docking diagram of strictosamide and MAPK3 target
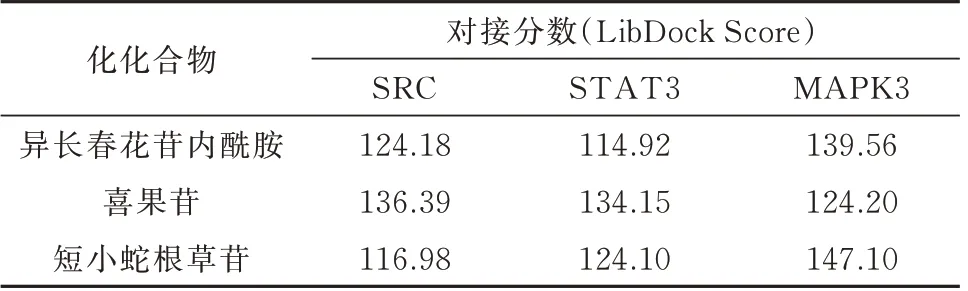
表4 分子对接结果Tab 4 The results of molecular docking.
2.8 体外细胞CCK8 实验结果
结合网络药理学结果,选择胆木中主要活性成分异长春苷内酰胺进行验证。如图10 所示,浓度为40~160 μmol/L 的异长春花苷内酰胺对LX-2 正常肝细胞生长无抑制作用(P>0.05)。但是图11 结果显示,分别在80~160 μmol/L 浓度作用12 h 后,异长春花苷内酰胺对于HepG2 细胞表现出了显著的抑制细胞生长的活性(P<0.001)。因此,异长春花苷内酰胺对肝癌HepG2 具有细胞毒性,可抑制肝癌细胞增殖生长,但是对正常LX-2 肝细胞无明显作用。
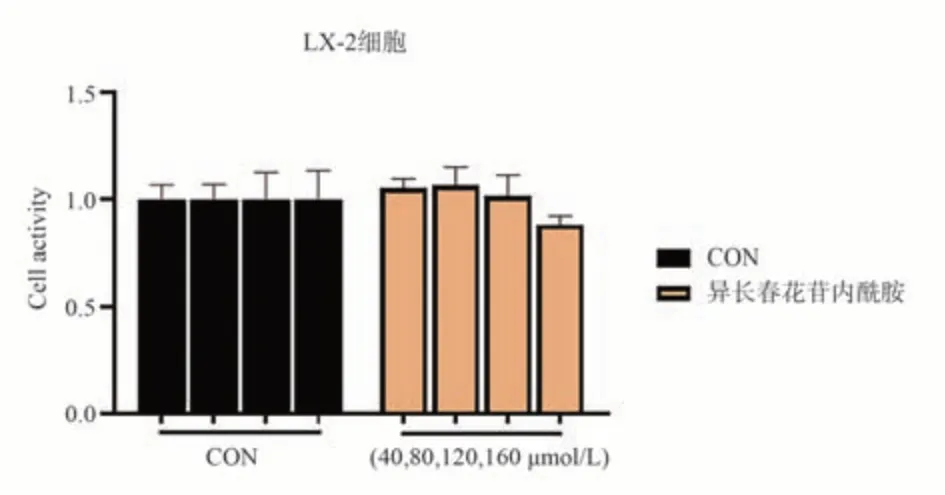
图10 异长春花苷内酰胺对LX-2 细胞毒性影响Fig 10 Effect of strictosamide lactam on cytotoxicity of LX-2 cells
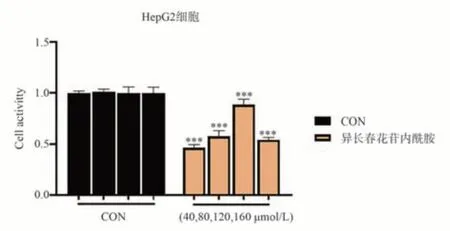
图11 异长春花苷内酰胺对HepG2 细胞毒性影响Fig 11 Effect of strictosamide lactam on cytotoxicity of HepG2 cells
2.9 药物对肿瘤细胞凋亡的影响
不同浓度异长春花苷内酰胺(0、40、80、120、160 μmol/L)处理人肝癌HepG2 细胞12 h 后,采用流式细胞术检测其对细胞凋亡的影响。图12 左下象限代表正常细胞,右上象限代表晚期凋亡细胞。与对照组相比,0、40、80、120、160 μmol/L 组中凋亡细胞明显增多,正常细胞明显减少。凋亡率分别为15.99%、24.49%、29.16%、36.12%、49.11%(表5)。与对照组相比,随浓度增加人肝癌HepG2 细胞凋亡率明显上升(P<0.001)。

图12 不同浓度异长春花苷内酰胺溶液对细胞凋亡的影响Fig 12 Effect of different concentrations of strictosamide solution on cell apoptosis
表5 不同浓度异长春花苷内酰胺溶液对细胞凋亡率的影响(n=3,±s)Tab 5 Effect of different concentrations of strictosamide on cell apoptosis rate(n=3,±s)
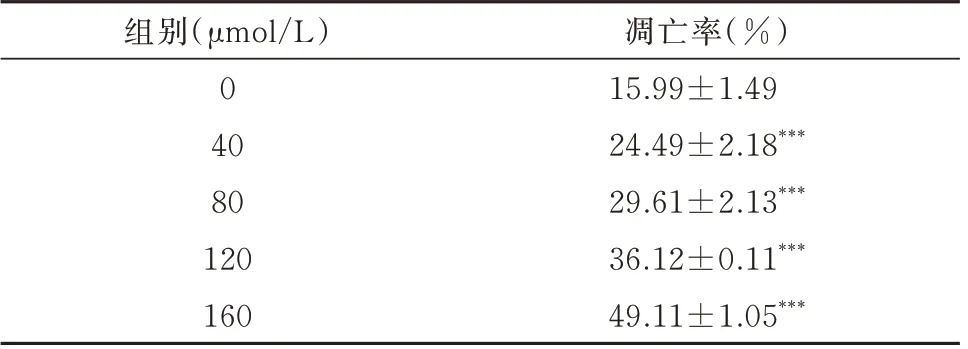
表5 不同浓度异长春花苷内酰胺溶液对细胞凋亡率的影响(n=3,±s)Tab 5 Effect of different concentrations of strictosamide on cell apoptosis rate(n=3,±s)
注:与空白组相比,***P<0.001。
凋亡率(%)15.99±1.49 24.49±2.18***29.61±2.13***36.12±0.11***49.11±1.05***组别(μmol/L)0 40 80 120 160
2.10 药物抑制核心靶点mRNA 的表达
qRT-PCR 检测不同浓度异长春花苷内酰胺(0、40、80、120 μmol/L)作用HepG2 细胞12 h 后,TP53、SRC、STAT3、MAPK3 mRNA 的表达情况。如表6 结果所示,随着高异长春花苷内酰胺的升高,HepG2 细胞中SRC、STAT3、MAPK3 mRNA 的表达下降(P<0.05,P<0.05,P<0.05)。这些数据表明,异长春花苷内酰胺可以下调HepG2 细胞中SRC、STAT3、MAPK3 mRNA 的表达水平。
表6 异长春花苷内酰胺对肝癌HepG2 细胞核心蛋白 mRNA 表达的影响(n=3,±s)Tab 6 Effect of strictosamide on core protein mRNA expression in hepatocellular carcinoma HepG2 cells(n=3,±s)
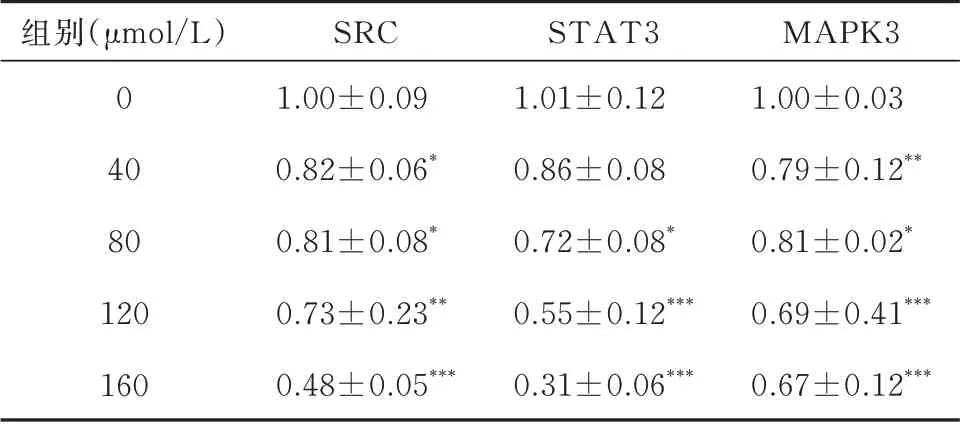
表6 异长春花苷内酰胺对肝癌HepG2 细胞核心蛋白 mRNA 表达的影响(n=3,±s)Tab 6 Effect of strictosamide on core protein mRNA expression in hepatocellular carcinoma HepG2 cells(n=3,±s)
注:与空白组相比,*P<0.05, **P<0.01, ***P<0.001。
组别(μmol/L)0 40 80 120 160 MAPK3 1.00±0.03 0.79±0.12**0.81±0.02*0.69±0.41***0.67±0.12***SRC 1.00±0.09 0.82±0.06*0.81±0.08*0.73±0.23**0.48±0.05***STAT3 1.01±0.12 0.86±0.08 0.72±0.08*0.55±0.12***0.31±0.06***
3 讨论
肝癌是指发生在肝脏的恶性肿瘤,其预防和治疗仍然是主要的临床挑战。对于晚期不能切除的肝癌,药物治疗是主要治疗策略。生物碱类化合物是胆木主要化学成分,是目前临床抗肿瘤研究的关注点之一。本研究通过网络药理学预测胆木抗肝癌的可能活性成分及作用机制,并通过体外细胞实验进行验证其抗肝癌活性。
在胆木的14 种活性成分中,预测潜在活性成分生物碱类化合物异长春花苷内酰胺、喜果苷、短小蛇根草苷抗肝癌对应靶点最多,且在“药物-成分-靶点-通路-疾病”网络中自由度值排名前3。将这3 种化学成分与胆木抗肝癌的关键靶点TP53、SRC、STAT3、MAPK3 进行分子对接,其中SRC、STAT3、MAPK3 靶点对接分数都大于105 分,提示结合活性好。利用体外细胞实验验证,表明胆木中主要成分异长春花苷内酰胺能显著抑制肝癌HepG2 细胞增殖(P<0.001)。相关研究发现,生物碱类化合物可以通过抑制端粒酶活性、减少肝癌扩散、诱导肝癌细胞分化和凋亡、抑制肝癌细胞周期和增殖来发挥抗肝癌作用[18-20]。
PPI 网络显示黎药胆木抗肝癌作用的核心靶点有TP53、SRC、STAT3、MAPK3 等。TP53 是一种肿瘤抑制基因,抑制其TP53 基因突变和表达的肝癌患者预后较好[21,22]。且TP53 可调节癌细胞衰老和凋亡[23]。SRC 为首个发现的原癌基因,影响细胞增殖、迁移、侵袭及血管形成等过程,当SRC 表达下调时,肝癌疾病进展受到抑制[24-26]。Seo 等[27]研究表明咖啡豆醇能通过抑制SRC 的磷酸化,以及抑制pmTOR 和p-STAT3 来诱导肝癌细胞凋亡。在肿瘤生态系统中,STAT3 在癌细胞和非癌细胞中广泛的过度激活,在对抗肿瘤免疫反应的调节发挥关键作用,当STAT3 磷酸化增加会促进肝脏肿瘤的发生[28,29]。研究表明,当MAPK3 过表达时,肝癌细胞的增殖速率、迁移能力随之加快[30]。而下调MAPK3 后,细胞内凋亡相关基因表达显著增加[31]。因此,抑制SRC、STAT3、MAPK3 的表达,可能促进肝癌细胞凋亡。本研究发现异长春花苷内酰胺可下调肝癌HepG2 细胞SRC、STAT3、MAPK3 mRNA 的表达(P<0.05),并诱导肝癌细胞凋亡(P<0.001)。
GO 富集显示共有靶点在蛋白质磷酸化、凋亡过程的负调控等过程富集。已有研究表明,中药能通过调节蛋白质磷酸化水平促进凋亡等方式发挥抗肿瘤作用[32]。核心靶点MAPK3 也是一种蛋白激酶,磷酸化活化STAT3,促进肝脏肿瘤的发生[29,33]。因此,影响蛋白质磷酸化过程参与细胞凋亡可能与胆木抑制MAPK3 表达,发挥抗肝癌作用密切相关。KEGG 通路显示,在癌症通路和EGFR 受体酪氨酸激酶抑制剂抵抗和PI3K-Akt 信号通路中共有靶点富集较多,提示其可能是胆木抗肝癌潜在通路。癌症通路,是由NF-κB、MAPK、JAK-STAT 等多条通路汇集而成,其中核心靶点MAPK3 在MAPK 信号通路上,这一通路中相关蛋白质磷酸化水平的变化与肝癌的发生发展密切相关[30]。核心靶点STAT3、SRC 等基因参与了调节EGFR 受体酪氨酸激酶抑制剂抵抗通路。肝癌细胞通过激活这一通路途径,促进该轴上EGFR、STAT3、SRC 靶点的表达,获得对一线抗癌药仑伐替尼的耐药性[34,35]。此外,研究表明 PI3K-Akt 信号通路被激活时,促进肝癌细胞增殖、迁移和侵袭,加快疾病进程[36]。植物素可通过抑制PI3K/Akt 信号通路进而转导PI3K/Akt 的表达,限制肝细胞癌进展[37]。结合RTPCR 结果,胆木中异长春花苷内酰胺可抑制SRC、STAT3、MAPK3 基因的表达,初步显示出胆木可通过作用于SRC、STAT3、MAPK3 等靶点调节多条通路,发挥抗肝癌作用。
综上所述,胆木可能的抗肝癌机制为:胆木中活性成分异长春花苷内酰胺、短小蛇根草苷、喜果苷等多种活性物质通过SRC、STAT3、MAPK3 等靶点作用于肝癌,通过调节癌症通路、PI3K/Akt 和EGFR 酪氨酸激酶抑制剂抵抗等多重信号通路最终干预肝癌的发生发展。体外细胞实验进一步验证胆木对肝癌有显著抑增殖作用、并且可下调SRC、STAT3、MAPK3 基因表达,促进癌细胞凋亡。本研究为胆木抗肝癌机制研究奠定方向和提供思路,但鉴于网络药理学及细胞实验初步验证的局限性,胆木抗肝癌的功效及其作用机制仍需进一步研究。
作者贡献度说明:
陈维佳:细胞实验、收集数据并撰写论文;徐剑:负责文章构思和审核;其余作者参与文章润色和格式校正。
所有作者声明不存在利益冲突关系。

