基线BMI与免疫检查点抑制剂治疗晚期非小细胞肺癌疗效的关系
闫 焱,焦碧航,周 昆,高 群,陈新峰,岳冬丽,张丽敏
1)郑州大学第一附属医院肿瘤内科 郑州 450052 2)郑州大学第一附属医院胸外科 郑州 450052 3)郑州大学第一附属医院生物治疗中心 郑州 450052
肺癌是世界范围内第二常见的恶性肿瘤,有着较高的远处转移率,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的病理类型[1]。程序性死亡受体1(programmed death protein 1,PD-1)是一种位于T细胞表面的重要免疫抑制分子,与肿瘤细胞上表达的程序性死亡受体配体1(programmed death-ligand 1,PD-L1)结合后抑制T细胞的抗肿瘤细胞毒性,导致人体对肿瘤细胞免疫耐受。免疫检查点抑制剂(immune checkpoint inhibitor,ICI)通过阻断PD-1/PD-L1相互作用,可以恢复T细胞对肿瘤细胞的免疫应答。近年来,ICI单药或与化疗、抗血管生成药物联合应用已经在转移性NSCLC中展示出良好的抗肿瘤活性[2-3]。筛选优势人群是肿瘤免疫治疗获益的前提和关键。
近几十年来,超重或肥胖人口比例逐步上升。肥胖是一种慢性炎症状态[4]。较高的BMI被认为是癌症的危险因素,与一些肿瘤较差的预后有关[5]。然而,有研究[6-8]表明超重或肥胖患者有更好的免疫治疗反应。目前关于肿瘤患者BMI与ICI疗效关系的研究集中于欧美人群,且大多为免疫单药研究。本研究回顾性分析193例ICI治疗的晚期NSCLC患者的临床资料,评估免疫治疗开始前(基线)BMI水平(超重/肥胖或非超重)对NSCLC患者疗效和安全性的影响。
1 对象与方法
1.1 研究对象选择2019年1月至2021年5月郑州大学第一附属医肿瘤内科收治的Ⅳ期NSCLC患者193例。纳入标准:①经病理组织学或细胞学证实为Ⅳ期NSCLC。②至少具有1个未经局部治疗的符合实体瘤疗效评估(response evaluation in solid tumors,RECIST)1.1标准[9]的可测量病灶,有完善的影像学检查结果。③接受基于ICI的治疗(PD-1抑制剂±化疗±抗血管生成靶向治疗),包括一线治疗及后续治疗。④完成 1个疗程及以上治疗。排除标准:①既往曾接受过抗肿瘤免疫治疗。②接受基于ICI的治疗同时联合应用放疗或介入、消融等局部治疗。③临床和随访资料不完整。
1.2 临床资料收集患者一般资料,包括性别、年龄、吸烟史、基线身高和体重、疾病分期、病理类型、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分[10]、ICI治疗线数、PD-L1表达情况,治疗方案、治疗开始日期、治疗最佳反应。
1.3 基线BMI根据免疫治疗开始前体重和身高计算基线BMI。根据基线BMI,将患者分为超重/肥胖组(BMI≥25.0 kg/m2)64例和非超重组(BMI<25.0 kg/m2)129例。
1.4 观察指标治疗开始后每2个周期(6周)行CT或MRI等影像学检查,依据RECIST 1.1标准评价疗效,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progression disease,PD)。主要观察指标为总生存期(overall survival,OS);次要观察指标包括客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、无进展生存期(progression-free survival,PFS)以及免疫相关不良事件(immune-related Adverse Event,irAE)。ORR为自接受治疗第1天到疾病进展的整个研究过程中观察到的最佳疗效为CR或PR的患者的比例。PFS为从免疫治疗开始至疾病进展或死亡的时间,以先发生者为准。OS为从免疫治疗开始至因任何原因引起死亡或生存患者的最后一次随访的时间。irAE根据不良事件通用术语标准(common terminology criteria for adverse events,CTCAE)5.0分级并记录。
1.5 随访采取电话、信件、门诊及住院复查等形式进行随访,随访截至2022年3月。主要终点事件是因任何原因引起的死亡;次要终点事件为肺癌疾病进展及irAE的发生,irAE包括免疫相关内分泌毒性、胃肠道毒性、皮肤毒性、肝毒性、肺毒性、血液毒性、心脏毒性、反应性皮肤毛细血管增生症以及输液相关反应。
1.6 统计学处理采用SPSS 26.0分析。超重/肥胖组和非超重组基线临床特征、ORR、DCR以及irAE发生率的比较采用χ2检验;应用Kaplan-Meier法绘制生存曲线,采用Log-rank检验比较两组PFS和OS生存曲线的差异;应用Cox回归分析OS的影响因素,检验水准α=0.05。
2 结果
2.1 超重/肥胖组和非超重组基线临床特征的比较两组临床特征的比较见表1。两组性别、病理类型、ECOG PS评分、吸烟史、PD-L1表达、ICI治疗线数以及治疗方案差异均无统计学意义。
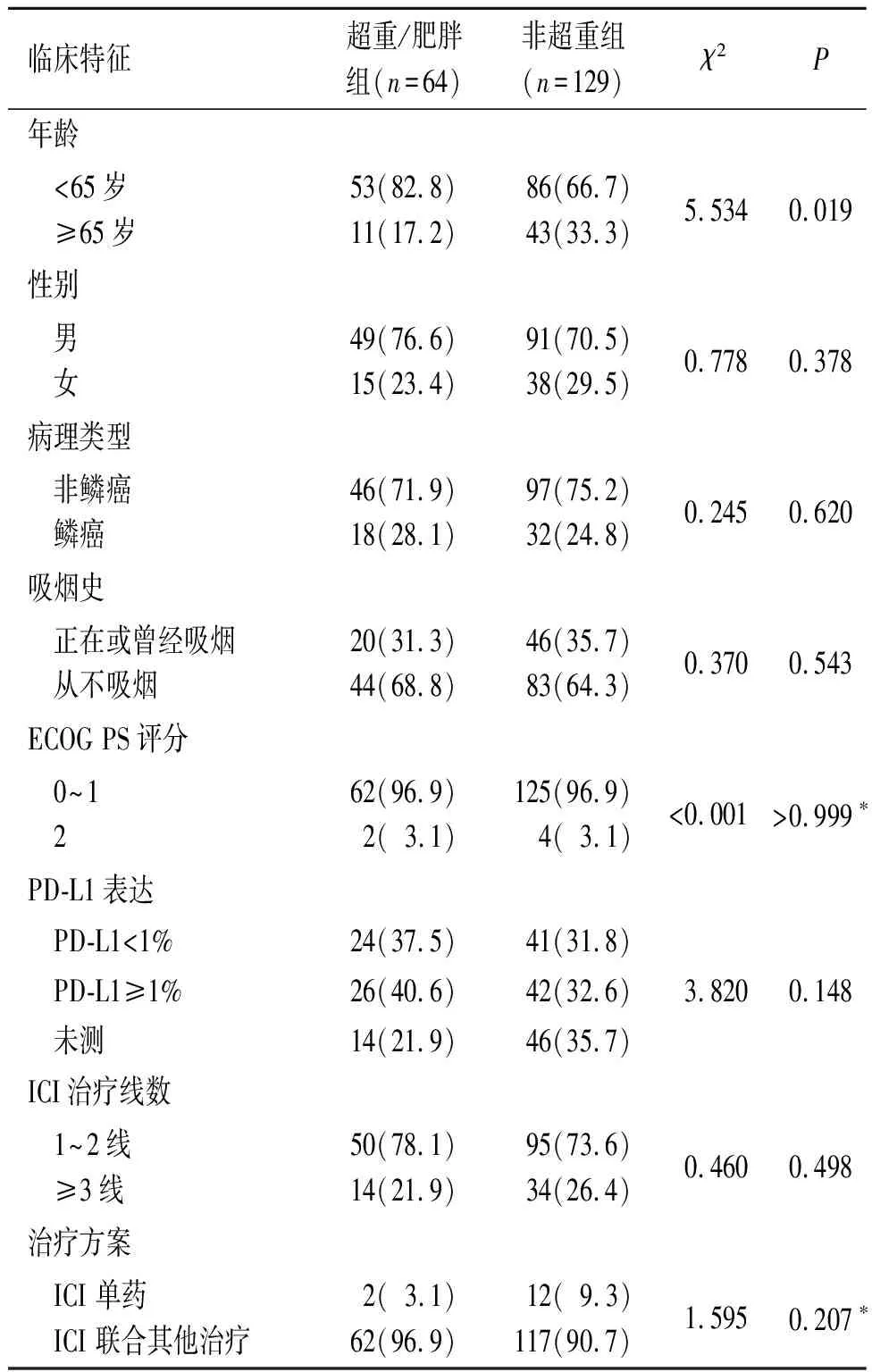
表1 两组临床特征的比较 例(%)
2.2 超重/肥胖组和非超重组疗效比较见表2。两组均没有CR。两组ORR差异无统计学意义;而超重/肥胖组DCR高于非超重组。63例患者(32.6%)经历了任意级别的irAE,16例为G3/G4 irAE。超重/肥胖患者和非超重组任意级别irAE和G3/G4 irAE的发生率差异均无统计学意义(表3)。
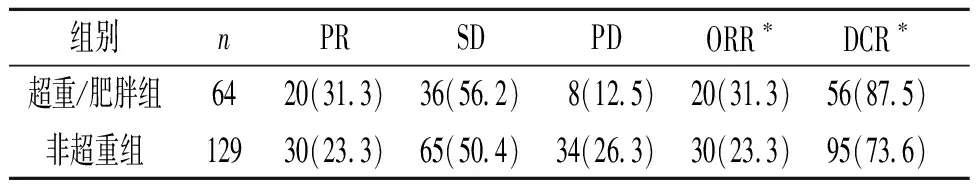
表2 超重/肥胖组和非超重组疗效比较 例(%)
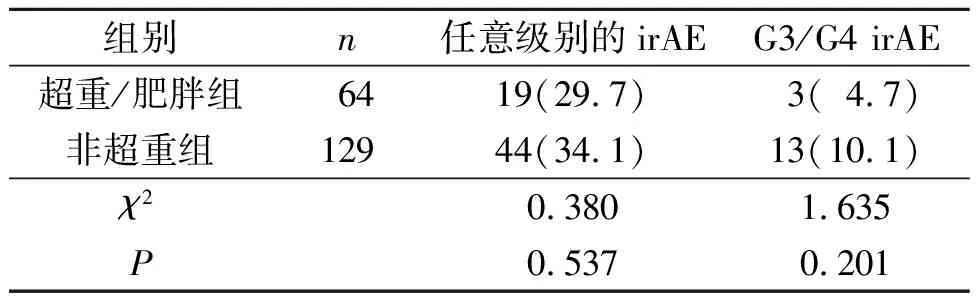
表3 两组任意级别irAE和G3/G4 irAE发生率的比较 例(%)
2.3 超重/肥胖组及非超重组生存分析结果见图1。患者随访1.45~38.77个月。超重/肥胖组和非超重组PFS生存曲线比较,差异无统计学意义(χ2=3.210,P=0.073)。超重/肥胖组和非超重组OS生存曲线比较,差异有统计学意义(χ2=5.076,P=0.024)。
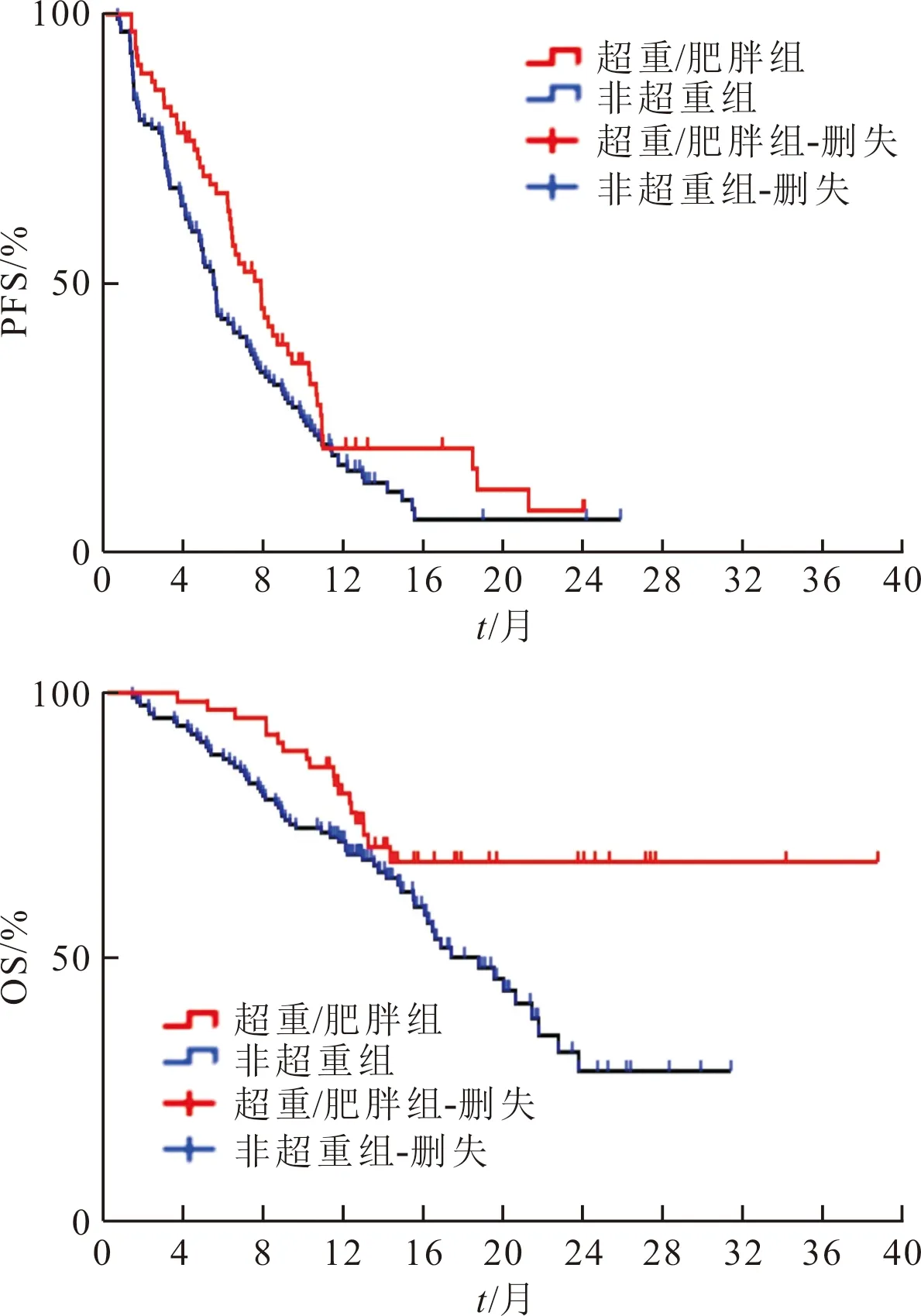
图1 两组PFS及OS生存曲线
2.4 OS影响因素的Cox回归分析对OS影响的单因素Cox回归分析结果见表4,多因素Cox回归分析结果见表5,基线BMI是OS的影响因素。
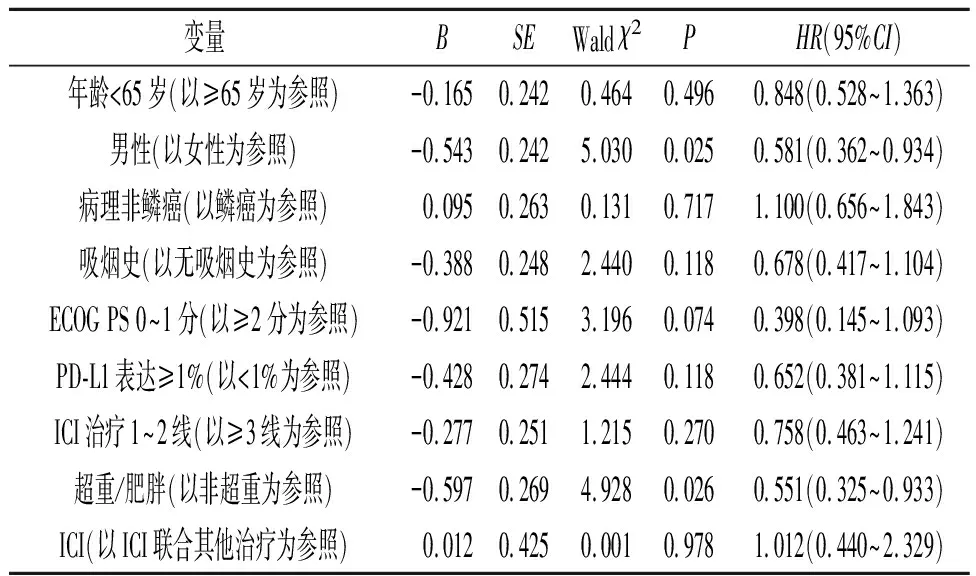
表4 OS影响因素的单因素Cox分析结果
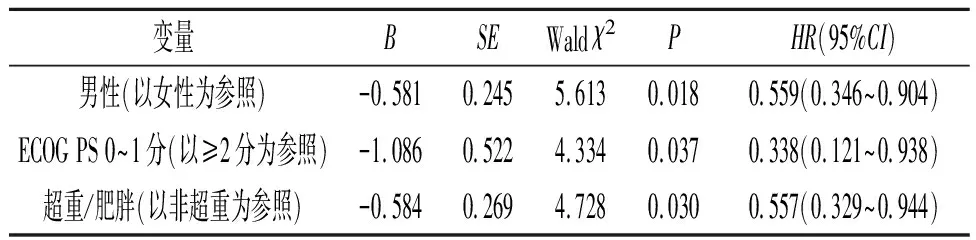
表5 OS影响因素的多因素Cox分析结果
3 讨论
年龄、吸烟史、BMI、转移部位等可能是免疫治疗潜在的疗效预测因素。有研究[6]发现接受阿替利珠单抗治疗的晚期NSCLC患者中,BMI和OS之间可能存在接近线性的关系。另一项针对一线单药派姆单抗治疗转移性NSCLC的研究[11]表明,BMI≥25.0 kg/m2与患者的ORR、PFS和OS改善有关。一项抗PD-1治疗NSCLC的研究[12]结果显示BMI仅与ORR以及DCR相关。而在另一项针对一线治疗队列的回顾性研究[13]中并未观察到BMI与NSCLC患者预后的相关性。有研究[14]表明对于晚期恶性黑色素瘤,BMI与接受靶向或免疫治疗患者的生存预后相关,而与化疗患者的预后无关。两项关于NSCLC的大型研究[6,11]表明,在接受ICI治疗的患者中,BMI和OS呈正相关,但在接受化疗的对照组患者中,肥胖与OS改善无关。
一项针对晚期NSCLC患者一线ICI联合化疗疗效的研究[7]结果显示高BMI组(BMI≥23.2 kg/m2)的PFS和OS较低BMI组(BMI<23.2 kg/m2)显著延长,但研究仅纳入了肺鳞癌患者。本研究纳入了肺鳞癌和非鳞癌患者,治疗方案绝大部分为ICI联合化疗或抗血管生成治疗,更符合当前真实世界的临床实践,结果发现超重/肥胖组ICI疗效及OS均优于非超重组,提示对ICI联合化疗或抗血管生成治疗为主导的NSCLC治疗模式,肥胖患者可能是优势人群。
本研究结果显示32.6%的患者经历了任意级别irAE,其中25.4%为G3/G4 irAE,这与以往的研究结果[15-16]一致。有研究[17]表明肥胖与人群中较高的自身免疫性疾病以及炎症性疾病的发生率有关。既往研究[18]发现肥胖会增加irAE的发生风险。
肥胖可引起全身炎症和免疫反应受损[4]。脂肪组织可通过分泌脂联素或瘦素等细胞因子,影响肿瘤微环境[19]。在超重患者中,瘦素诱导的JAK/STAT通路激活也可导致肿瘤细胞PD-L1的表达上调[20]。目前关于BMI影响免疫治疗的机制还处于探索阶段,未来需要进一步深入研究。
总之,本研究结果表明基线BMI与NSCLC患者对ICI治疗的反应有关,BMI≥25.0 kg/m2的患者DCR更高,总存活时间更长,相对死亡风险降低。考虑到这项研究为回顾性研究且来自单中心,样本量较小,缺乏来自未接受 ICI治疗的NSCLC患者的数据,因此对结果的解释应该谨慎。

