艾司氯胺酮复合右美托咪定行无阿片麻醉对乳腺癌改良根治术患者术后恢复质量的影响
刘梦菲,何 龙,田丹丹,张 迪,许 颖,秦菲菲,艾艳秋
郑州大学第一附属医院麻醉与围术期医学部 郑州 450052
乳腺癌发病率呈现逐年升高的趋势,已成为全球最常见的恶性肿瘤[1]。目前乳腺癌的治疗仍以手术切除为主,其中改良根治术是最常见的手术方式[2]。乳腺癌患者绝大部分为女性,术后疼痛和恶心呕吐发生率较高,不利于术后康复,甚至延长住院时间。全身麻醉期间,阿片类药物作为强效镇痛药,具有抑制交感神经、稳定血流动力学的作用;然而也有许多副作用,如导致恶心呕吐、便秘、呼吸抑制及痛觉过敏等[3]。近年来,无阿片麻醉方案在全球麻醉实践中逐渐开展。无阿片麻醉是一种与催眠药、 N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体拮抗剂、局部麻醉药、抗炎药及α-2受体激动剂相关的多模式麻醉管理策略[4]。本研究拟采用艾司氯胺酮复合右美托咪定行无阿片麻醉,探究其对乳腺癌改良根治术患者术后恢复质量的影响。
1 对象与方法
1.1 研究对象选取2022年2月至6月于郑州大学第一附属医院行乳腺癌改良根治术的女性患者,排除长期服用阿片类或精神类药物,伴有严重心、肝、肾、肺等重要器官疾病,既往有麻醉药物过敏史,怀孕或哺乳期,以及难以配合完成数据采集者。本研究初始纳入患者90例,2例因手术类型改变被剔除,3例术后撤回知情同意退出试验,3例失访。最终纳入数据分析的患者共82例,年龄18~65岁,BMI 18.5~28.0 kg/m2,ASA 分级Ⅰ或Ⅱ级,其中无阿片类药物麻醉40例(OF组),阿片类药物麻醉42例(C组)。本研究经医院伦理委员会批准(批准号2021-KY-1242),患者或家属已签署知情同意书。
1.2 麻醉方法患者入手术室后开放静脉通路,常规监测心率(heart rate,HR)、平均动脉压(mean artery pressure,MAP)、脉搏氧饱和度(pulse blood oxygen saturation,SpO2)。OF组麻醉诱导前10 min输注右美托咪定(扬子江药业集团有限公司,国药准字H20183219)0.6 μg/kg,C组输注等体积的生理盐水。麻醉诱导:OF组静脉注射艾司氯胺酮(江苏恒瑞医药股份有限公司,国药准字H20193336)0.5 mg/kg,C组静脉注射阿芬太尼25~50 μg/kg。所有患者均给予咪达唑仑1~2 mg、丙泊酚2.0~2.5 mg/kg和顺式阿曲库铵0.15 mg/kg。喉罩置入后行机械通气,潮气量设置为6~8 mL/kg,呼吸频率为12次/min,术中根据呼气末二氧化碳分压调整参数,使之维持在4.665~5.985 kPa。麻醉维持:OF组术中持续泵注右美托咪定0.3 μg/(kg·h)和艾司氯胺酮0.25 mg/(kg·h),C组术中持续泵注瑞芬太尼0.10~0.25 μg/(kg·min),两组患者均复合吸入七氟醚0.8~1.5个肺泡最小有效浓度。术中结合患者生命体征调整吸入麻醉药浓度,维持MAP和HR波动幅度在基础值20%以内,间断追加顺式阿曲库铵2~4 mg维持适宜肌松。若出现一种或多种特定体征(血流动力学参数超过基线的20%、体动或面部痛苦表情),则给予抢救性镇痛,包括5~10 mL体积分数0.5%利多卡因局部浸润或加深麻醉。若抢救性镇痛后再次出现上述任一体征则视为镇痛不足,可以根据需要使用阿片类药物。手术结束前约30 min静脉注射氟比洛芬酯2 mg/kg和帕洛诺司琼0.25 mg,缝皮时停用麻醉维持药物,并给予阿托品0.01 mg/kg和新斯的明0.05 mg/kg拮抗残余肌松。离开手术室前连接静脉镇痛泵行患者自控静脉镇痛,药物配制为氢吗啡酮0.05 mg/kg、酮咯酸氨丁三醇180 mg加生理盐水稀释至100 mL,参数设置为背景剂量2 mL/h、自控剂量4 mL/次、锁定时间15 min。
1.3 观察指标①术前1 d和术后1 d行15项恢复质量评分量表(QoR-15)评分。QoR-15包括身体舒适度5项、情绪状态4项、自理能力2项、心理支持2项、疼痛2项,共15项主观参数,每项分值为0~10分,QoR-15总分为0~150分,分数越高代表状态越好。②手术时间、拔管时间和麻醉恢复室(PACU)停留时间。③术后2、6、12、24 h的数字化疼痛量表(NRS)评分和术后24 h氢吗啡酮消耗量。④围术期不良反应(心动过缓、恶心呕吐、头晕、口腔分泌物增多和呼吸抑制)发生情况。
1.4 统计学处理采用SPSS 21.0处理数据。采用两独立样本t检验比较两组年龄、BMI、手术时间及拔管时间,采用χ2检验比较ASA分级,采用Mann-WhineyU检验比较PACU停留时间,术前1 d和术后1 d QoR-15评分及其差值,以及术后24 h氢吗啡酮消耗量,采用广义估计方程比较不同时点NRS评分,采用χ2检验或确切概率法比较围术期不良反应发生率。检验水准α=0.05。
2 结果
2.1 两组患者一般情况比较见表1。两组患者年龄、BMI、ASA分级、手术时间差异均无统计学意义,具有可比性。OF组拔管时间和PACU停留时间较C组延长(P<0.05)。OF组术中血流动力学稳定,无一例需要抢救性镇痛或转为阿片类药物麻醉。
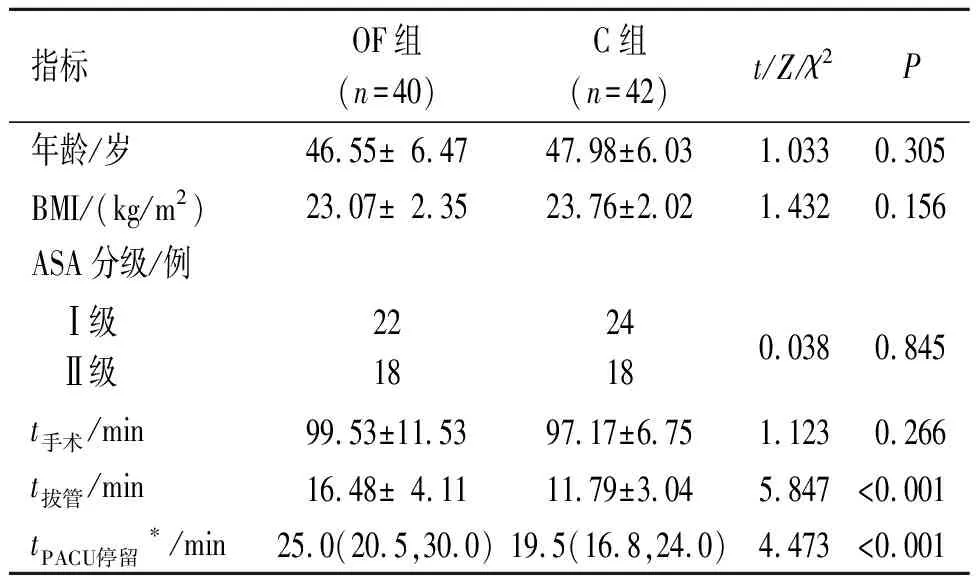
表1 两组患者一般情况比较
2.2 两组患者QoR-15评分比较两组患者术后1 d QoR-15评分均下降,OF组QoR-15评分下降幅度小于C组(P<0.05),见表2。
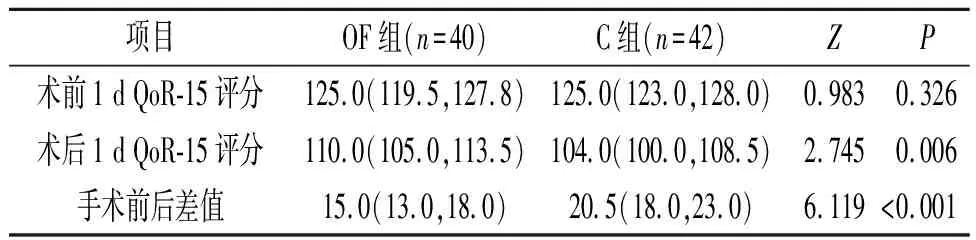
表2 两组患者QoR-15评分比较 分
2.3 两组患者不同时点NRS评分及术后24 h氢吗啡酮消耗量的比较两组患者不同时点NRS评分差异无统计学意义(表3)。OF组术后24 h氢吗啡酮消耗量[1.5(1.4,1.7) mg]低于C组[1.7(1.5,1.9) mg](Z=3.139,P=0.002)。

表3 两组患者不同时点NRS评分比较 分
2.4 两组围术期不良反应发生情况比较术后OF组恶心呕吐发生率低于C组,两组患者其余不良反应发生情况差异均无统计学意义,见表4。

表4 两组围术期不良反应发生情况比较 例(%)
3 讨论
最近一项meta分析[5]表明无阿片麻醉可在全麻期间提供良好的镇痛效果,同时减少术后阿片类药物的消耗和相关不良反应。现有研究对无阿片麻醉的定义各不相同,但利多卡因、氯胺酮和α-2受体激动剂(如可乐定或右美托咪定)已被建议单独或联合用于替代阿片类药物[4]。艾司氯胺酮是一种新型镇痛镇静药物,是氯胺酮的右旋结构,与NMDA受体的亲和力高于氯胺酮,其效价为氯胺酮的2倍,同时能够激活μ阿片受体,具有较强的镇痛作用,不良反应发生率低于氯胺酮,已被批准用于抗抑郁治疗[6]。右美托咪定具有内在的镇痛特性及镇静、抗焦虑和抗交感神经的作用,适合作为多模式无阿片麻醉的佐剂[7]。因此本研究使用艾司氯胺酮复合右美托咪定替代阿片类药物,理论上可满足全身麻醉期间的镇痛需求。本研究结果显示,OF组患者术中血流动力学稳定,无一例需要抢救性镇痛或转为阿片类药物麻醉。
随着乳腺癌整体诊疗水平的提升,人们的关注点逐步转移到患者术后早期恢复上。术后恢复是一个多维度、相互关联的复杂过程,与术后疼痛和身心舒适程度密切相关。QoR-15被用于评估患者的术后恢复情况,其有效性和可靠性在既往研究[8]中已得到证实。乳腺癌改良根治术各时段刺激强度不同,本研究术中结合患者血流动力学指标调整吸入七氟醚浓度,缝皮时停用七氟醚,术毕所有患者呼气末七氟醚浓度均为0%,避免了吸入麻醉药对研究结果的影响。本研究结果显示,行无阿片麻醉的患者术后1 d QoR-15评分下降幅度更小,表明无阿片麻醉可改善患者术后恢复质量,与Hakim等[9]的研究结果一致。可能是由于患者术中未使用任何阿片类药物,同时术后阿片类药物的消耗降低,有效减少了术后早期恶心呕吐的发生,提高了患者身体舒适度。
Guinot等[10]研究表明无阿片麻醉可减少术后阿片类药物的消耗。本研究两组患者术后24 h内各时点NRS评分差异无统计学意义,考虑到患者术后均使用静脉镇痛泵,在背景输注的基础上可自行按压,术后疼痛均控制在轻度水平,达到良好的镇痛效果。C组患者术后氢吗啡酮消耗量高于OF组,可能与术中持续输注瑞芬太尼易引起痛觉过敏有关。目前痛觉过敏的机制尚不明确,可能与NMDA受体参与的中枢谷氨酸能系统活性增强导致神经元敏化有关。因此使用NMDA受体拮抗剂如艾司氯胺酮在减少痛觉过敏上或许具有优势[11]。
既往Beloeil等[12]研究报道,行无阿片麻醉过程中较大剂量的右美托咪定可导致心动过缓的发生。但本研究中两组患者心动过缓发生率差异无统计学意义,可能与联合使用艾司氯胺酮导致中枢拟交感活性增加有关,还可能与右美托咪定的剂量较低有关。右美托咪定消除半衰期为2~3 h,持续输注会引起长时间镇静,可能导致患者拔管时间和PACU停留时间延长[13];但本研究中总体上延长时间有限,未给麻醉医生和PACU转运带来额外压力,因此临床意义不大。本研究随访时间较短,仅观察术后1 d恢复质量,关注患者远期预后是本课题组今后的研究方向。
综上所述,艾司氯胺酮复合右美托咪定行无阿片麻醉能够改善乳腺癌改良根治术患者术后恢复质量,减少术后阿片类药物消耗量及术后恶心呕吐的发生率。

