Meg3在全反式视黄酸诱发小鼠腭裂中的作用
刘小转,张军喜,余增丽,王国旭,何志东,宋帅星,李 雪
1)河南省人民医院临床医学研究中心 郑州 450003 2)国家卫生健康委员会出生缺陷预防重点实验室;河南省人口缺陷干预技术研究重点实验室 郑州 450002 3)郑州大学公共卫生学院营养与食品卫生学教研室 郑州 450001
腭裂是人类常见的颅面畸形[1]。研究[2]发现,维生素A对胚胎发育起着重要的调节作用。视黄酸是维生素A的生理活性形式,在实验研究中常应用全反式视黄酸(all-trans retinoic acid,atRA)。有文献[3]报道,药理浓度的atRA可影响胎鼠神经嵴细胞的增殖和迁移,诱发颌面部畸形,导致腭裂发生。
母系印迹基因3(maternally expressed gene 3,Meg3)是定位于染色体14q32.3的一个长链非编码RNA(long non-coding RNA,LncRNA)[4]。TGF-β作为一种转化生长因子,通过调控Smad信号通路,参与多种细胞上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程,在腭发育和融合过程中至关重要[5]。文献[6-8]报道,Meg3可直接激活TGF-β及其下游基因Smad2/3,参与TGF-β诱导的EMT、细胞增殖和分化,因此推测Meg3在胎鼠腭突发育过程中发挥了重要作用。
本研究采用atRA诱导建立胎鼠腭裂模型,观察腭发育过程中胎鼠腭突间充质细胞增殖和细胞中磷酸化Smad2(phospho-Smad2,p-Smad2)、Smad2、Smad4和Smad7表达情况,检测腭突组织中Meg3 mRNA的定位和表达,以及Meg3基因与Smad2蛋白结合情况,探讨Meg3在atRA诱发腭裂过程中的作用,为腭裂的预防提供思路。
1 材料与方法
1.1 主要试剂与仪器atRA(美国Sigma公司),BCA蛋白检测试剂盒(中国北京索莱宝公司),BrdU抗体、小鼠抗Smad2单克隆抗体、兔抗鼠p-Smad2单克隆抗体、小鼠抗Smad4单克隆抗体、小鼠抗Smad7单克隆抗体(美国Abcam公司),兔抗鼠IgG(美国Cell Signaling公司),荧光抗体IgG(美国Jackson公司),DAPI(瑞士Roche公司),磁珠(美国Thermo Fisher公司),荧光原位杂交(fluorescenceinsituhybridization,FISH)试剂盒(中国锐博公司),Power Up SYBR Green试剂盒(中国诺唯赞公司),Trizol(美国 Thermo公司)。低温高速台式离心机(德国Eppendorff公司),ChemiDocXRS+系统(美国Bio-Rad公司)。
1.2 动物模型的构建8~10周龄成年健康C56BL/6N近交系小鼠130只(雌鼠110只,雄鼠20只),来源于北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)016-0006。于晚上8:00按照雌雄比例2∶1合笼交配,第二天早上8:00检查雌鼠,有阴栓的雌鼠记录体重并分笼饲养,该时间记录为GD0;于GD10早上8:00再次对雌鼠称量体重,两次体重相差>2.0 g视为真性孕鼠。最终真性孕鼠90只,根据体重按照随机数字表随机分为atRA组和对照组,每组45只,分别给予100 mg/kg atRA和等体积的玉米油灌胃,1次/d。
1.3 标本制备两组孕鼠分别于GD13、GD14、GD15上午10:00颈椎脱臼处死(每组各时间点15只),其中拟行BrdU染色的孕鼠(每组各时间点5只)处死前2 h腹腔注射100 mg/kg BrdU。剖腹取胎鼠。切取胎鼠头部,多聚甲醛固定6 h,喙部朝下,常规包埋,冠状切片。分离双侧腭突,置于含1 U/mL中性蛋白酶消化液的青霉素瓶中,37 ℃恒温水浴箱中孵育15 min,手动轻振至腭突中嵴上皮与腭突间充质组织块分离并呈碎片状悬浮于液体中,用移液器吸去上皮碎片,将剩余组织和液体移至15 mL离心管中,室温1 000 r/min离心5 min,得胎鼠腭突间充质细胞。
1.4 胎鼠腭部组织学观察取GD13、GD14、GD15胎鼠头部冠状切片,经过逐级脱蜡、复水、HE染色、脱水、透明、封片,在光学显微镜下观察并拍照。
1.5 胎鼠腭突组织中腭突间充质细胞增殖的检测取GD13、GD14、GD15各5只胎鼠头部冠状切片,常规脱蜡至水,体积分数0.3%H2O2室温孵育10 min,正常羊血清孵育20 min,加BrdU抗体(1∶800)37 ℃孵育2 h,加 IgG荧光二抗(1∶300)37 ℃孵育 1 h,DAPI(1∶100) 37 ℃复染10 min。每只胎鼠随机取1张切片共5张,在荧光显微镜下,选择腭突间充质细胞固定区域统计细胞总数和BrdU阳性细胞数,计算BrdU阳性细胞率。
1.6 胎鼠腭突间充质细胞中Meg3的FISH法定位取GD14胎鼠(每组5只)头部冠状切片,经过标准脱蜡脱水后,加FISH试剂盒中的Meg3和18S探针(用Cy3标记,激发光555 nm,发射光570 nm;结果为红色荧光)混合物,37 ℃孵育过夜。用含甲酰胺的2×SSC洗3遍,加DAPI(1∶100,蓝色荧光) 37 ℃复染10 min,1×PBS洗涤后在共聚焦显微镜下成像。18S为阳性参照。
1.7 胎鼠腭突间充质细胞中Meg3 mRNA表达的检测取分离的GD14胎鼠腭突间充质细胞(每组3只),Trizol法提取总RNA并测定其含量,反转录得cDNA,适当稀释,按照Power Up SYBR Green试剂盒说明书操作,以β-actin作为内参,进行实时荧光定量PCR。采用2-ΔΔCt法计算Meg3 mRNA相对表达量。引物由尚亚生物技术有限公司设计并合成,引物序列见表1。
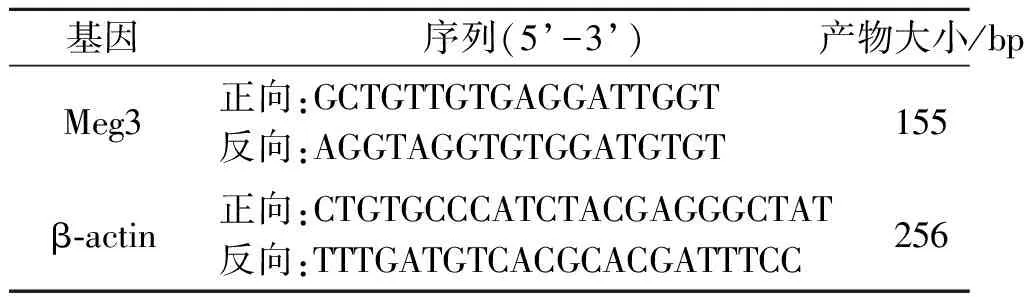
表1 PCR引物
1.8 胎鼠腭突间充质细胞中Smad通路蛋白表达的检测取分离的GD14胎鼠腭突间充质细胞(每组3只),加入裂解液,冰上裂解细胞,同时加入蛋白酶抑制剂和磷酸酶抑制剂,提取蛋白,用BCA蛋白试剂盒测定蛋白浓度,计算上样量,然后制胶、上样(50 μg/孔)、电泳、转膜,50 g/L脱脂奶37 ℃封闭2 h;加Smad2抗体(1∶2 000),p-Smad2、Smad4、Smad7、GAPDH抗体(均为1∶1 000)4 ℃孵育过夜,加IgG二抗(1∶5 000)37 ℃孵育1 h;用增强发光液(EpiZyme)显影,应用ChemiDocXRS+系统扫描,用Image J计算条带灰度值。以目的蛋白与内参GAPDH条带灰度值的比值表示目的蛋白的相对表达量。
1.9 胎鼠腭突间充质细胞中Meg3与Smad2蛋白结合情况的检测采用RNA结合蛋白免疫沉淀(RNA binding protein immunoprecipitation,RIP)实验检测。取分离的GD14胎鼠腭突间充质细胞(每组3只),加入裂解液,冰上裂解细胞;将每个样本的裂解混合液分成2份,分别加入Smad2抗体和IgG抗体(均为10 μg/mL)4 ℃孵育过夜,使用磁珠沉淀结合蛋白;用Trizol提取沉淀中的mRNA,然后检测Meg3 mRNA的表达,方法同1.7。
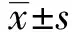
2 结果
2.1 两组胎鼠腭部发育情况的比较两组胎鼠腭突组织学表现见图1。GD13,两组胎鼠腭突均垂直生长,无明显区别。GD14,对照组胎鼠两侧腭突抬高、水平生长,向腭中线延伸,舌体下降;atRA组胎鼠双侧腭突抬高延迟,舌体下降不明显。GD15,对照组胎鼠两侧腭突互相接触,完全融合;atRA组胎鼠双侧腭突体积小,未融合,腭裂明显。
ps:腭突;t:舌体
2.2 两组胎鼠腭突间充质细胞增殖情况的比较两组胎鼠头部冠状切片BrdU染色结果见图2和表2。GD13和GD14,atRA组BrdU阳性细胞率均低于对照组;GD15,对照组无BrdU阳性细胞,atRA组BrdU阳性细胞率达(1.18±0.71)%。
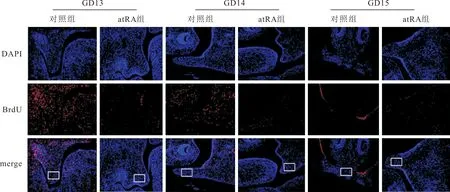
图2 两组GD13、CD14、GD15胎鼠腭突间充质细胞增殖情况(BrdU×200,白色方框为量化分析区域)
表2 两组GD13、GD14、GD15胎鼠BrdU阳性细胞率的比较 %
2.3 GD14胎鼠腭突间充质细胞中Meg3的定位和表达Meg3基因主要定位在GD14胎鼠腭突间充质细胞的细胞核,见图3。对照组、atRA组胎鼠腭突间充质细胞中Meg3 mRNA相对表达量分别为(1.00±0.14)、(1.73±0.09),atRA组高于对照组(t=7.310,P<0.001)。
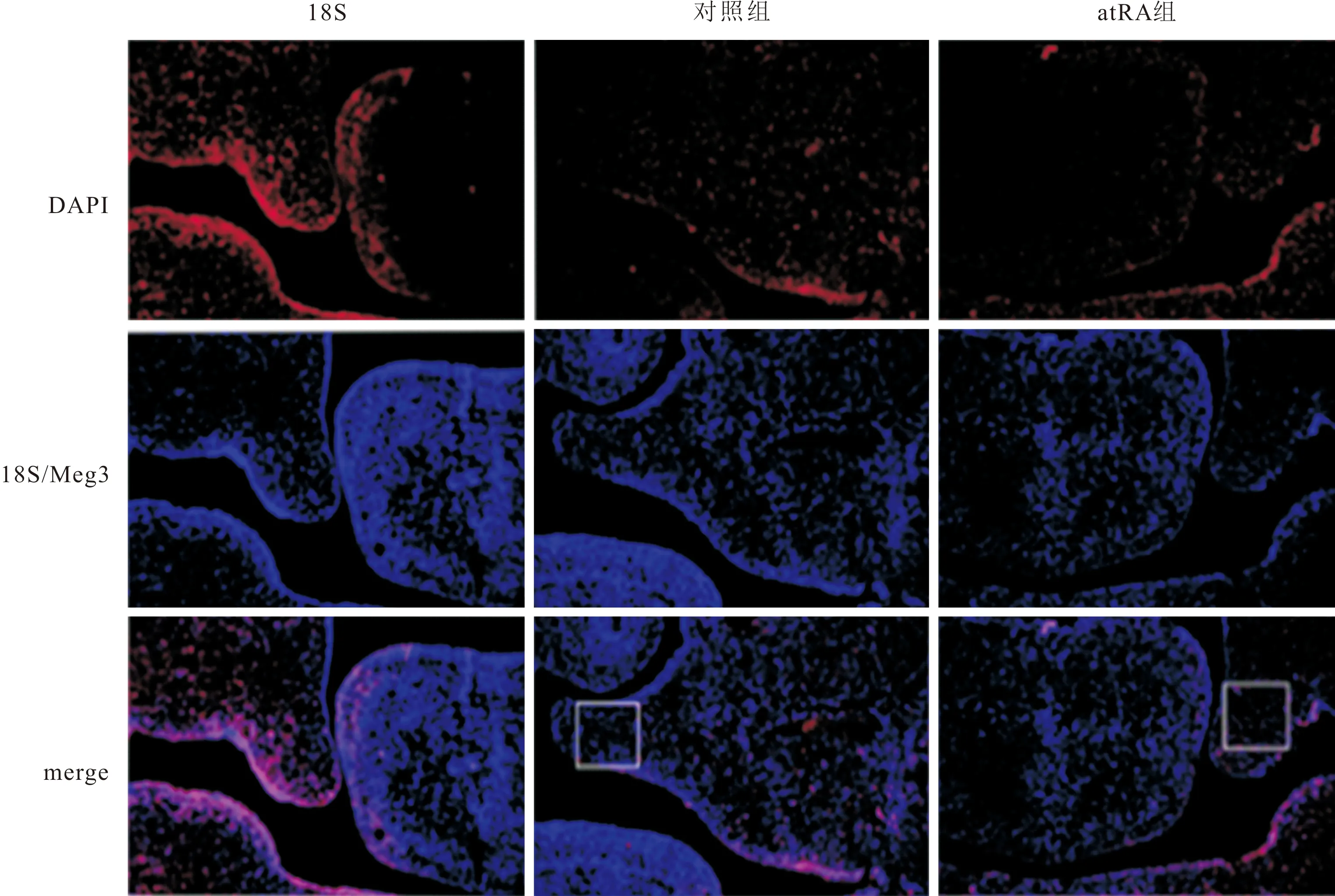
图3 GD14胎鼠腭突间充质细胞中Meg3的定位(FISH,×200)
2.4 两组GD14胎鼠腭突间充质细胞中Smad通路相关蛋白表达的比较见图4和表3。与对照组相比,atRA组GD14胎鼠腭突间充质细胞中p-Smad2和Smad4蛋白表达水平降低,Smad7蛋白表达水平增加,两组Smad2蛋白表达水平差异无统计学意义。
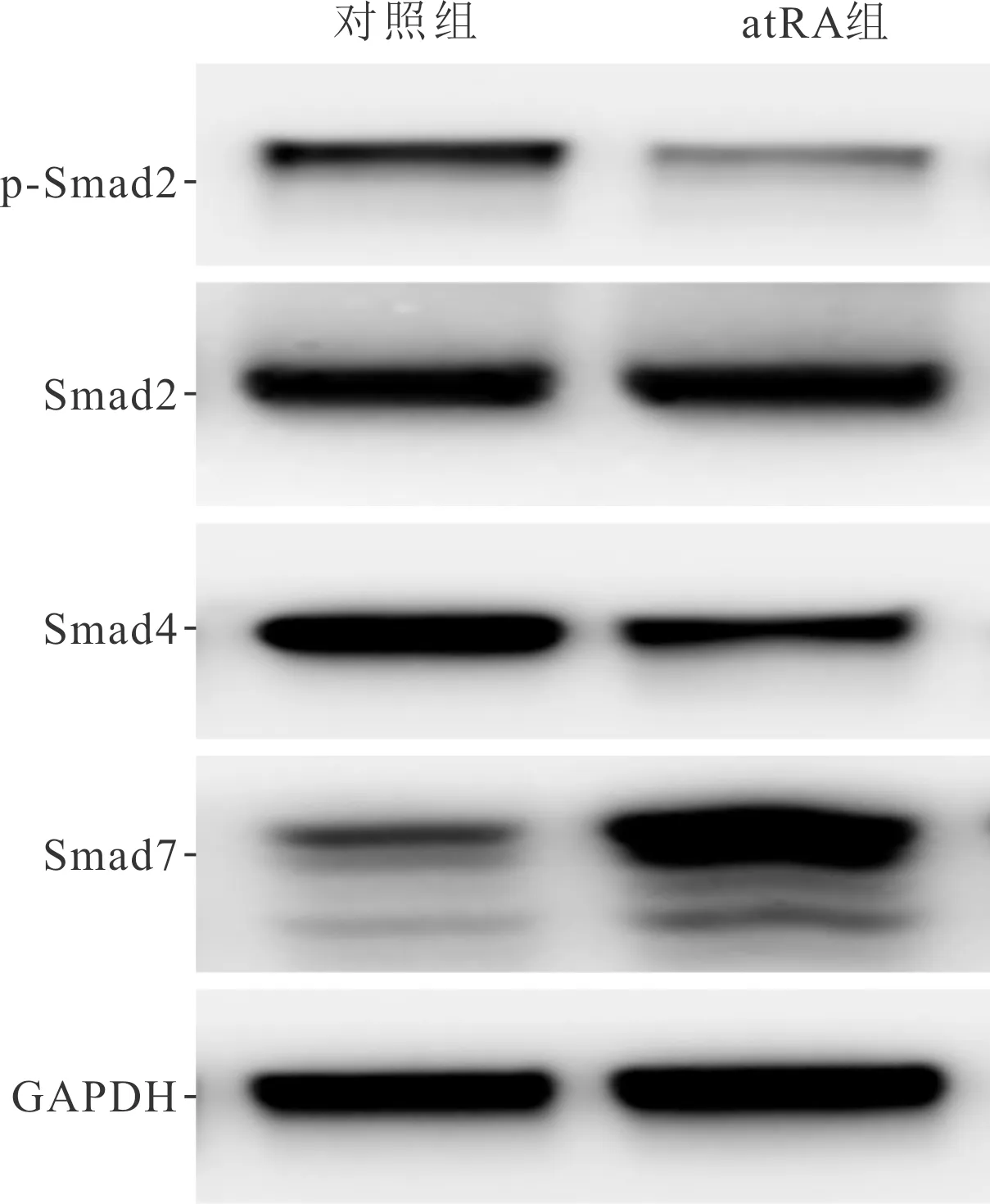
图4 两组GD14胎鼠腭突间充质细胞中Smad通路相关蛋白的表达

表3 两组GD14胎鼠腭突间充质细胞中Smad通路相关蛋白表达水平的比较
2.5 两组GD14胎鼠腭突间充质细胞中Meg3与Smad2蛋白结合情况的比较atRA组和对照组GD14胎鼠腭突间充质细胞中Meg3基因均与Smad2蛋白结合,富集的Meg3 mRNA相对表达量分别为(36.0±3.5)、(6.0±2.1),atRA组大于对照组(t=12.729,P<0.001)。
3 讨论
腭的发育过程中,主要通过基因调控网络介导细胞迁移、增殖、凋亡、分化以及细胞外基质分泌等,从而控制腭架的生长、升高和融合[9],任一环节失调都会导致腭突融合失败,从而导致腭裂。颅神经嵴来源的间充质细胞是腭突的主要组成细胞[10]。相关研究[11]发现,腭突抬高不足或发育迟缓与胚胎腭突间充质细胞的增殖抑制有关。atRA可以通过抑制胎鼠腭突间充质细胞增殖导致腭裂发生[12-14]。本研究HE染色结果再次证实atRA对腭突发育有影响,atRA组胎鼠在腭突生长关键期GD14和GD15[15]腭突抬高延迟,未能完全接触融合,腭裂表型明显。基于本研究中HE染色展现的形态学特点,我们选择GD14胎鼠作为主要研究对象,探讨腭裂发生的可能机制。
Meg3参与多种细胞的增殖、迁移、EMT等过程[16]。Meg3表达上调可促进牙髓干细胞发生成骨分化,细胞中成骨标志物runt相关转录因子2和骨钙素表达上调[17]。TGF-β家族通过调节细胞增殖、生长以及分化等,在胚胎发育和组织稳态中发挥关键作用,Smad蛋白是TGF-β家族信号传导的关键下游分子[18]。本研究结果显示,atRA组GD14胎鼠腭突间充质细胞增殖能力较对照组明显减弱,胎鼠腭突间充质细胞中Meg3 mRNA表达水平高于对照组,p-Smad2和Smad4蛋白表达水平低于对照组,Smad7表达水平高于对照组,两组Smad2蛋白表达水平差异无统计学意义;RIP实验结果表明胎鼠腭突间充质细胞中Smad2蛋白能够直接与Meg3基因结合,atRA组胎鼠腭突间充质细胞中Smad2蛋白对Meg3基因的富集率显著高于对照组。由此推测atRA可能通过促进Meg3与Smad2的靶向结合,进而抑制TGF-β/Smad信号通路的激活,影响胎鼠腭突间充质细胞的增殖,从而导致腭裂的发生。

