伴有黏膜面破溃的胃间质瘤的危险因素及预后分析
刘珍珍,刘 丹,刘冰熔
郑州大学第一附属医院消化内科 郑州 450052
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是消化道最常见的间叶源性肿瘤,占消化系统肿瘤的1%~3%,可发生于消化道任何部位,最常见于胃(60%~65%)[1-2]。GIST生物学行为复杂,异质性较高,可表现为良性、潜在恶性或高度恶性,准确评估肿瘤的恶性潜能对治疗方式的选择及预测预后非常重要[3]。多项研究[4-5]证明,GIST破裂至腹腔是影响预后的危险因素。而GIST破溃到胃肠道腔内对患者预后影响如何,目前尚无定论[6-7]。本研究探讨了伴有黏膜面破溃的胃间质瘤的临床病理特征及黏膜面破溃对预后的影响,现报道如下。
1 对象与方法
1.1 研究对象收集2015年6月至2021年2月于郑州大学第一附属医院接受内镜或外科手术完整切除(R0切除)的432例胃间质瘤患者的临床病理资料。纳入标准:①术前均行胃镜检查。②肿瘤最大径≥2 cm。③术后病理确诊为GIST。排除标准:①存在肿瘤远处转移或侵犯邻近器官。②术前接受化疗、放疗或其他抗肿瘤治疗。③合并其他恶性肿瘤。④临床或病理资料不完整。按照纳排标准,最终纳入408例患者。本研究所有胃间质瘤均未破裂至腹腔内。
1.2 研究分组根据胃间质瘤黏膜面是否破溃,将患者分为破溃组(n=179)和非破溃组(n=229)。胃间质瘤黏膜面破溃的判定标准:术前胃镜检查可见胃间质瘤黏膜面有溃疡、缺损,有或无活动性出血或陈旧性出血斑。
1.3 资料收集收集患者的临床病理资料,包括性别、年龄、首发症状、肿瘤部位、肿瘤最大径、核分裂象计数、危险度分级[参照改良版的美国国立卫生研究院(National Institutes of Health,NIH)危险度分级标准[3]]、免疫组化指标和手术方式。
1.4 随访通过门诊复查病历、查阅住院病历或电话进行随访。随访时间从手术日开始,截至2022年2月。随访项目包括胃镜或全腹(增强)CT检查。无复发生存期定义为自手术日开始,至诊断肿瘤复发、转移或最后1次复查的时间。
1.5 统计学处理采用SPSS 23.0处理数据。应用χ2检验或校正χ2检验比较破溃组与非破溃组间性别、年龄、首发症状、肿瘤部位、肿瘤最大径、核分裂象计数、危险度分级、CD34、CD117、DOG-1、Ki-67指数和手术方式的差异。应用Logistic回归分析影响胃间质瘤黏膜面破溃的危险因素。绘制2组患者的K-M生存曲线并进行log-rank检验。检验水准α=0.05。
2 结果
2.1 破溃组与非破溃组一般临床病理资料比较见表1。破溃组与非破溃组首发症状、肿瘤部位、肿瘤最大径、核分裂象计数、危险度分级、Ki-67指数、手术方式比较差异有统计学意义(P<0.05)。
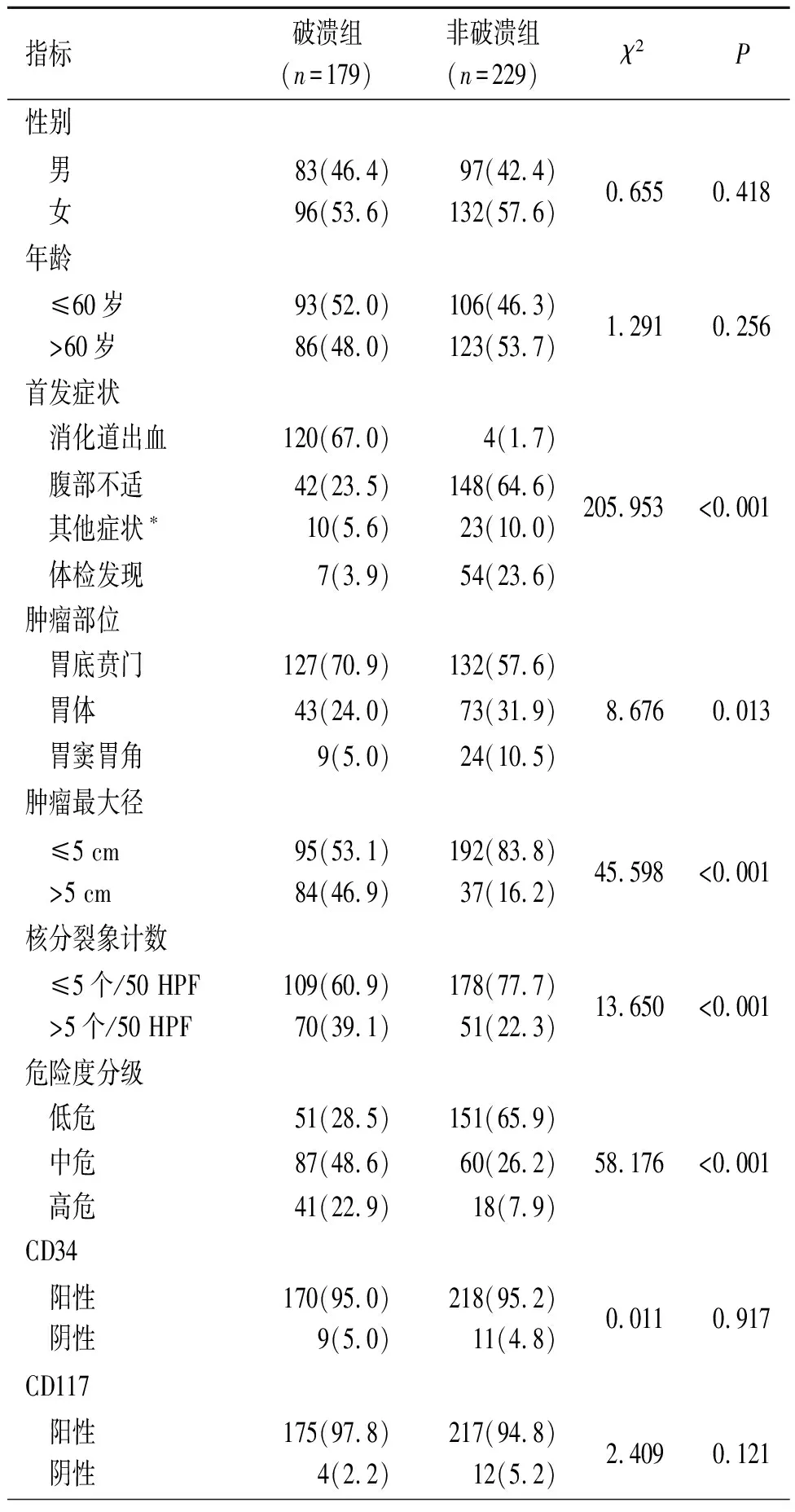
表1 破溃组与非破溃组患者一般临床病理资料的比较 例(%)
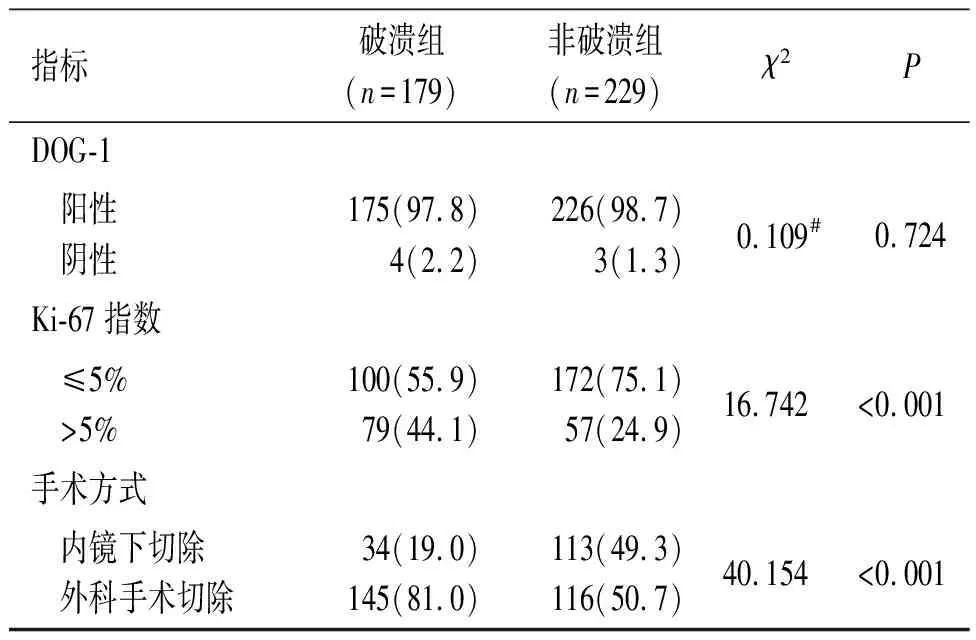
续表1
2.2 胃间质瘤黏膜面破溃的影响因素以胃间质瘤黏膜破溃为因变量,以肿瘤部位、肿瘤最大径、核分裂象计数、Ki-67指数为自变量做Logistic回归分析;结果显示,肿瘤位于胃底贲门、肿瘤最大径>5 cm、核分裂象计数>5个/50 HPF及Ki-67指数>5%是胃间质瘤黏膜面破溃的危险因素,见表2。
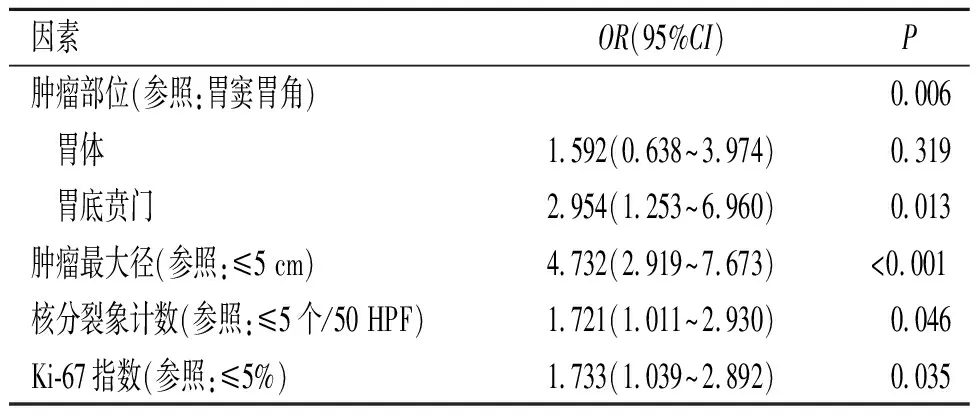
表2 胃间质瘤黏膜面破溃的影响因素分析
2.3 生存分析截至2022年2月,408例患者中有27例失访(破溃组14例,非破溃组13例),随访时间3~77个月,中位随访时间26个月。破溃组165例,其中10例术后肿瘤复发或转移;非破溃组216例,其中2例术后肿瘤复发或转移。2组生存曲线差异有统计学意义(χ2=6.812,P=0.009),见图1。

图1 破溃组与非破溃组患者生存曲线的比较
3 讨论
GIST是消化道最常见的间叶源性肿瘤,其破裂至腹腔会导致肿瘤细胞播散、转移,与患者预后不良有关[4-5]。根据改良版的NIH危险度分级标准,不论肿瘤最大径、核分裂象计数、肿瘤部位如何,破裂至腹腔的GIST都应被归为高危险度复发风险组,但其中并不包括破溃到胃肠道腔内的肿瘤[3]。
胃间质瘤黏膜面破溃与肿瘤最大径密切相关,随着肿瘤体积的不断增大,肿瘤表面局部血供不足,导致肿瘤组织缺血坏死、黏膜面破溃,并引起消化道出血。核分裂象计数则是表示细胞增殖能力的指标,肿瘤的核分裂象计数越高,其增殖能力越活跃,肿瘤体积增长越快,对血供要求也越高。Ki-67指数也是一种反映细胞增殖能力的重要指标,与细胞的有丝分裂密切相关,随着细胞核分裂象数目的增加而增加[8]。本研究结果提示,肿瘤最大径>5 cm、核分裂象计数>5个/50 HPF及Ki-67指数>5%是胃间质瘤黏膜面破溃的危险因素。另外本研究还发现,肿瘤部位是影响胃间质瘤黏膜面破溃的重要因素,与生长于胃窦胃角的间质瘤相比,胃底贲门部间质瘤更容易发生破溃,其原因可能与胃底贲门部血供较差,而胃体、胃窦部血供较为丰富有关;但胃各部位的血供是否存在差异仍需进一步的研究去证实。
GIST破溃到胃肠道腔内会导致消化道出血。研究[9]表明,有23%~33%的GIST患者以消化道出血就诊。本研究中,有30.4%(124/408)的患者以消化道出血为首发临床表现就诊,与上述文献报道一致。近年来,一些研究者发现GIST合并消化道出血与预后有关,但相关的研究结论并不一致:有学者[6,9-10]发现消化道出血是GIST术后复发转移的危险因素;也有研究[7,11]报道,消化道出血是GIST术后复发转移的保护因素。在临床上,我们发现部分胃间质瘤患者的胃镜检查提示肿物黏膜面发生了破溃,患者却没有以消化道出血为首发临床表现就诊。本研究破溃组179例患者中,59例(33.0%)未以消化道出血为首发临床表现就诊,这说明GIST黏膜面破溃后,患者不一定表现为消化道出血。有4例非破溃病例以消化道出血就诊,说明有消化道出血的胃间质瘤患者不一定有肿瘤黏膜面破溃。因此,以消化道出血症状为分组标准研究GIST合并消化道出血与患者预后的关系可能存在一定的不足[6-7,9-11]。
根据中国GIST诊断治疗共识[3],对于原发局限性GIST,建议外科手术切除。外科开腹手术曾是首选的治疗方式,但由于其创伤大、并发症发生率高,因此创伤小的腹腔镜手术正逐步取代开腹手术成为主要的治疗方式。相比外科手术,内镜下手术具有创伤更小、术后恢复快、体表无疤痕等优势,但主要用于<3 cm GIST的治疗[12]。随着内镜诊疗水平的不断提高,越来越多的研究[13-14]证明,内镜下切除3~5 cm、甚至5~7 cm的胃间质瘤是可行、安全且有效的。但由于内镜下治疗具有手术难度高、创面缝合难度大、不易完整经食管取出等缺点,其临床应用仍需进一步探讨。伴有黏膜面破溃的胃间质瘤体积较大,行外科手术切除的较多。本研究中破溃组有81.0%的患者行外科手术切除治疗,明显高于非破溃组(50.7%)。在选择手术方式时,除了肿瘤最大径,肿瘤部位、生长方式等也是需要考虑的因素[13]。临床医生应综合各个因素,选择最佳的手术方案。
GIST切除后应根据肿瘤最大径、核分裂象计数、肿瘤原发部位以及有无破裂对其进行危险度分级,以评估肿瘤的复发或转移风险[3]。中、高危GIST患者术后肿瘤复发或转移的风险较高,推荐服用伊马替尼治疗,且应常规随访胃镜、腹盆腔CT或MRI[3]。本研究中,破溃组有71.5%的胃间质瘤危险度分级属于中高危级,而非破溃组仅34.1%的胃间质瘤属于中高危级,说明伴有黏膜面破溃的胃间质瘤危险度分级较高,术后肿瘤复发或转移的风险较大。本研究生存分析也证明了伴有黏膜面破溃的胃间质瘤患者预后较差,提示临床医生在术后应加强随访,尽早发现复发或转移病灶并及时治疗,以改善患者的远期预后。
综上所述,伴有黏膜面破溃的胃间质瘤一般体积较大、危险度分级较高、预后较差。对于这类患者,我们应加以重视,及早治疗。在选择手术方式时,需综合考虑肿瘤最大径、生长部位及生长方式等各个因素。术后应加强随访,尽可能较早地发现复发或转移病灶。

