异丹叶大黄素对肺腺癌A549细胞miR-654-3p表达及增殖、迁移、侵袭能力的影响
陈 静,樊慧杰,耿 申,范菲菲
1)郑州大学第一附属医院呼吸内科 郑州 450052 2)郑州大学第一附属医院肿瘤科 郑州 450052
肺癌是我国危害严重的恶性肿瘤之一,其中非小细胞肺癌占据肺癌的85%以上[1]。肺癌早期临床症状不明显,患者确诊时多已处于晚期,目前主要采用以铂类为基础的化疗手段治疗,但副作用较大且部分患者易产生耐药性[2-3]。miRNA在肺癌组织或细胞系中表达异常,是肺癌潜在的治疗靶点[4-5]。有研究[6]表明,在非小细胞肺癌组织和细胞中miR-654-3p表达降低。既往研究[7]显示中医药可能通过作用于miRNA而调控肺癌细胞的生长及转移,从而发挥治疗作用。异丹叶大黄素(isorhapontigenin,ISO)是从中医药买麻藤中提取分离的一种中药单体成分。研究[8-10]显示,ISO可通过调控miR-145、miR-365a表达,抑制膀胱癌细胞生长并促进细胞凋亡。本研究分析了ISO调控miR-654-3p表达后对人肺腺癌A549细胞增殖、迁移、侵袭能力的影响,探讨ISO对肺癌的治疗作用以及可能的作用机制。
1 材料与方法
1.1 细胞与试剂上海融禾医药科技发展有限公司提供ISO(纯度≥98%,货号32507-66-7);上海通派生物科技有限公司提供A549;美国Thermo Fisher公司提供实时荧光定量PCR试剂盒;北京天根生化提供miRNA提取试剂盒及其反转录试剂盒;美国Invitrogen公司提供LipofectamineTM3000转染试剂;北京索莱宝公司提供CCK-8试剂、Transwell小室及Matrigel。E-cadherin、N-cadherin和内参GAPDH抗体以及山羊抗兔二抗为美国Santa Cruz公司产品。
1.2 ISO干预对A549生物学行为影响的观察
1.2.1实验分组 A549细胞密度达到95%左右时,将其接种在6孔板(1×105个/孔),用含不同浓度(0、5、10、20 μmol/L)ISO的 DMEM培养基培养24 h[11],分别记录为对照组、ISO-L组、ISO-M组和ISO-H组。
1.2.2细胞增殖能力的检测 分组培养后,将细胞接种于96孔板(1×103个/孔,每组3孔),在37 ℃含有体积分数5%CO2的培养箱中培养48 h,每孔加CCK-8溶液10 μL培养2 h,用微量板读取器测量450 nm处每个孔的光密度(OD)值。以未处理细胞孔为空白对照。细胞增殖抑制率=(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%。
1.2.3细胞克隆形成能力的检测 分组培养后,将A549细胞接种于6孔板(500个/孔,每组3孔),在37 ℃含有体积分数5%CO2的培养箱中培养14 d。待肉眼可见的细胞集落出现后,丢弃培养基,用预冷PBS清洁细胞,每孔加甲醇固定20 min,弃甲醇,加结晶紫染色1 min,拍照并用Image J计数细胞克隆数量。大于50个细胞的集落为一个克隆。
1.2.4细胞迁移能力的检测 用记号笔事先在6孔板背面每隔0.5 cm画一横线,横穿过孔,每孔6条线。分组培养后,将细胞按1×105个/孔接种于6孔板(每组3孔),在37 ℃含有体积分数5%CO2的培养箱内培养,直至细胞长满。用10 μL枪头在细胞单层划线,此时为0 h,然后将其放入培养箱内继续培养24 h。用Image J软件检测划痕宽度(6条线间距离的均值)并计算划痕愈合率。划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.5细胞侵袭能力的检测 用Matrigel稀释液涂抹Transwell小室的上室后固定5 h。分组培养后,将细胞接种于上室,将含有体积分数10%胎牛血清的DMEM培养液600 μL加入下室,将小室在37 ℃含有体积分数5%CO2的培养箱内培养24 h。取出小室,多聚甲醛固定20 min,加结晶紫染色10 min,PBS洗涤,于显微镜下用细胞计数板计数6个高倍镜视野下的侵袭细胞数。
1.2.6细胞中miR-654-3p表达水平的检测 分组培养后,用miRNA提取试剂盒提取细胞的小RNA,参照miRNA反转录试剂盒说明书操作,将小RNA反转录合成cDNA。以cDNA为模板,以U6为内参,进行实时荧光定量PCR。反应体系: SYBR qPCR Master Mix 10 μL,正、反向引物各0.4 μL,cDNA 2 μL,双蒸水7.2 μL。反应条件:95 ℃ 5 min预变性;95 ℃ 10 s,60 ℃ 30 s,40个循环。采用2-ΔΔCt法计算miR-654-3p相对表达量。miR-654-3p正向引物5’-GGGATGTCTGCTGACCA-3’,反向引物5’-CAGTGCGTGTCGTGGA-3’;U6正向引物5’-CTCGCTTCGGCAGCACA-3’,反向引物5’-AACGCT TCACGAATTTGCGT-3’。
1.2.7细胞中E-cadherin、N-cadherin蛋白表达的检测 采用Western blot法检测。收集各组A549细胞,加RIPA裂解物裂解,12 000 r/min离心12 min,取上清,用BCA法检测蛋白质浓度。经SDS-PAGE分离,转膜、密封2 h,加入E-cadherin(1∶1 000)、N-cadherin和内参GAPDH抗体(1∶2 000)4 ℃孵育24 h,PBS洗涤5次,加山羊抗兔二抗(1∶3 000)室温孵育1 h,用Image J软件分析条带的灰度值。用GAPDH蛋白表达归一化E-cadherin和N-cadherin蛋白的表达。
1.3 ISO干预联合上调miR-654-3p表达对A549细胞生物学行为影响的观察待A549细胞密度达到95%左右时,将其接种在6孔板(1×105个/孔),当细胞生长汇合达80%时,分两组,采用脂质体转染法分别转染miR-NC和miR-654-3p模拟物(上海生工生物工程技术服务有限公司)。转染48 h后,加20 μmol/L ISO孵育24 h。然后参照1.2方法检测细胞的增殖、侵袭、迁移能力,以及miR-654-3p、E-cadherin和N-cadherin蛋白的表达。
1.4 ISO干预联合下调miR-654-3p表达对A549细胞生物学行为影响的观察待A549细胞密度达到95%左右时,将其接种在6孔板(1×105个/孔),当细胞生长汇合达到80%时,分两组,采用脂质体转染法分别转染anti-miR-NC、anti-miR-654-3p(上海生工生物工程技术服务有限公司)。转染48 h后,加20 μmol/L ISO孵育24 h。然后参照1.2方法检测各指标。
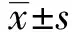
2 结果
2.1 ISO干预对A549细胞生物学行为和miR-654-3p表达的影响对照组、ISO-L组、ISO-M组和ISO-H组Western blot、侵袭实验及划痕实验结果见图1、2,各指标测定结果见表1。结果显示,ISO干预后A549细胞中miR-654-3p表达量升高;细胞增殖抑制率升高,克隆形成数减少;划痕愈合率、侵袭细胞数、N-cadherin蛋白表达水平均降低,E-cadherin蛋白表达水平升高;上述指标的变化均呈剂量依赖性。
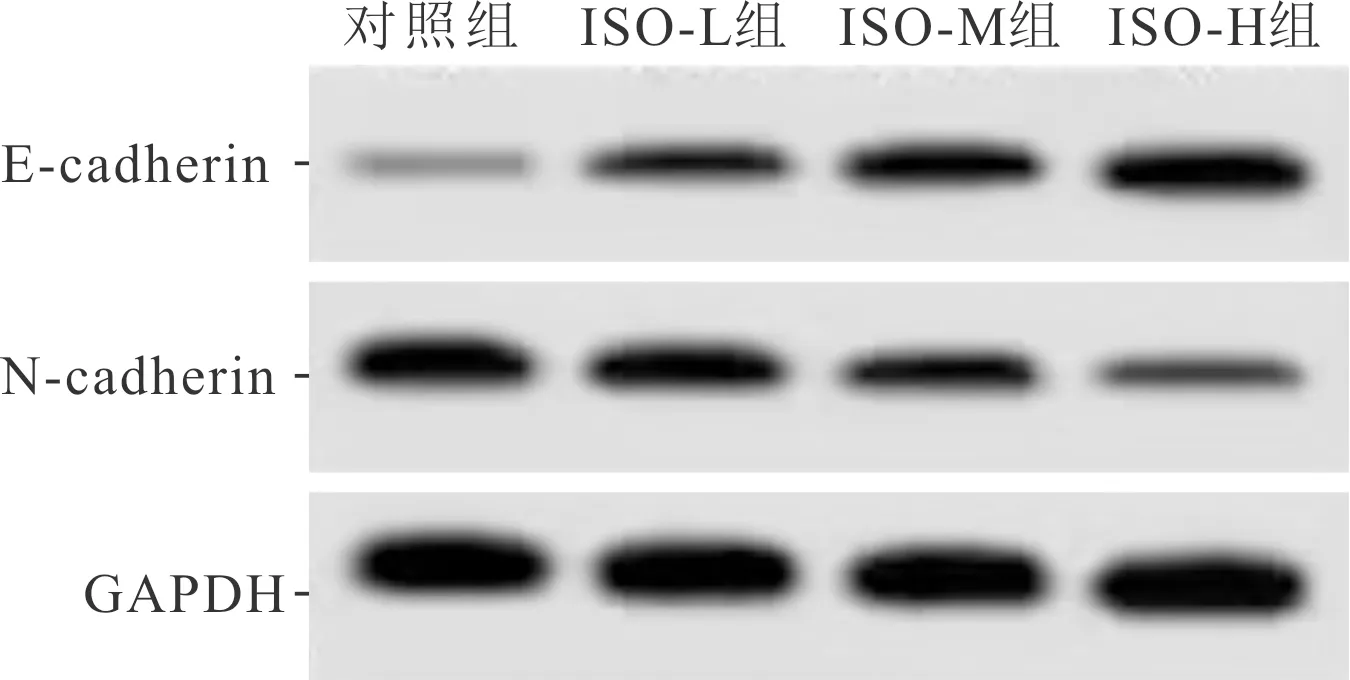
图1 4组细胞中E-cadherin和N-cadherin蛋白的表达
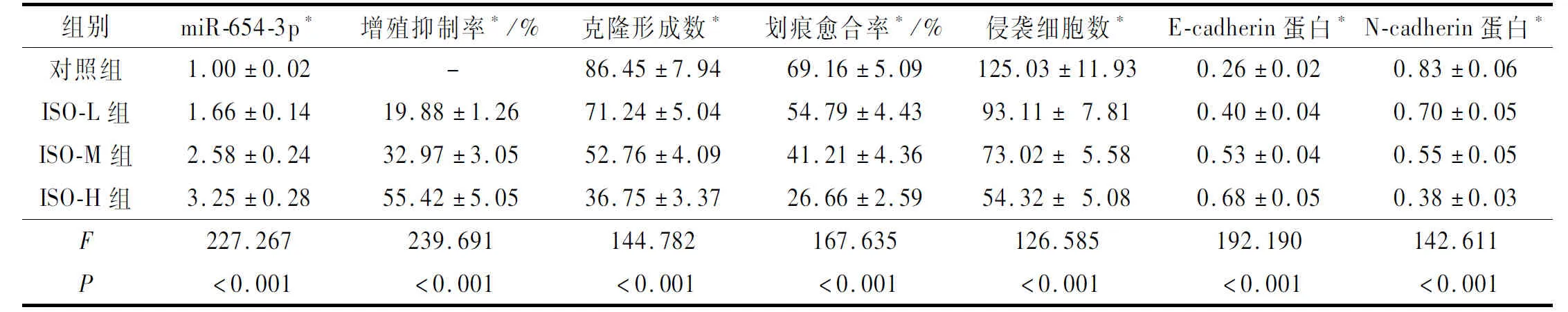
表1 4组细胞增殖、迁移、侵袭能力相关指标及miR-654-3p表达的比较(n=3)
2.2 ISO干预联合上调miR-654-3p表达对A549细胞生物学行为的影响miR-NC和miR-654-3p模拟物组Western blot、侵袭实验及划痕实验结果见图3、4,各指标测定结果见表2。与miR-NC组比较,miR-654-3p模拟物组克隆形成数减少,增殖抑制率升高;划痕愈合率、侵袭细胞数、N-cadherin蛋白表达水平降低,E-cadherin蛋白表达水平升高。
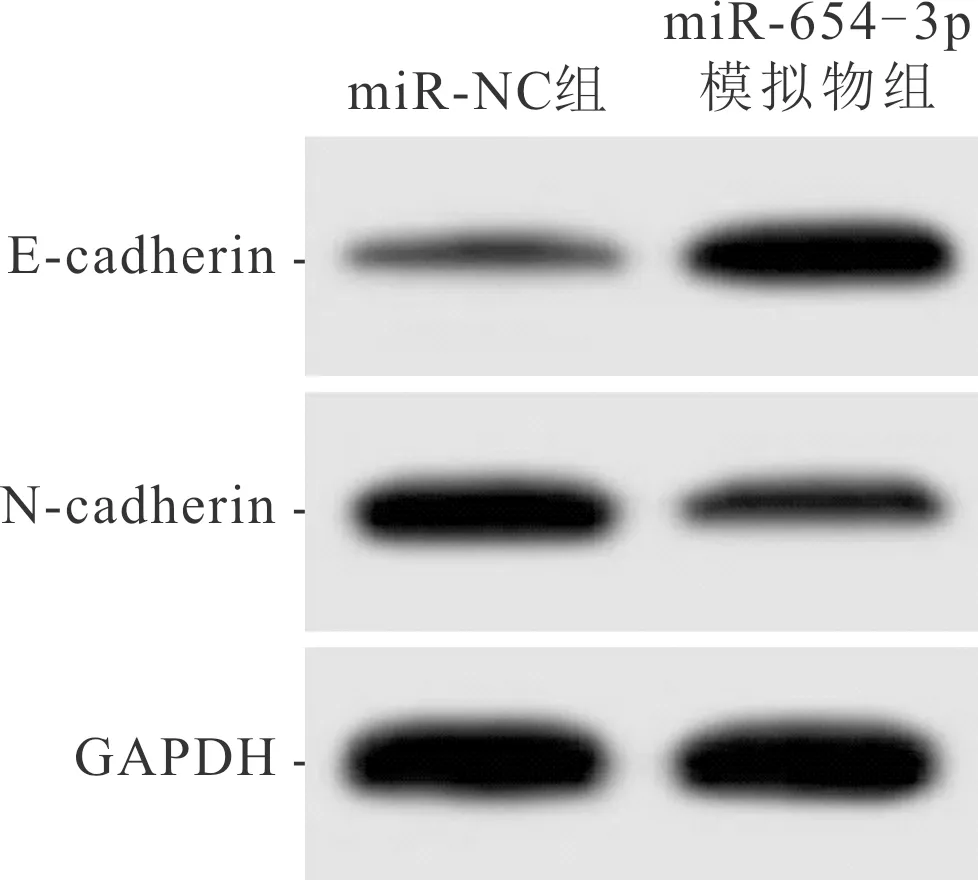
图3 miR-NC和miR-654-3p模拟物组细胞中E-cadherin和N-cadherin蛋白的表达

图4 miR-NC和miR-654-3p模拟物组细胞划痕实验(上、中)和侵袭实验(下)结果(×400)

表2 miR-NC和miR-654-3p模拟物组细胞增殖、迁移、侵袭能力相关指标及miR-654-3p表达的比较(n=3)
2.3 ISO干预联合下调miR-654-3p表达对A549细胞生物学行为的影响anti-miR-NC组和anti-miR-654-3p组Western blot、侵袭实验及划痕实验结果见图5、6,各指标测定结果见表3。与anti-miR-NC组比较,anti-miR-654-3p组克隆形成数增加,增殖抑制率降低;划痕愈合率、侵袭细胞数、N-cadherin蛋白表达水平增高,E-cadherin蛋白表达水平降低。
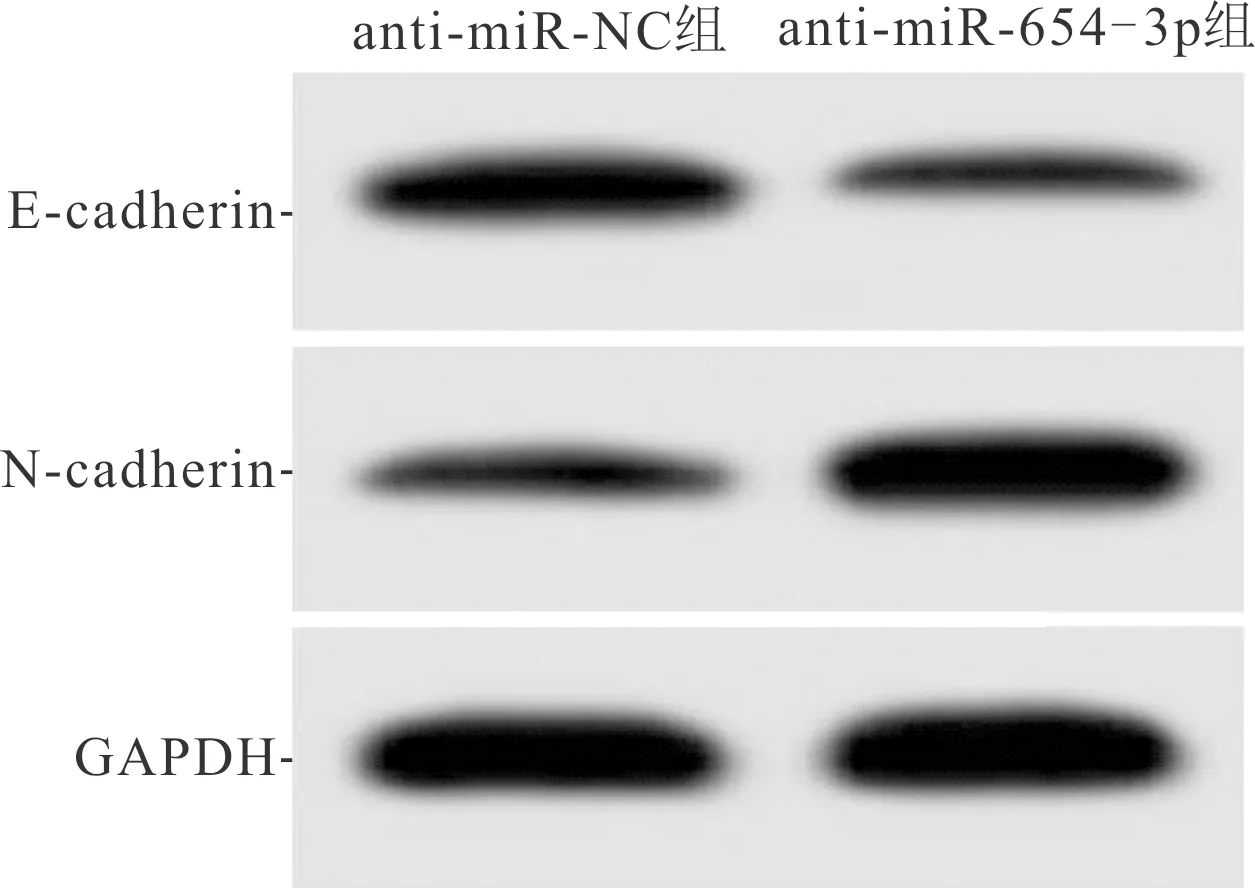
图5 anti-miR-NC和anti-miR-654-3p组细胞E-cadherin和N-cadherin蛋白的表达

图6 anti-miR-NC和anti-miR-654-3p组细胞划痕实验(上、中)和侵袭实验结果(下)(×400)

表3 anti-miR-NC和anti-miR-654-3p组细胞增殖、迁移、侵袭能力相关指标及miR-654-3p表达的比较(n=3)
3 讨论
miR-654-3p通过靶向RASAL2,抑制非小细胞肺癌细胞增殖并促进细胞凋亡[12]。miR-654-3p表达上调可抑制卵巢癌细胞增殖、侵袭及克隆形成能力[13]。在结直肠癌组织中miR-654-3p表达降低,上调miR-654-3p可抑制结直肠癌细胞增殖、迁移,促进细胞凋亡[14]。
本研究结果显示,ISO可抑制肺腺癌A549细胞的增殖及克隆形成能力。N-cadherin表达上调时上皮-间充质转化(epithelial-mesenchymal transition,EMT)被激活,而E-cadherin表达上调时EMT被抑制[15]。本研究结果表明,随着ISO浓度的增加,A549细胞的迁移和侵袭能力以及N-cadherin的表达受到抑制,而E-cadherin表达水平增加,表明ISO可以抑制A549细胞的迁移和侵袭,其机制可能与抑制EMT有关。本研究结果还显示,上调miR-654-3p表达联合ISO干预可抑制A549细胞的增殖、迁移和侵袭能力;而下调miR-654-3p表达联合ISO干预后,A549细胞的增殖、克隆形成、迁移及侵袭能力恢复。这表明ISO可能通过促进miR-654-3p的表达而发挥抗肺癌的作用。
综上所述,ISO可通过促进miR-654-3p表达而抑制A549细胞的增殖、迁移、侵袭能力,miR-654-3p可能是ISO治疗肺癌的潜在靶点,这为肺癌治疗药物的研发提供了新方向。但ISO抗癌机制较为复杂,其是否可通过调控其他非编码RNA或信号通路而调节肺癌细胞的生物学行为尚需进一步探究。

