昼夜节律基因Bmal1在卵巢浆液性癌发生发展中的作用
杨展飞,李风艳,王朝霞
(1山西医科大学第一临床医学院妇产科教研室,太原 030001;2山西医科大学第一医院妇科;*通讯作者,E-mail:lfytao@163.com)
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,因早期缺乏特异症状,发现时多为晚期,为妇科恶性肿瘤中致死率最高的疾病。卵巢浆液性癌(ovirian serous carcinoma,OSC)是上皮来源的卵巢癌中最常见的类型,分为两型,低级别卵巢浆液性癌(LGSOC)属于Ⅰ型,其很少有p53基因的突变,生物学特性为低度恶性,生长缓慢,高级别卵巢浆液性癌(HGSOC)属于Ⅱ型,80%伴有p53基因的突变,其生长迅速。HGSOC是最常见的表型,约占所有卵巢癌的80%[1],由于症状不明确,大多数HGSOC进展到晚期,预后差[2]。即使在治疗后,HGSOC也经常由于化疗药物耐药而复发,5年总体生存概率为31%[3]。研究发现,昼夜节律的改变促进肿瘤的形成[4]。昼夜节律基因包括Per1、Per2、Per3、Cry1、Cry2、Bmal1、Npas2和Clock等[5]。在体内和体外实验中,Bmal1均可抑制鼻咽癌细胞[6]。Per1在卵巢癌组织中的表达明显低于癌旁组织,它主要通过调节肿瘤浸润细胞,从而影响卵巢癌患者的预后[7]。Per2还通过PI3K信号通路调节卵巢癌的化疗效果和多药耐药性[8]。但Bmal1与卵巢癌的研究较少。野生型p53参与细胞周期调控,促进细胞凋亡,而突变型促进细胞恶变,大多数肿瘤伴随着p53基因的突变,而p53基因和昼夜节律基因存在着复杂的交互关系[9]。Bmal1的缺失会降低Per1、Per2、Per3和p53(野生型)的表达[10]。Vimentin是一种细胞外基质蛋白,是中间丝蛋白家族的一部分[11]。Vimentin的过表达可能与卵巢肿瘤细胞通过上皮间充质转化(epithelial-mesenchymal transition,EMT)转移增加有关[12]。但Bmal1在卵巢癌发生发展的作用机制并不明确,Bmal1是否通过p53通路发挥作用也存在疑问,Bmal1是否和Vimentin的表达相关,并且参与EMT,都是需要研究的内容。本研究探讨节律基因Bmal1在节律异常组和节律正常组的卵巢癌组织的表达,并检测两组中p53(突变型)、Vimentin的表达情况,探索Bmal1影响卵巢癌的途径。
1 资料与方法
1.1 资料来源
1.1.1 组织标本 选择2020年09月至2022年02月经山西医科大学第一医院经病理诊断的卵巢浆液性癌石蜡包埋组织,分为节律正常组和节律异常组,节律异常组的定义为晚上11点到早晨7点之间的时间,因工作或睡眠障碍无法入睡,3年以上每月有3个以上这样的夜晚[13]。通过查阅病史及电话随访获得资料。纳入标准:①患者均病理诊断为卵巢浆液性癌;②患者术前均未接受放化疗;③临床及随访资料完整。排除标准:①术前接受放化疗;②临床资料不完整。节律正常组和节律异常组各30例。本研究已获得山西医科大学第一医院伦理委员会批准(批件号:NO.KYLL-2023-055)。
1.1.2 主要试剂 PMSF、RIPA裂解液、SDS-PAGE凝胶快速制备试剂盒、BCA蛋白浓度测定试剂盒主要购自上海碧云天生物技术有限公司,蛋白marker(12-154KD)、GAPDH、RNA提取液体、Water Nuclease-Free、RT First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master Mix(None ROX)、超敏ECL化学发光试剂盒购自武汉赛维尔生物科技有限公司,HRP标记羊抗兔二抗购自赛默飞世尔科技。
1.2 方法
1.2.1 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)技术检测患者肿瘤组织Bmal1 mRNA的表达 取石蜡切片,二甲苯脱蜡处理,100%乙醇洗涤后干燥,提取Bmal1 mRNA,并进行浓度及纯度测定。逆转录合成cDNA,逆转录条件:RNA溶液10 μl,随机引物0.5 μl,Oligo(dT)18 Primer 0.5 μl,5×Reaction Buffer 4 μl,RT Enzyme Mix 1 μl,RNase free water 4 μl。42 ℃孵育30 min,然后85 ℃孵育5 s。Bmal1基因的引物序列,上游:5′-CACCCAGCACAATGAAGATCAAGAT-3′,下游:5′-CCAGTTTTTAAATCCTGAGTCAAGC-3′;内参照磷酸甘油醛脱氢酶(GAPDH)基因的引物序列,上游:5′-GGAAGCTTGTCATCAATGGAAATC-3′,下游:5′-TGATGACCCTTTTGGCTCCC-3′。反应体系:2×qPCR Mix 7.5 μl,2.5 μmol/L基因引物(上游+下游)1.5 μl,cDNA 2.0 μl,Water Nuclease-Free 4.0 μl。进行PCR扩增,条件为:95 ℃预变性30 s,95 ℃变性15 s,60 ℃退火/延伸30 s。40个循环结束。反应后,通过内置PCR扩增软件生成溶解曲线。采用2-ΔΔCt法分析两组Bmal1 mRNA的相对表达,Ct为荧光强度达到阈值所需的扩增循环数。
1.2.2 蛋白印迹(Western blot)法检测患者肿瘤组织Bmal1蛋白的表达 取3~5片石蜡切片,二甲苯脱蜡处理,100%乙醇洗涤后干燥,将少量的剪碎的组织块置于2 ml EP管中,每管加300 μl含有PMS的RIPA裂解液,裂解完成后,用移液器将裂解液移至1.5 ml离心管中,然后在4 ℃下12 000 r/min离心5 min,取上清分装于0.5 ml离心管中。用BCA法测蛋白浓度,在100 ℃沸水中水浴10 min使蛋白质变性,使用常规方法制备分离凝胶和浓缩凝胶,进行SDS-PAGE电泳,将蛋白转移至PVDF膜上,将PVDF膜用含5%脱脂奶粉的TBST在室温下封闭2 h。使PVDF泡于兔抗人单克隆抗体孵育液中,4 ℃孵育过夜,洗去多余一抗,用封闭液稀释相应的HRP标记二抗(1∶10 000稀释),使PVDF膜浸泡于二抗孵育液中,37 ℃摇床孵育1 h。洗去多余二抗显色曝光。用GAPDH作为内部参照。利用ImageJ图像分析软件分析蛋白条带。
1.2.3 免疫组织化学法(immunohistochemistry,IHC)测定患者肿瘤组织中p53(突变型)、Vimentin蛋白的表达量 对组织蜡块进行连续切片,放进60 ℃恒温箱中烘烤3 h,二甲苯中脱蜡,再依次按照浓度梯度由高到低的乙醇各水化5 min,PBS缓冲液冲洗3次,每次15 min,置于3%的H2O2PBS缓冲液冲洗3次,每次冲洗2 min,盛有柠檬酸钠溶液的高压锅煮沸,切片浸入高压锅,自然冷却后取出,PBS缓冲液冲洗3次,每次5 min,加入一抗稀释液(p53 1∶200,Vimentin 1∶200),37 ℃恒温孵育1.5 h,PBS缓冲液冲洗3次,每次2 min,加入二抗,在自然温度下孵育20 min,PBS缓冲液冲洗3次,每次2 min,滴加DAB显色溶液,镜检后自来水冲洗,苏木青复染、盐酸分化、氨水反蓝,每部均需自来水冲洗,中性树胶封片。用Image-ProPlus分析免疫组织化学结果,用平均光密度值(mean optical density,MOD)表示,棕黄色颗粒为阳性表达。每张切片随机选取5个高倍镜视野,测定每个视野下的MOD值,5个视野的平均MOD值为该张切片的MOD值。
1.3 统计学方法
采用SPSS26.0软件分析数据,符合正态分布的计量资料用均数±标准差表示,若方差齐,组间比较采用t检验,若方差不齐,组间比较采用t’检验。不符合正态分布的计量资料,用M(P25,P75)表示,组间比较采用秩和检验。计数资料组间比较采用卡方检验。
2 结果
2.1 两组患者肿瘤组织中Bmal1 mRNA和蛋白的相对表达量
RT-qPCR检测结果显示,Bmal1 mRNA的相对表达量在节律异常组低于节律正常组,差异有统计学意义(P<0.000 1,见图1)。
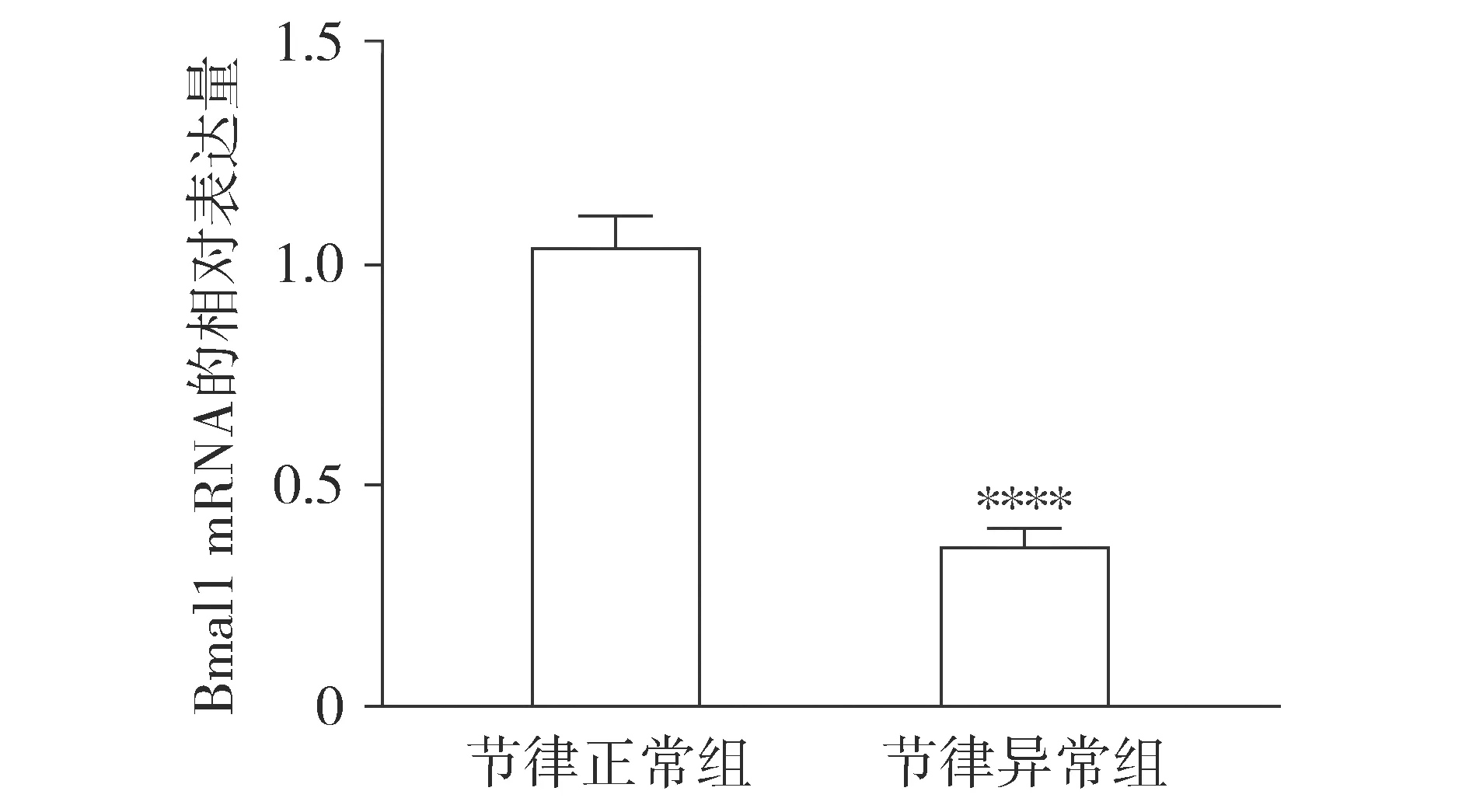
与节律正常组相比,****P<0.000 1
Western blot结果显示,节律异常组Bmal1蛋白的相对表达量低于节律正常组,差异有统计学意义(P<0.000 1,见图2)。
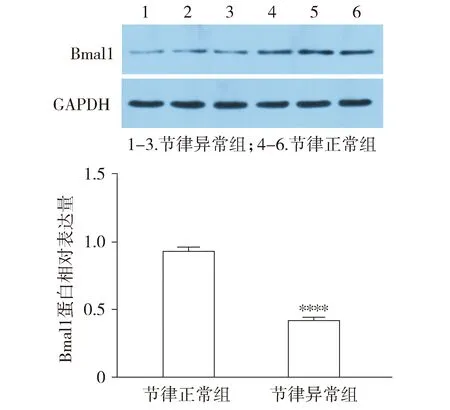
与节律正常组相比,****P<0.000 1
2.2 IHC法检测p53(突变型)和Vimentin蛋白的表达
p53(突变型)在节律异常组的MOD值是0.144(0.123,0.151),高于节律正常组的0.065(0,0.135),差异有统计学意义(P<0.001,见图3)。Vimentin在节律异常组的MOD值是0.096(0.085,0.104),高于节律正常组的0.045(0,0.084),差异有统计学意义(P<0.001,见图4)。
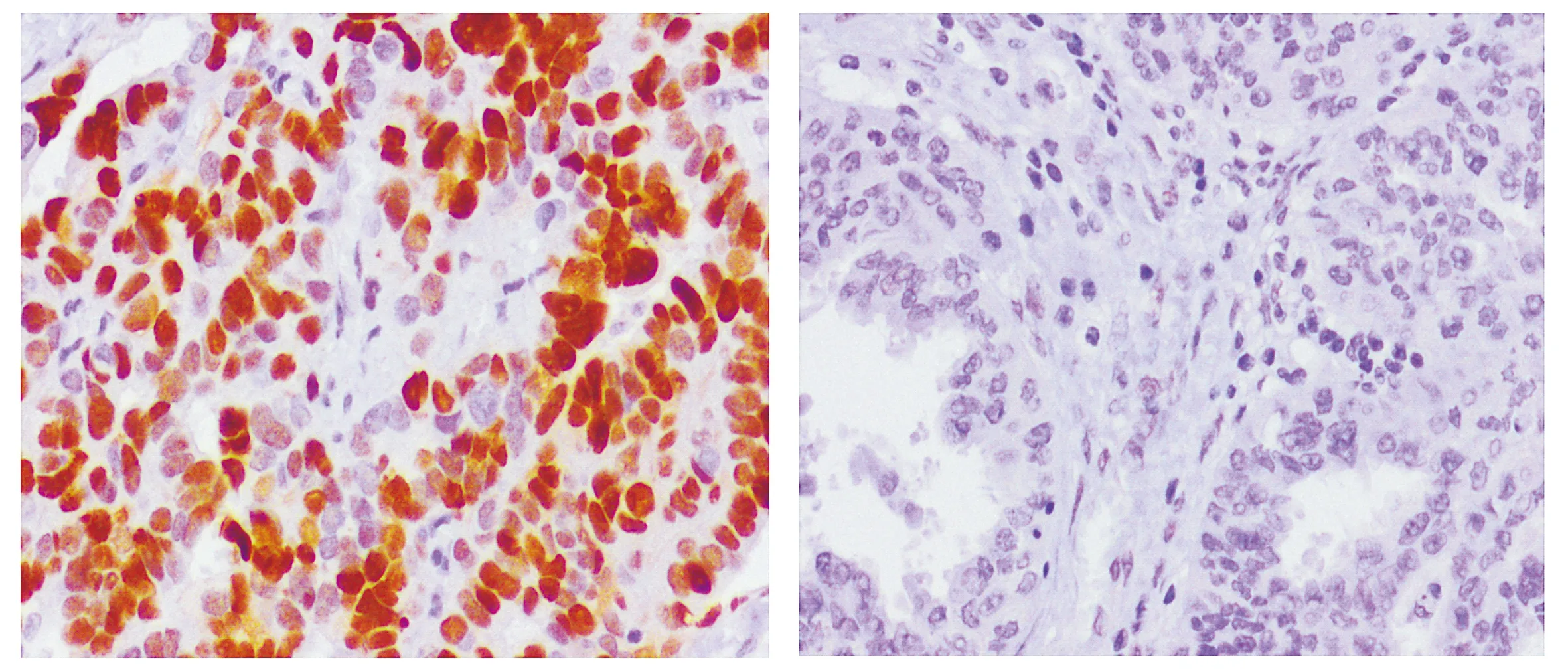
A.节律异常组 B.节律正常组
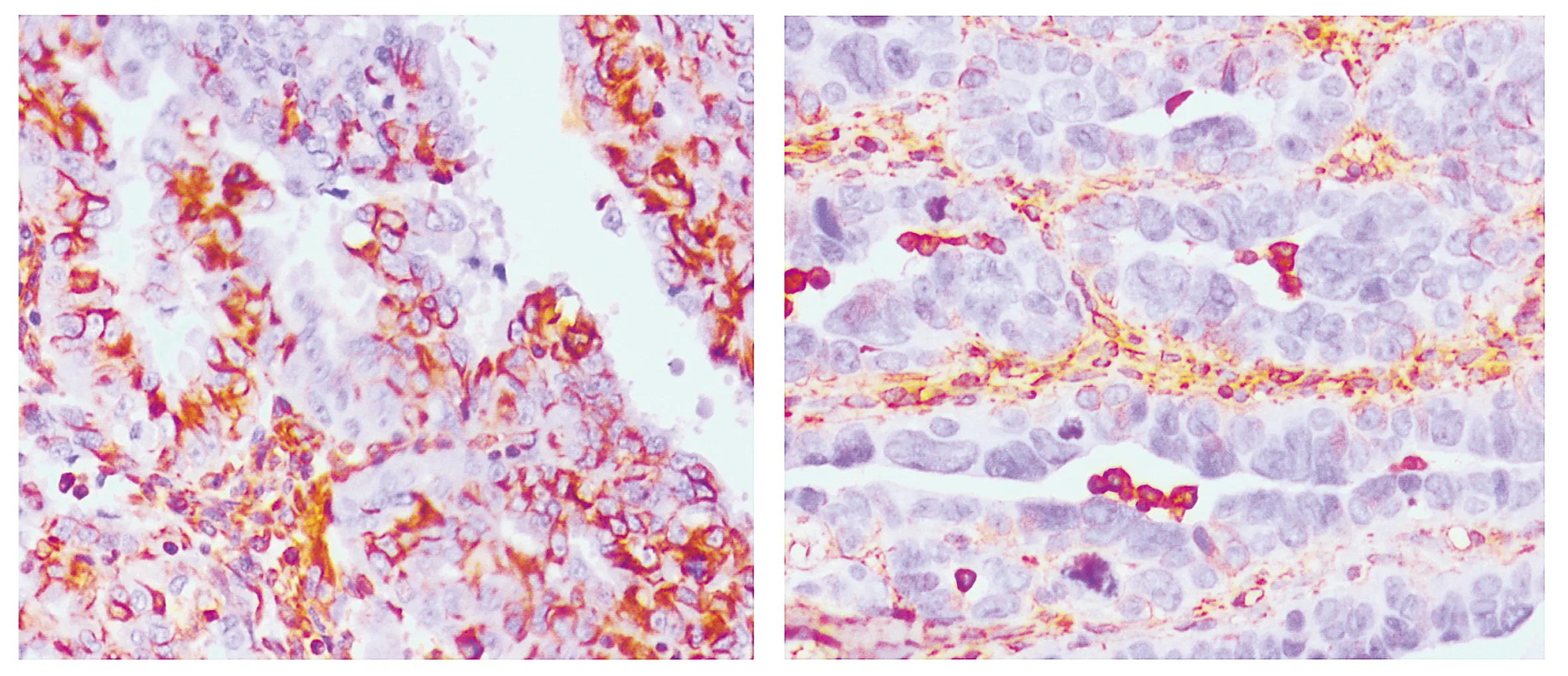
A.节律异常组 B.节律正常组
2.3 节律与临床病理特征
节律异常组中<55岁患者所占比例与节律正常组相比差异无统计学意义(50.00%vs40.00%,P>0.05)。节律异常组中高级别卵巢浆液性癌患者所占比例高于节律正常组(86.67%vs63.33%,P<0.05)。节律异常组中Ⅲ+Ⅳ期患者所占比例高于节律正常组(80.00%vs53.33%,P<0.05)。节律异常组中有淋巴结转移患者所占比例高于节律正常组(53.33%vs26.67%,P<0.05,见表1)。
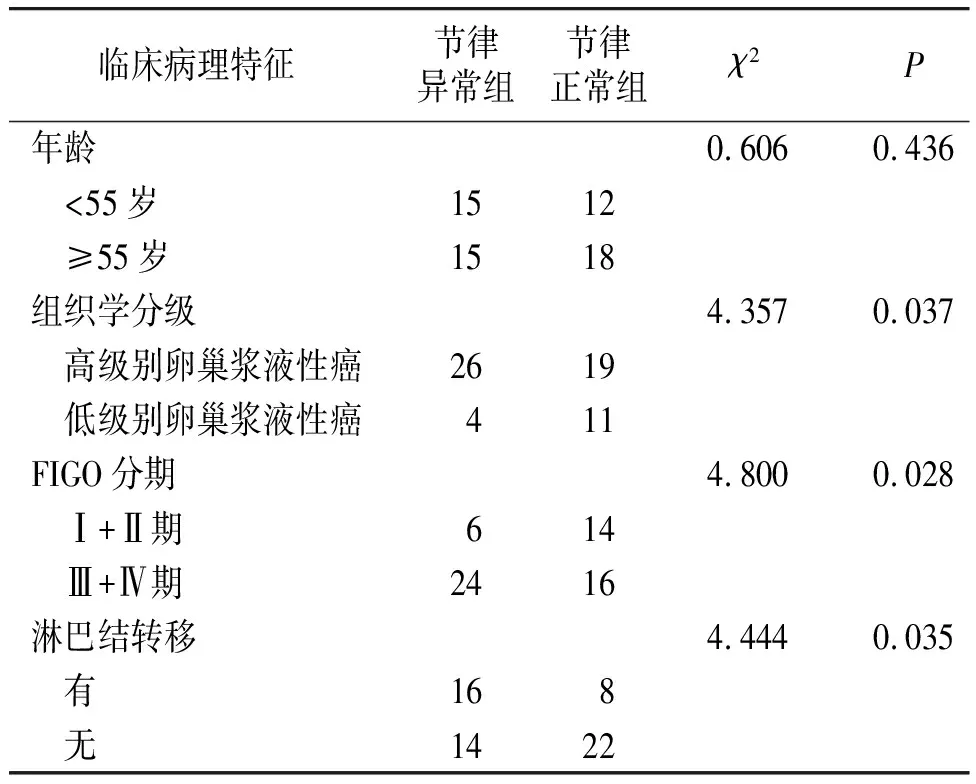
表1 节律与临床病理特征的关系 (例)
2.4 Bmal1 mRNA和Bmal1蛋白与临床病理特征的关系
Bmal1 mRNA与Bmal1蛋白的相对表达量与组织学分级、FIGO分期、淋巴结转移有关(P<0.001),与年龄无关(P>0.0.05,见表2)。
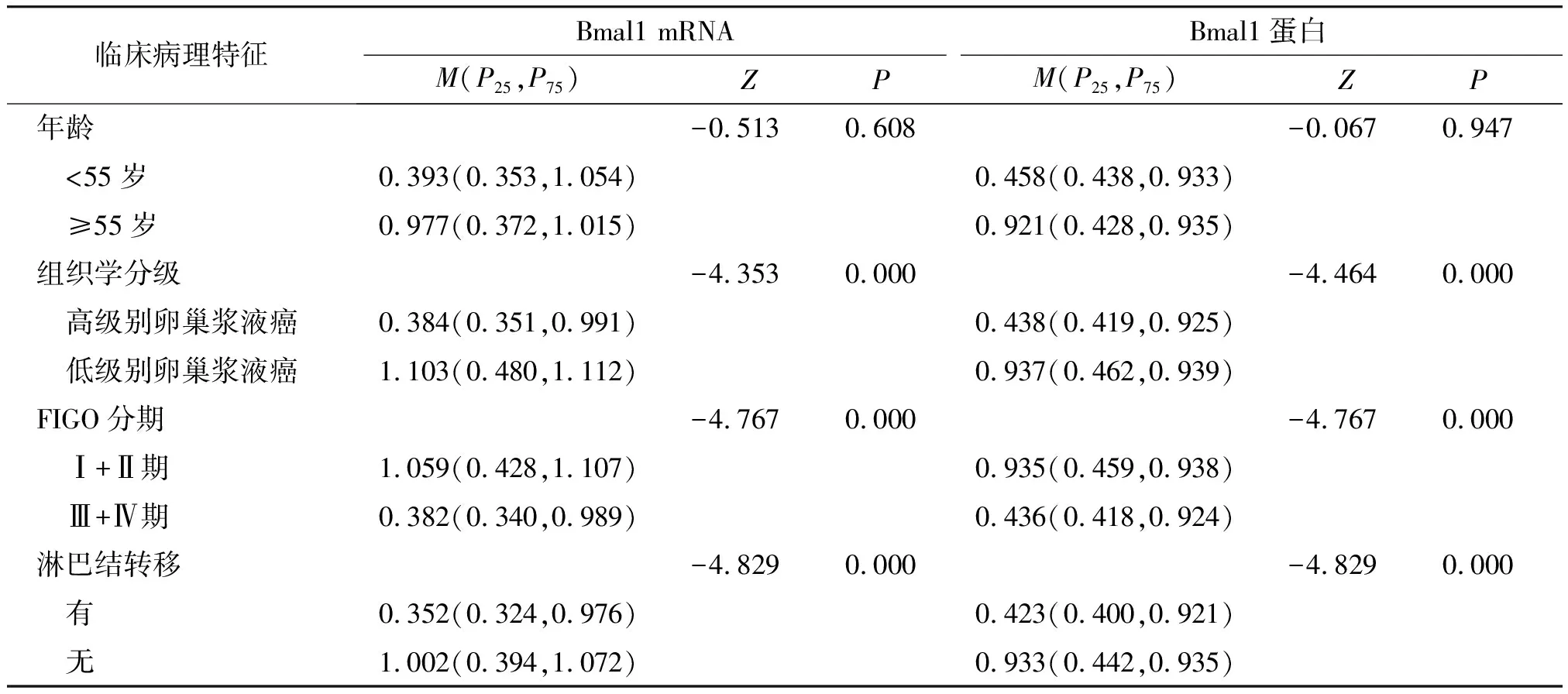
表2 Bmal1 mRNA和Bmal1蛋白与临床病理特征的关系
2.5 Bmal1蛋白与p53(突变型)和Vimentin的相关性
Spearman相关性分析显示:Bmal1蛋白与p53(突变型)表达呈负相关(rs=-0.784,P=0.000);Bmal1蛋白与Vimentin表达呈负相关(rs=-0.754,P=0.000,见图5)。
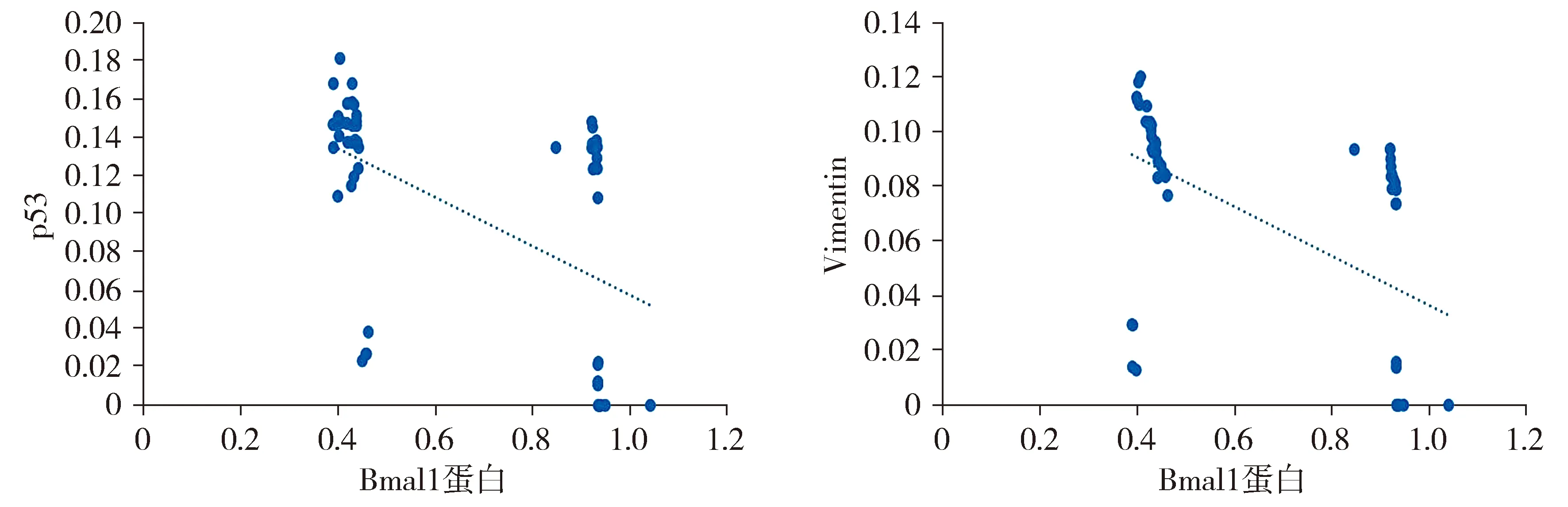
图5 卵巢浆液性癌中Bmal1蛋白与p53和Vimentin表达的相关性
3 讨论
Bmal1基因也称为Arntl基因,位于11号染色体短臂,它编码蛋白质Bmal1,Bmal1基因不仅表达于所有视交叉上核细胞,在多数外周细胞中也存在表达[14]。已有研究表明,Bmal1基因在头颈部鳞状细胞癌组织中的表达水平明显低于正常组织[15],另一项研究表明,Bmal1的高表达可抑制舌鳞癌细胞的增殖,显著减缓裸鼠的肿瘤发生速度[16]。另有研究表明,Bmal1蛋白在低级别鼻咽癌细胞中比在高级别鼻咽癌细胞中表达高[6]。卵巢成纤维细胞和颗粒细胞都表达Bmal1。Bmal1的低表达与卵巢癌患者总生存率较低有关,与正常卵巢组织相比,上皮性卵巢癌细胞中的Bmal1和Cry1表达显著降低[17]。Bmal1突变没有使小鼠易患癌症,但引起过早衰老表型[18]。在本研究中,Bmal1 mRNA及Bmal1蛋白在LGSOC组中的表达也高于HGSOC,且Bmal1 mRNA及Bmal1蛋白在早期、无淋巴结转移患者的表达分别高于晚期、有淋巴结转移患者,这与已有研究相似,但Bmal1作用于卵巢癌的分子机制仍不明确,这需要大量的实验进一步探究。
p53基因位于17号染色体上,是最重要的肿瘤抑制因子之一。p53通过与DNA结合并激活p21基因的转录来阻止肿瘤的生长和形成。当p53基因发生突变时,它无法正确地结合DNA,p21产生障碍,细胞呈指数级分裂,从而形成肿瘤。HGSOC是以p53基因突变为主要分子遗传学特征[19]。而昼夜节律基因和p53有着诸多联系。Cry对p53野生型小鼠的寿命没有影响,然而,它的缺失延长了p53-/-的癌细胞的寿命[20]。p53还通过调节Per2转录来影响生物钟节律:p53与Per基因启动子中的反应元件结合,该元件与E-box重叠[21]。p53与Bmal1的研究较少。在本实验中,节律异常组中HGSOC所占比例高于节律正常组,且IHC结果显示,节律异常组中p53(突变型)表达高于节律正常组,相反,节律异常组中Bmal1 mRNA及Bmal1蛋白表达低于节律正常组,且Bmal1蛋白与p53(突变型)表达呈负相关,但是Bmal1具体通过怎样的分子通路作用于p53,进而影响卵巢癌癌的发生、发展,目前尚不清楚,仍需大量实验进一步探究。
研究表明,Vimentin表达增加与多种癌症(如结直肠癌、宫颈癌、乳腺癌、胃癌和非小细胞肺癌)的生存率降低相关[22]。在EMT过程中,上皮细胞失去极性并转变为间充质细胞,伴有N-钙黏蛋白、Vimentin表达上调,但E-钙黏蛋白表达下调[23]。在与胶质瘤相关巨噬细胞M2型共培养的胶质瘤中,Bmal1蛋白的表达降低,胶质瘤细胞中Vimentin的表达增加[24]。在本实验中,IHC结果显示,Vimentin在节律异常组的表达高于节律正常组,相反,节律异常组中Bmal1 mRNA及Bmal1蛋白表达低于节律正常组,且Bmal1蛋白与Vimentin表达呈负相关,猜测Bmal1可能通过阻断EMT过程抑制肿瘤的发展,这是需要进一步验证的问题。
长基因间非蛋白编码RNA 472(LINC00472),miR-149-3p和miR-4270参与非小细胞肺癌的进展。LINC00472的过表达可以下调miR-149-3p和miR-4270,上调KLLN并激活p53信号通路,抑制非小细胞肺癌细胞的侵袭、迁移和EMT,进而使N-钙黏蛋白和Vimentin的表达降低以及E-钙黏蛋白表达增加[25]。p53突变乳腺肿瘤细胞表现出Vimentin表达升高[26]。在本实验中,p53(突变型)、Vimentin的表达在节律异常组均高于节律正常组,据此我们猜测p53(野生型)可能通过下调Vimentin、阻断EMT过程发挥抑瘤作用。
本研究证实:Bmal1 mRNA和Bmal1蛋白的表达在节律异常组低于节律正常组,对应的p53(突变型)和Vimentin的表达在节律异常组高于节律正常组。且Bmal1 mRNA和Bmal1蛋白在高级别病变、有淋巴结转移、晚期患者表达分别低于低级别病变、无淋巴结转移、早期患者。Bmal1可能成为卵巢癌治疗的新靶点,课题组会继续研究节律基因和卵巢癌的关系。

