沙漠嘎有效部位化学成分的分离与鉴定
刘 湉,王志鑫,母磊鑫,王凯赫,徐 广,吉 莉,马 群,乔延江
(北京中医药大学中药学院,北京 102488;*通讯作者,E-mail:maqun99@163.com;#共同通讯作者,E-mail:yjqiao@263.net)
沙漠嘎,菊科蒿属植物差不嘎蒿(ArtemisiahalodendronTurcz.)的嫩枝叶,分布于我国东北、华北及西北地区广阔的沙漠中[1]。沙漠嘎具有止咳平喘、祛风湿的功效,可用于感冒、慢性支气管炎及风湿性疾病的治疗[2],其药理活性主要体现在抗炎、抗哮喘、祛痰止咳等方面[3-7]。前期研究表明沙漠嘎中主要含有黄酮类、挥发油类、有机酸类等化学成分,其中黄酮类化合物为主要的药效成分[4-9]。目前对沙漠嘎的化学成分及药效作用机制的研究仍有待完善,为了阐明沙漠嘎的药效物质基础,为其质量控制方法及抗哮喘作用机制研究提供依据,本文对沙漠嘎具抗哮喘活性有效部位进行了化学研究。
1 材料与方法
1.1 主要仪器
KH-250型速控超声波清洗器(昆山禾创超声仪器有限公司);HH-4数显恒温水浴锅,(国华电器有限公司);DZF-6050真空干燥箱(上海一恒科技有限公司);旋转蒸发仪(上海亚荣化工仪器厂);电子天平BS-124S(北京赛多利斯仪器系统有限公司);LC-20AT岛津高效液相色谱仪,分析型(日本岛津公司,日本);Waters Prep 150高效液相色谱仪,制备型(美国waters公司,美国);超高效液相色谱-四级杆飞行时间质谱联用仪(Q-TOF6550)(美国安捷伦科技公司,美国),核磁共振仪(瑞士BRUKER公司,瑞士)。
1.2 材料与试剂
沙漠嘎药材,采自内蒙古自治区通辽市,经北京中医药大学刘春生教授鉴定为菊科蒿属植物沙漠嘎的地上部分;娃哈哈纯净水(杭州娃哈哈集团有限公司);甲醇,乙腈,甲酸均为色谱纯(赛默飞世尔科技公司,美国);95%乙醇,分析纯(北京化工厂有限责任公司);氘代甲醇(美国剑桥CIL同位素标准品公司,美国)。
1.3 药材分离部位的制备
将沙漠嘎药材用85%乙醇溶液回流提取3次,每次2 h,合并3次提取液,浓缩,再用预处理后的大孔树脂对粗提物进行纯化,收集洗脱液,减压浓缩,干燥,即得沙漠嘎制备物。
1.4 供试品溶液的制备
取沙漠嘎制备物250 mg,精密称定,置于25 ml容量瓶中,加入适量甲醇溶解,超声30 min,再加甲醇至刻度,定容,摇匀,过0.45 μm的微孔滤膜,即得。
1.5 分离纯化
制备液相色谱的分离条件:采用YMC-Pack ODS-A制备色谱柱(5 μm,250 mm×20 mm);流动相为0.1%甲酸水-乙腈(70∶30),等度洗脱;流速为18 ml/min,流动相在使用前过0.45 μm的微孔滤膜后再超声15 min;柱温为室温;进样量为3 ml,检测波长为270 nm。沙漠嘎有效部位的制备液相色谱图见图1,分别收集各色谱峰所对应的组分。
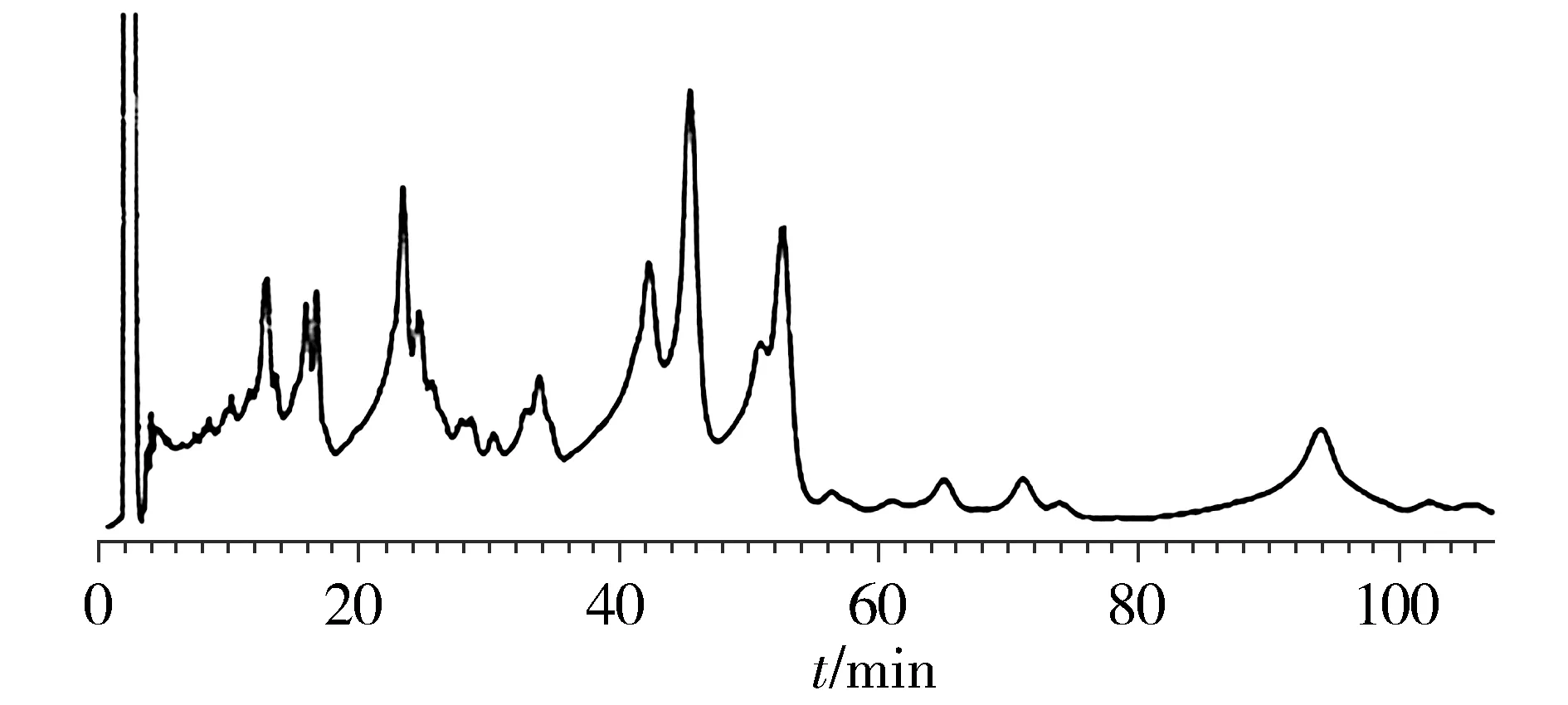
图1 沙漠嘎有效部位的制备液相色谱图
将收集到的各馏分溶液分别合并,浓缩干燥,用适量甲醇溶解,先采用分析型高效液相色谱仪摸索制备条件,然后再采用半制备柱YMC-Pack ODS-A色谱柱(5 μm,250 mm×10 mm)通过调节流动相的种类、比例与流速对不同组分建立不同制备液相色谱条件,进行二次分离制备,分别收集洗脱液,采用分析型高效液相色谱仪检测纯度后合并,浓缩干燥,得到纯度较高的单体化合物,提取分离流程图见图2。
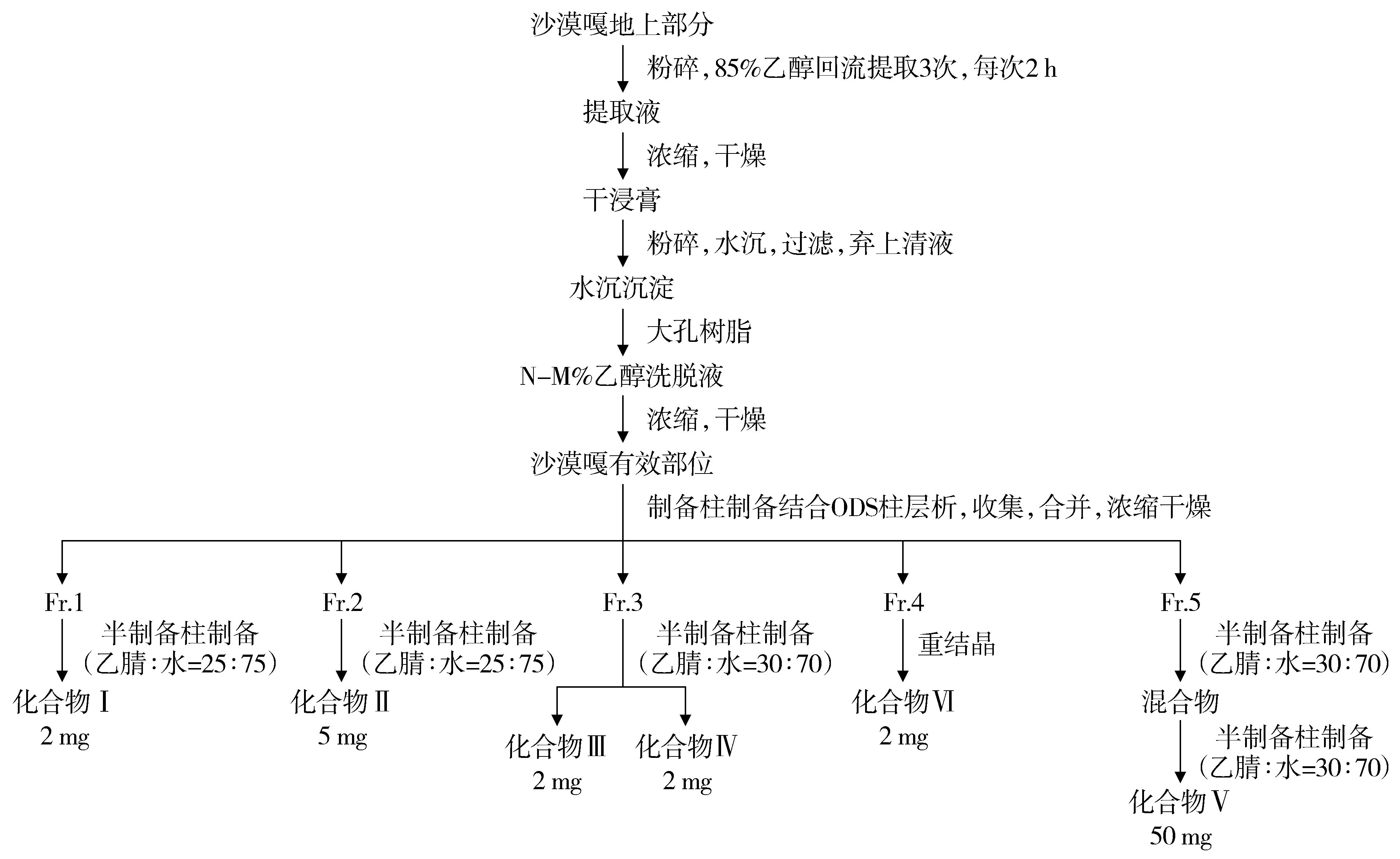
N-M%乙醇洗脱液为先以N%乙醇洗脱,再以M%乙醇洗脱得到的洗脱液
2 结果
共从沙漠嘎中分离并鉴定6个纯度较高的单体化合物,其中前5个化合物为首次从该植物分离得到,化合物Ⅰ~Ⅵ的结构见图3。
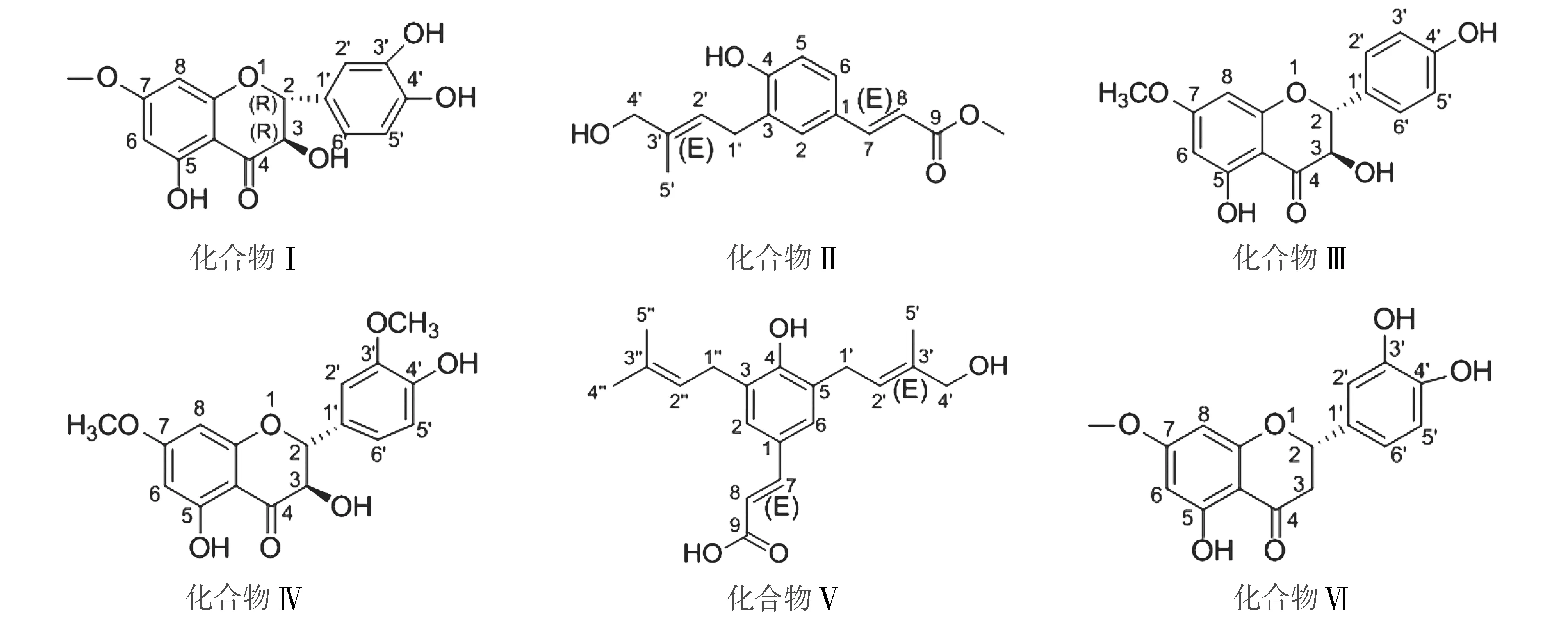
图3 化合物Ⅰ-Ⅵ的化学结构图
2.1 化合物Ⅰ
化合物Ⅰ为淡黄色结晶(甲醇);UV(MeOH)λmax为270 nm。HR-EI-MSm/z[M-H]-:317.062 5,推断其分子式为C16H14O7,不饱和度为10。1H-NMR谱中[δH:8.48]处单峰推测为羟基上的氢信号;[δH:6.84]和[δH:6.79]处两个二重峰的偶合常数为8.23 Hz,推测分别为5′位和6′位的氢信号;[δH:4.93]和[δH:4.52]处两个二重峰的偶合常数为11.34 Hz,推测分别为2位和3位氢信号,且2,3位氢原子互为反式构型;[δH:3.81]处的单峰积分面积对应3个氢,推测为7位甲氧基信号。13C-NMR谱中共观察到16个碳信号,其中[δC:199.0]对应4位碳原子,[δC:147.2,146.4,129.8,121.0,116.1,115.9]位苯环上的碳信号,推测其分别对应4′,3′,1′,6′,2′,5′位的碳原子,[δC:73.8]对应3位碳原子,[δC:85.3]对应2位碳原子,[δC:56.4]为甲氧基上的碳信号。其1H-NMR、13C-NMR及分子量与文献报道[10]基本一致,故将该化合物鉴定为3,5,3′,4′-四羟基-7-甲氧基二氢黄酮(帕得马亭,padmatin)。
2.2 化合物Ⅱ
化合物Ⅱ为无色透明结晶(甲醇),UV(MeOH)λmax为210 nm和296 nm;HR-EI-MSm/z[M-H]-:216.112 1,推断其分子式为C15H18O4,不饱和度为7。1H-NMR谱中[δH:7.59]与[δH:6.30]两处双峰的偶合常数均为15.98 Hz,推测为7位与8位氢信号,且7位与8位之间的双键为反式构型;[δH:7.32]、[δH:7.28]与[δH:6.78]为苯环上的质子信号,分别对应2位、5位、6位氢信号;[δH:5.60]处的三重峰推测为2′位的双键质子信号;[δH:3.97]与[δH:3.36]为2组亚甲基质子信号;[δH:1.76]处单峰为甲基信号。13C-NMR结合无畸变极化转移技术(DEPT)、异核多量子相关谱(HSQC)、异核多键相关谱(HMBC)数据可知共有15个碳信号,包括10个烯碳(1个苯环,2个双键),1个羧基,2个甲基,2个亚甲基。13C-NMR谱图中[δC:169.9]对应羧基上的碳信号;[δC:159.2,131.1,129.6,128.9,127.2,116.3]被推测为苯环的碳信号,分别对应4,2,3,6,1,5位的碳原子,其中[δC:131.1,128.9,116.3]在DEPT 90谱图中有对应峰,证明其所对应的碳与一个氢原子相连,所以分别为2,6,5位的碳原子信号;[δC:68.9]与[δC:28.9]在DEPT 135谱图中为倒峰,可知二者对应两个亚甲基上的碳信号;[δC:52.1]为甲氧基上的碳信号;[δC:13.9]对应甲基上的碳信号。
1H-1H-COSY(同核位移相关谱)数据显示H-7/H-8、H-5/H-6、H-1′/H-2′相关(见图4)。HMBC数据显示H-2、H-5、H-5′与C-1′(δC:28.9)相关,说明苯环与一个亚甲基相连;H-1′、H-4′、H-5′与C-2′(δC:124.6)、C-3′(δC:137.1)相关,说明亚甲基与双键相连;H-5与C-7(δC:147.0)相关,H-7、H-OCH3与C-8(δC:114.7)相关,H-6、H-7与C-1(δC:127.2)相关(见图5),说明苯环与双键相连。
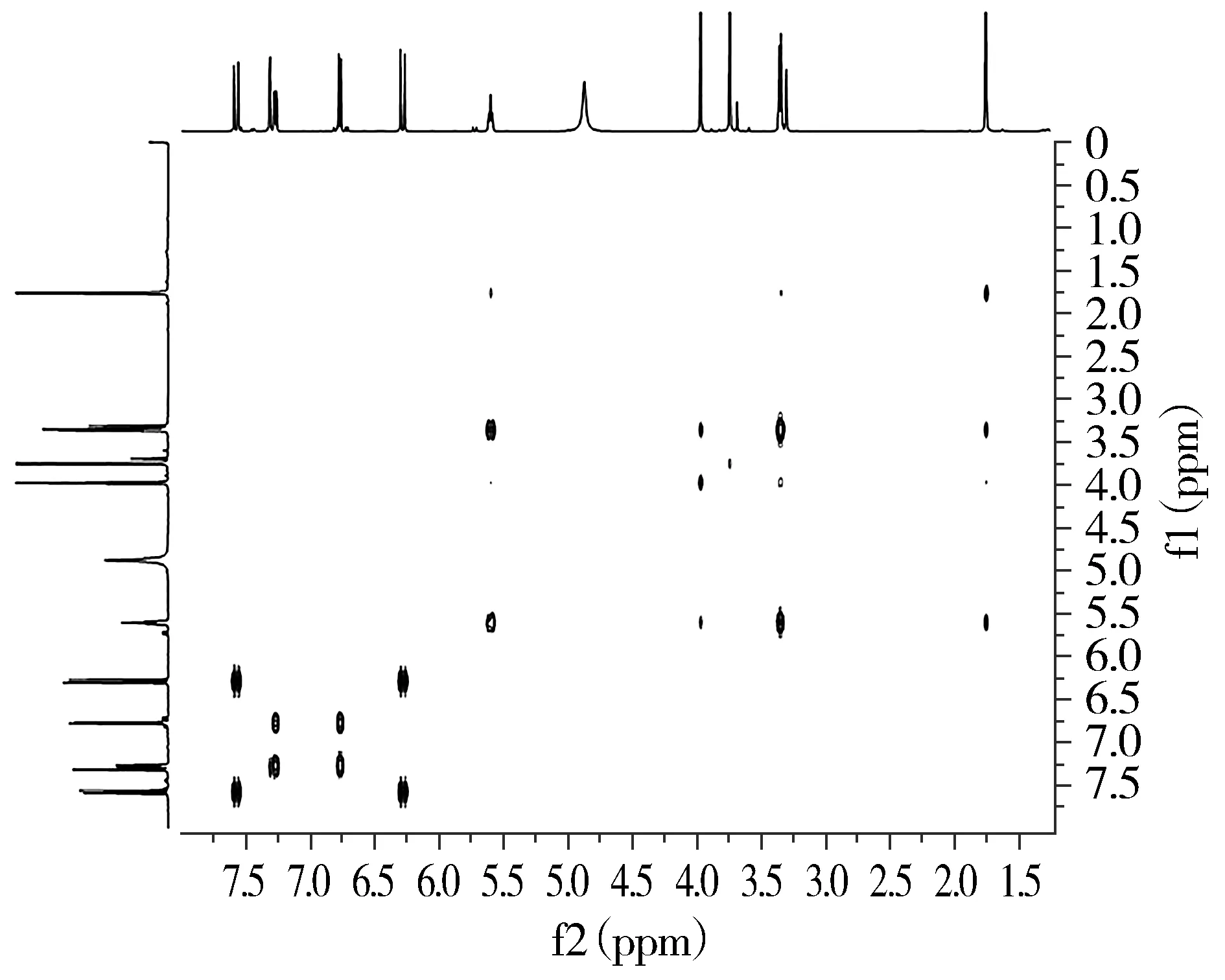
图4 化合物Ⅱ的1H-1H-COSY谱图
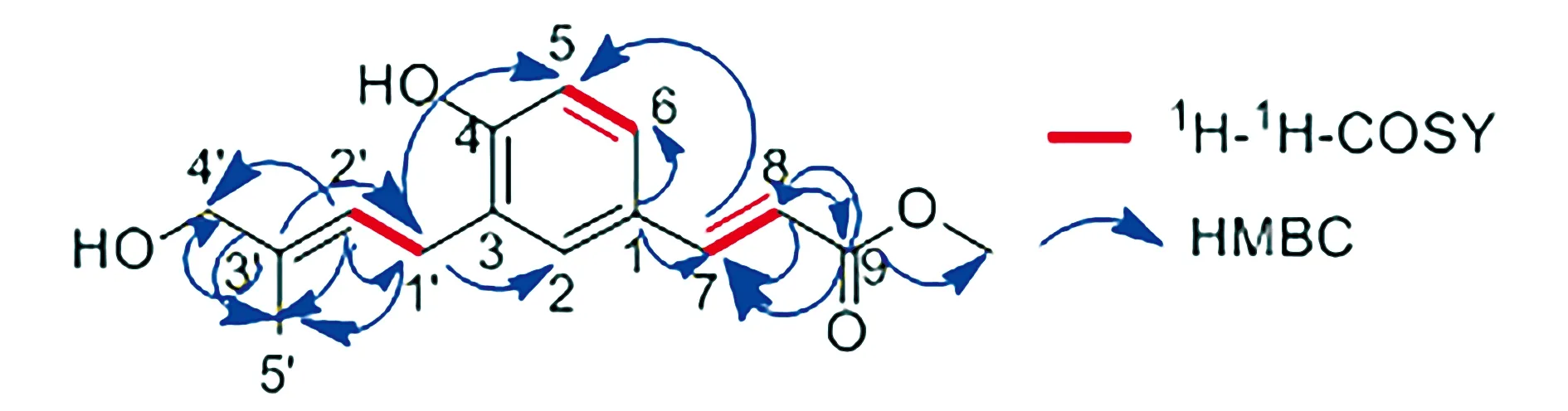
图5 化合物Ⅱ的1H-1H-COSY与HMBC中的主要相关关系
在NOESY谱(二维核奥弗豪泽增强谱)中,照射2′-H(δH:5.60)时4′-H(δH:3.97)、1′-H(δH:3.36)、2-H(δH:7.32)信号有增益;照射4′-H(δH:3.97)时2′-H(δH:5.60)、5′-H(δH:1.76)信号有增益;照射5′-H(δH:1.76)时4′-H(δH:3.97)、1′-H(δH:3.36)信号有增益。因此可证明2′位CH与4′位CH2-OH空间距离较近,二者处于双键同侧,即C-2′与C-3′之间的双键为反式构型(E)。
综合以上信息,将化合物Ⅱ鉴定为甲基-3-(4′-羟苯基)香豆酸,其1H-NMR、13C-NMR及分子量与文献报道[11,12]基本一致。
2.3 化合物Ⅲ
化合物Ⅲ为白色粉末(甲醇),UV(MeOH)λmax为270 nm,HR-EI-MSm/z[M-H]-:301.071 0,推断其分子式为C16H14O6,不饱和度为10。在1H-NMR谱中[δH:7.36,6.84,6.09,6.04]代表苯环上的氢信号,推测[δH:7.36]为2′位、6′位的质子信号;[δH:6.84]为3′位、5′位的质子信号;[δH:6.09]与[δH:6.04]分别为8位、6位的质子信号;[δH:3.81]处的单峰对应甲基上的3个氢原子。在13C-NMR谱中,[δC:199.1]对应4位碳原子,[δC:170.0]为在7位与甲氧基相连的碳原子的信号,[δC:129.2]为3′位、5′位的碳原子信号,[δC:116.2]为2′位、6′位的碳原子信号,[δC:56.4]为甲氧基上的碳信号。综合以上数据,将化合物Ⅲ鉴定为3,5,4′-三羟基-7-甲氧基黄酮,其1H-NMR、13C-NMR及分子量与文献报道[13]基本一致。
2.4 化合物Ⅳ
化合物Ⅳ为淡黄色粉末(甲醇),UV(MeOH)λmax为270 nm,HR-EI-MSm/z[M-H]-:331.081 4,推断其分子式为C17H16O7,不饱和度为10。在1H-NMR谱中,[δH:7.12,6.98,6.84]分别对应苯环上2′位、6′位和5′位的氢信号;[δH:6.09]与[δH:6.05]两处的双峰分别为6位、8位的质子信号;[δH:3.89]与[δH:3.81]两处的单峰分别位甲氧基上的质子信号。在13C-NMR谱共观察到17个碳信号,其中[δC:199.1]对应4位碳原子,[δC:149.0,148.5,129.7,122.3,116.0,112.5]推测为苯环上的碳信号,分别对应4′,3′,1′,6′,5′,2′位的碳原子;[δC:102.7]对应10位碳原子,[δC:56.5]和[δC:56.4]分别为3′位与7位甲氧基上的碳原子信号。综合以上数据,将化合物Ⅳ鉴定为3,5,4′-三羟基-7,3′-二甲氧基黄酮,其1H-NMR、13C-NMR及分子量与文献报道[13]基本一致。
2.5 化合物Ⅴ
化合物Ⅴ为黄白色固体(甲醇),UV(MeOH)λmax为216 nm和296 nm,HR-EI-MSm/z[M-H]-:315.158 7,推断其分子式为C19H24O4,不饱和度为8。在1H-NMR谱中,[δH:7.40]与[δH:6.30]处的双峰分别为7位、8位的质子信号,且两处双峰的耦合常数均为15.76 Hz,因此7位碳与8位碳之间的双键为反式构型(E)。[δH3.97,3.37,3.29]代表亚甲基上的质子信号,故推测其分别对应4′位、1′位和1′′位上的氢信号;[δH:1.76]与[δH:1.71]两处的单峰为甲基质子信号,分别对应5′位、4′′位和5′′位上的氢信号。在13C-NMR谱中观察到18个碳信号,[δC:155.2,131.1,129.7,128.0,127.9]推测为苯环上的碳信号,分别对应4位,5位,1位,3位,6位,2位碳,[δC:26.0,17.9,13.9]为甲基上的碳信号,分别对应4″位,5″位,5′位碳。采用核Overhauser效应法,照射2′-H(δH:5.59)、4′-H(δH:3.97)、5′-H(δH:1.76),无信号增强;照射1′-H(δH:3.38)时5′-H(δH:1.76)信号有增益,故推测2′位与3′位之间的双键为反式构型(E)。
1H-1H-COSY数据显示H-7/H-8、H-1′/H-2′、H-1″/H-2″相关(见图6)。HMBC数据显示H-2、H-6、H-1′、H-1″与C-4(δC:155.0)相关,说明苯环与2个亚甲基相连;H-2、H-6与C-7(δC:143.0)相关,说明苯环还与一个双键相连;H-7、H-8与C-9(δC:170.0)相关(见图7),说明连着苯环的双键还与羧基相连。
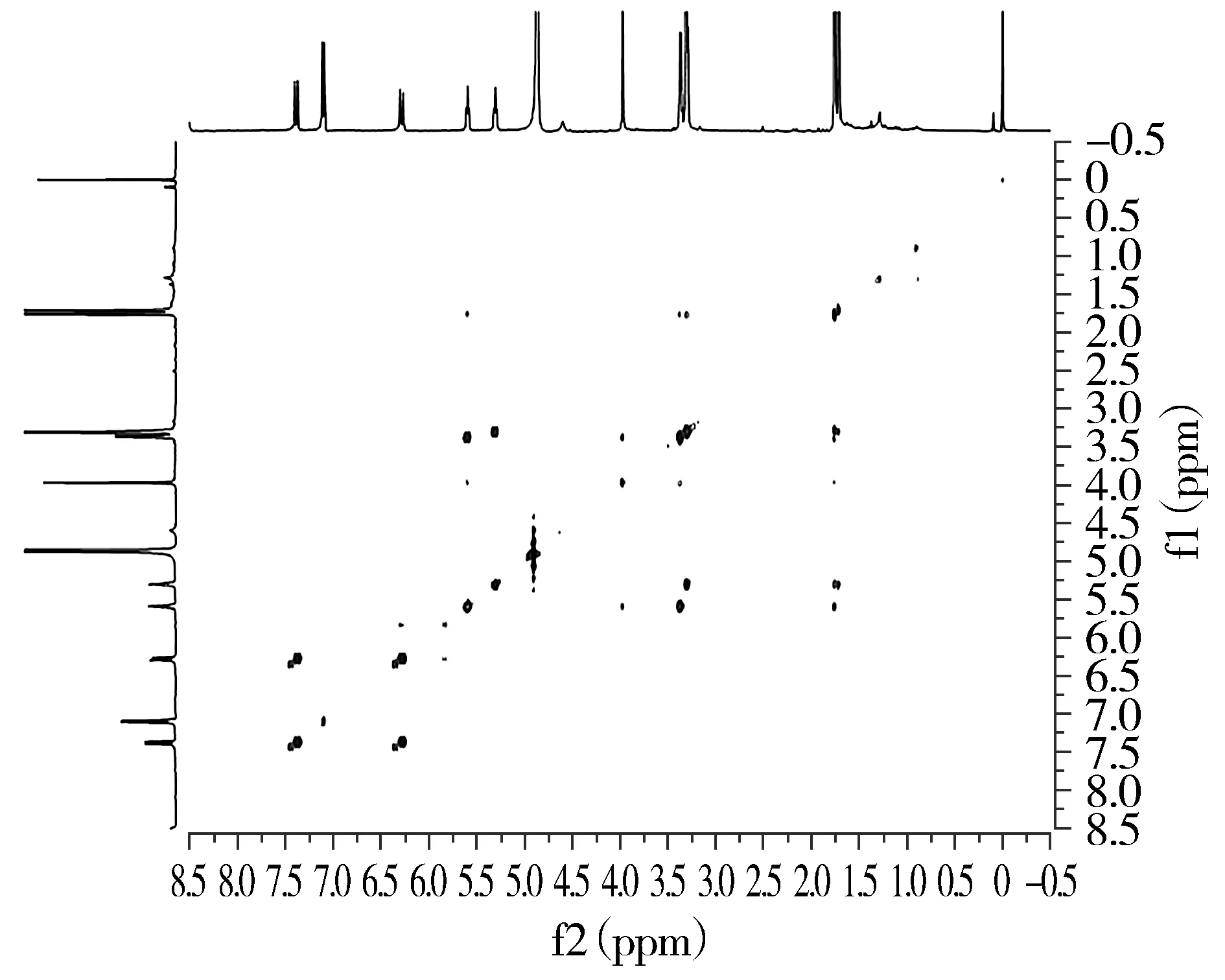
图6 化合物Ⅴ的1H-1H-COSY谱图
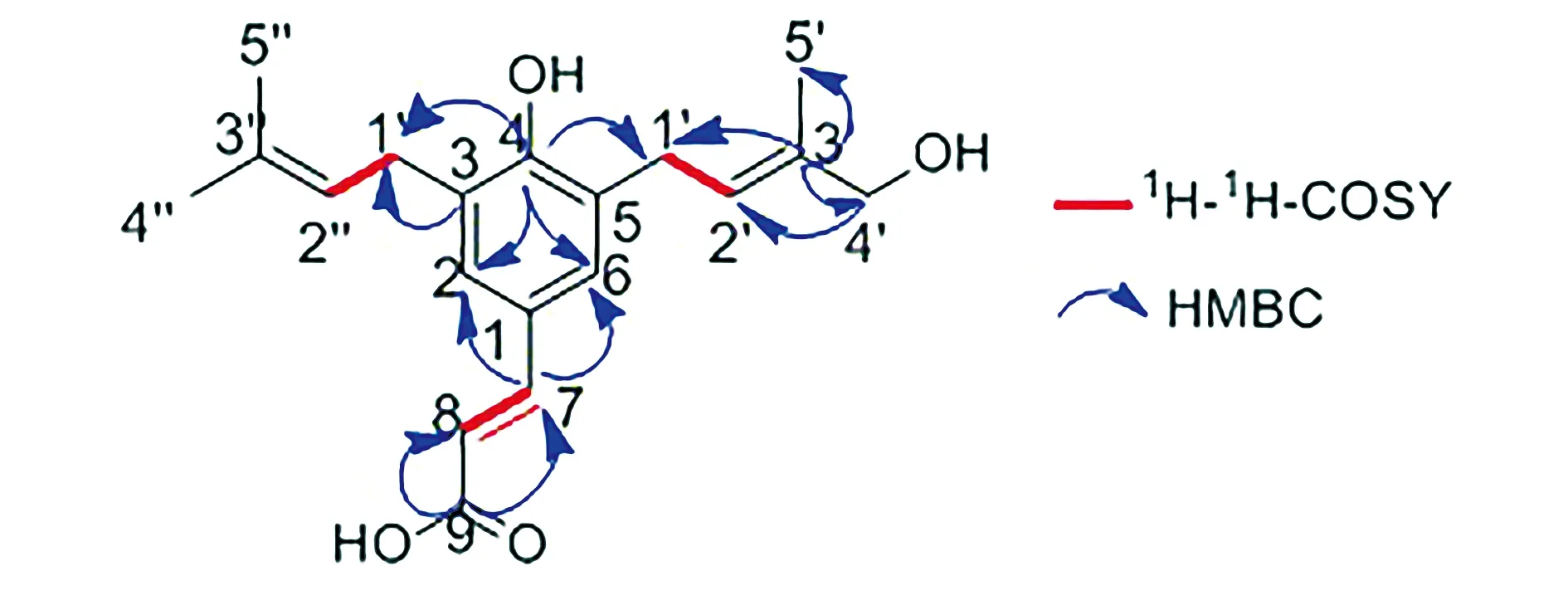
图7 化合物Ⅴ的1H-1H-COSY与HMBC中的主要相关关系
综合以上数据,将化合物Ⅴ鉴定为茵陈蒿香豆酸A,其1H-NMR、13C-NMR及分子量与文献报道[14]基本一致。
2.6 化合物Ⅵ
化合物Ⅵ为淡黄色固体(甲醇),UV(MeOH)λmax为269 nm;结合1H-NMR、13C-NMR数据,确定其分子式为C16H14O6,不饱和度为10。在1H-NMR谱中,[δH:6.05]与[δH:6.03]处的双峰分别为6位、8位的质子信号;[δH:3.13、2.74]代表亚甲基上的质子信号,故推测其对应3位的氢信号;[δH:3.80]处的单峰为甲氧基上的质子信号。在13C-NMR谱中观察到16个碳信号,其中[δC:147.0,146.6,131.7,119.3,116.3]推测为苯环上的碳信号,分别对应4′位、3′位、1′位、6′位、5′位、2′位碳;[δC:169.6]为与甲氧基相连的碳的信号,对应7位碳;[δC:56.3]为甲氧基上的碳信号。综合以上数据,将化合物Ⅵ鉴定为圣草酚-7-甲醚,其1H-NMR、13C-NMR信息与文献报道[15]基本一致。
3 讨论
高效制备液相色谱法适用于分离复杂的中药组分中的有效成分,尤其适用于对目标成分的分离富集。本研究在采用高效制备液相分离之前先采用柱层析方法对样品进行了处理,同时也结合了反相ODS柱层析法富集不同组分样品,实验结果表明高效制备液相色谱法结合ODS柱层析法能更好地提高制备效率,更快地获得目标成分。
在实验中考察了样品的进样量对高效制备液相色谱分离效果的影响,发现样品的进样体积对色谱峰的分离效果存在一定影响,针对不同的色谱柱,可通过适当调节样品浓度,适当减少进样体积来得到最佳分离效果,提高制备效率。本研究在确定制备液相的色谱条件之前先通过分析型液相色谱优化流动相条件,再通过线性放大原理放大至制备色谱过程,进而确立制备液相的色谱条件,在提高效率的同时也可以减少样品与流动相的损失,降低实验成本。
本研究从沙漠嘎中分离得到6个化合物,分别鉴定为帕得马亭、甲基-3-(4′-羟苯基)香豆酸、3,5,4′-三羟基-7-甲氧基黄酮、3,5,4′-三羟基-7,3′-二甲氧基黄酮、茵陈蒿香豆酸A和圣草酚-7-甲醚,其中前5个化合物为首次从该植物分离得到,可基于本研究分离鉴定出的化学成分进一步开展沙漠嘎抗哮喘药效作用机制研究,包括活性成分的筛选、药效模型的验证等,研究结果也可为沙漠嘎多指标质量控制方法的建立提供参考,为沙漠嘎的进一步研究与临床开发应用奠定了基础。

