基于网络药理学和分子对接探讨“寒凉”中药黄连、黄芩、黄柏治疗痴呆的作用机制
高书春,唐瑞欣,赵 洋,邓雪阳,浮 姣*
(1西安交通大学第一附属医院内分泌代谢科,西安 710061;2中国药科大学中药学院;*通讯作者,E-mail:jiao_fu@xjtufh.edu.cn)
痴呆症(dementia)是一种表现认知障碍且逐渐失去独立生活能力的综合征,它逐步影响人们的记忆、思维、学习、语言、社交等能力[1]。阿尔兹海默症(Alzheimer’s disease,AD)是痴呆症最常见的病因,约占60%~70%[2]。除此之外,痴呆症的类型还包括血管性痴呆(vascular dementia,VD)、路易体痴呆(dementia with Lewy bodies,DLB)[2]、额颞叶痴呆(frontotemporal lobar dementia,FTLD)、帕金森病性痴呆(parkinson disease,PD)等。据统计,全世界大约有5 000万人患痴呆症,预测到2030年将达8 200万人,其中近60%生活在低收入和中等收入国家[2]。由于痴呆症的类型复杂、发病机制多样,甚至同一患者可同时存在多种痴呆类型[2,3],采用西药治疗常难以实现预期疗效,因此以中医传统学说,基于中医基础理论,从中药具有“共同药性”的优势切入,探索一种针对痴呆症共同特点的“多成分—多靶点”的治疗方式具有重要的临床意义。
传统中医认为痴呆症属“呆病”“健忘”,痴呆症虽病发于脑,却涉及心、肝、脾、肺、肾、胃等脏器,并认为其病理涉及虚、瘀、痰、气、火等诸要素[4,5]。金元四大医学家之一的刘完素,为“寒凉派”的创始人,其“火热病机学说”“玄府学说”等中医基础理论对中药治疗痴呆症有重要的指导意义。刘完素认为玄府遍布全身,承“气液宣通”之功。如玄府幽闭于脑,则气液运行不舒,反生痰、热等毒,导致髓海损伤,神机郁滞,则生痴呆症[6]。明代医家张景岳也认为“痴呆证,凡平素无痰,而或以郁结”,而当前研究也认为“痰瘀阻滞”是痴呆症的病因之一[5]。并且传统中医认为“气郁化火”会扰神伤志,传盛于金元时期的“郁火理论”有玄府不通之郁火、痰瘀阻滞之郁火等分别,适时“寒凉派”对采用“火郁发之”的治法也有新的阐述[7]。《宣明论方》是刘完素极具代表性的著作,金元时期在北方广为流传,其中涉及多种寒凉中药,黄芩(ScutellariabaicalensisGeorgi,HQ)、黄连(CoptischinensisFranch,HL)、黄柏(PhellodendronchinenseSchneid,HB)统称“三黄”,其性味苦寒,均有清热燥湿、泻火解毒的功效,是以刘完素为代表的“寒凉派”常用的中药。
本课题组前期研究发现黄芩苷可调节PI3K/AKT/FoxO1通路改善神经炎症,从而缓解痴呆症症状[8-10]。以黄连解毒汤(黄芩、黄连、黄柏、栀子组方)治疗老年性痴呆,不仅临床效果显著,实验研究也有深入且可喜的成果[11-14]。因此,基于中医基础理论,采用数据挖掘和网络药理学结合的方式研究“寒凉”中药“三黄”治疗痴呆症这样复杂的疾病,不仅为治疗痴呆症开辟新的应用前景,也有益于中医药的现代化发展。
1 材料与方法
1.1 治疗痴呆症的中药筛选
“三黄”的筛选流程,首先阅读《宣明论方》全书,共15卷,治病各方350首,筛选与“痴呆症”病因相关的内容,其中“热门”“劳门”符合“痴呆症”的病因,统计其药方(共24首方剂,76味中药),进行中药频次分析(包括黄柏4次、木香5次、甘草5次、川穹5次、牵牛子6次、黄连8次、黄芩11次及大黄12次)。最后,筛选符合“寒凉”属性并且是治疗“痴呆症”的常见中药,包括黄芩、黄连及黄柏。
1.2 活性成分的收集及靶点的筛选
根据最新发布的《网络药理学评价方法指南》进行后续的网络药理学分析[15]。中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)有翔实的数据可综合分析中药的成分、靶点及ADME(吸收、分布、代谢和排泄)性质等信息[16],本研究利用TCMSP数据库收集黄芩、黄连、黄柏的成分,然后以三味药ADME性质中的口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18筛选活性成分。同时在TCMSP库中收集药物靶点,对该库中未查找到靶点的成分,利用Pubchem库查询该成分的简化分子线性输入规范(simplified molecular input line entry system,SMILES)号或结构数据文件(structure data format,SDF),并在SwissTargetPrediction库中预测其靶点。为便于后续的实验分析,需将靶点蛋白统一转化为基因名(gene name),利用UniProt、DrugBank库查询后统一规范。痴呆症靶点的收集通过GeneCards、DigSee、DisGeNET、DrugBank、OMIM、Therapeutic Target Database数据库,以“dementia”为关键词检索,将上述数据库所得靶点进行合并去重,获得痴呆症的靶点。
1.3 构建药物-成分-靶点网络及PPI分析
将上述筛选出的活性成分与其靶点,利用Cytoscape3.7.2构建“药物-成分-靶点”网络。将黄芩、黄连、黄柏及痴呆症筛选后的靶点导入VENNY2.1网站(https://bioinfogp.cnb.csic.es/tools/venny),获得黄芩、黄连、黄柏及痴呆症的交集靶点。利用STRING11.0构建蛋白质互作网络(protein-protein interaction networks,PPI),交集靶点上传STRING网站后,选择“最低要求的互动分数”(minimum required interaction score)为“high confidence(0.7)”,其他设置保持默认,最后导出TSV文件,再利用Cytoscape3.7.2中NetworkAnalyzer以及插件CytoNCA分析PPI网络,筛选PPI中重要靶点[17]。
1.4 GO功能与KEGG通路富集分析
对“三黄”及痴呆症的交集靶点PPI分析,所得的核心靶点进行基因本体(gene ontology,GO)功能与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,利用Metascape库对核心靶点进行GO和KEGG分析。获得KEGG通路、分子功能(molecular functions,MF)、细胞组成(cellular components,CC)、生物过程(biological processes,BP),最后查询文献筛选所得结果,并用GraphPad Prism7可视化。
1.5 药物-成分-靶点-通路-疾病网络构建
将核心靶点、KEGG核心通路、“三黄”成分导入Cytoscape3.7.2,构建“三黄”药物-成分-靶点-通路-疾病网络,用Cytoscape3.7.2中NetworkAnalyzer以及插件CytoNCA分析网络。
1.6 分子对接
利用Auto Dock(一种分子建模模拟软件)进行半柔性对接,以反向验证“三黄”活性成分与核心靶点之间的关系。此外,分子对接也有虚拟筛选的作用。根据上述所得的活性成分、核心靶点,筛选后进行分子对接,在TCMSP中获得活性成分的mol2结构;在蛋白质结构数据库(protein data bank,PDB)中检索核心靶点,选择晶体结构分辨率高的蛋白晶体结构,并保存为pdb格式文件。首先用Auto Dock Tools 1.5.6处理活性成分为配体,主要进行加氢、计算电荷;处理核心靶点蛋白结构为受体,进行加氢、去水、计算电荷,并设置Atoms为Assign AD4 type,配体、受体文件保存为pdbqt格式。采用拉马克遗传算法准备docking文件,进行半柔性对接。最后用pymol 2.4.1进行分子对接可视化展示。
2 结果
2.1 “三黄”活性成分、靶点的筛选结果以及成分-靶点网络
利用TCMSP对“三黄”活性成分收集筛选共获得:黄芩36个活性成分,黄连14个活性成分,黄柏37个活性成分,其中彼此重复成分有12个(见表1)。对“三黄”进行预测的靶点显示,黄芩有220个靶点,黄连222个靶点,黄柏368个靶点。痴呆症靶点经上述数据库检索,最终各个数据库合并去重后,获得6 375个痴呆症靶点。对“三黄”活性成分-靶点构建作用网络,其中有553个节点,897条边(见图1)。

黄色节点代表药物(HB:黄柏;HL:黄连;HQ:黄芩),绿色节点代表靶点,其他颜色代表成分
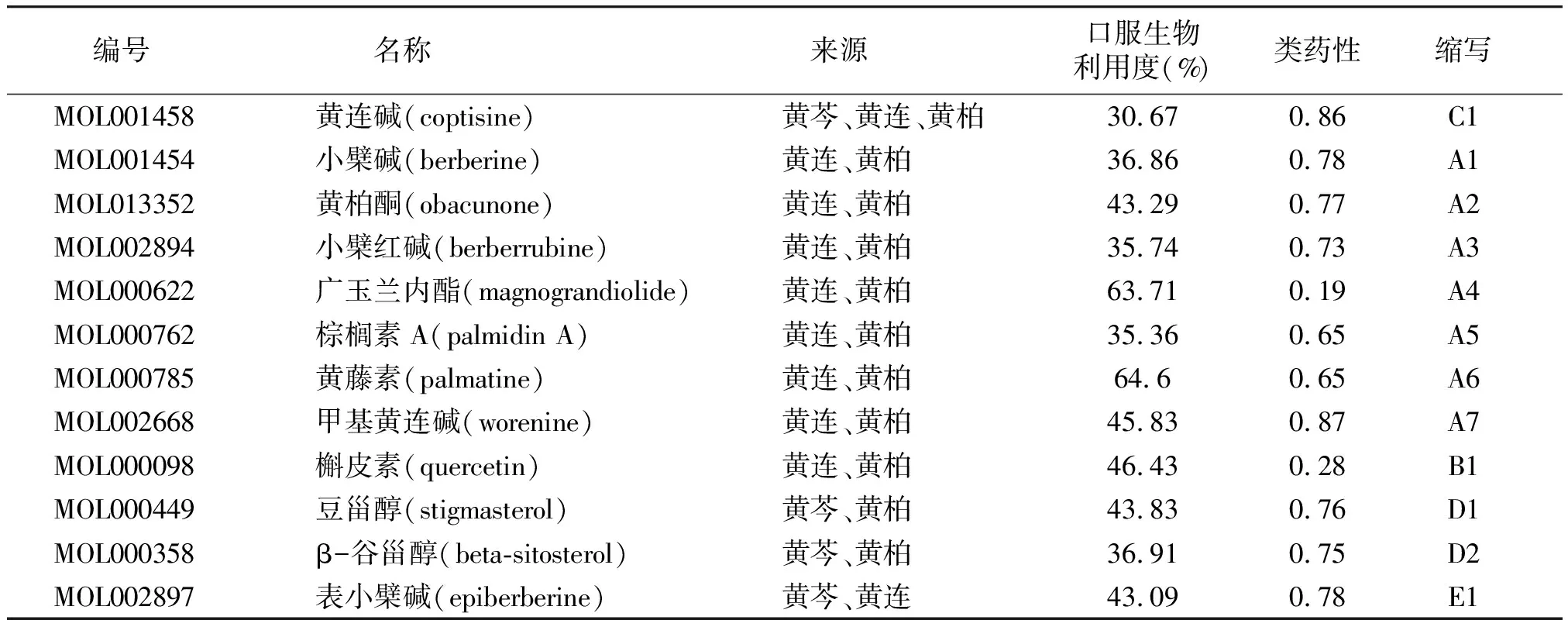
表1 黄芩、黄连、黄柏中彼此重复的活性成分信息
2.2 “三黄”治疗痴呆症的核心靶点及PPI分析结果
将“三黄”的靶点和痴呆症靶点,导入VENNY2.1,可视化后见图2。可见交集靶点有86个,将其导入STRING11.0分析,选择最低要求的互动分数为0.7后,筛选出80个核心靶点,分别为:TP53、AKT1、IL6、JUN、TNF、EGFR、VEGFA、MMP9、HSP90AA1、CXCL8、CCND1、PTGS2、FOS、CASP3、ESR1、MMP2、CCL2、NOS3、RELA、AR、PPARG、MMP1、TGFB1、CDKN1A、NOS2、CASP8、CHRM2、RXRA、HIF1A、MMP3、ESR2、CYP1A1、CCNB1、CASP9、IGF2、CDK2、PPARA、AHR、BCL2、NCOA2、PTGER3、OPRM1、CHRM1、BAX、MPO、CHEK1、OPRD1、CNR2、CHRM4、ADRB2、HTR2A、F3、ADRA1B、HSD11B1、CHRM3、DRD1、CYP1A2、PTGS1、NR3C2、CALM1、TOP1、PLAU、PRSS1、ALOX5、BCHE、PON1、GABRA2、NQO1、SLC6A4、ABCG2、AHSA1、PIK3CG、BACE1、MAOB、PIM1、XDH、F7、GABRA1、KCNH2、PPARD。
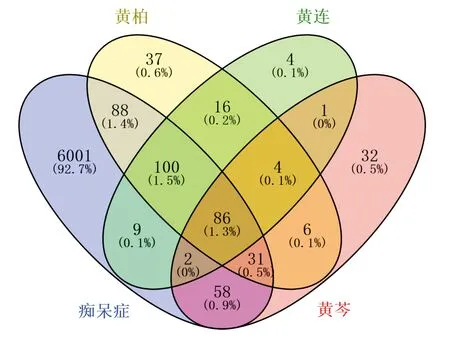
图2 “三黄”与痴呆症靶点交集韦恩图
导入Cytoscape3.7.2制作可视化网络图,含80个节点,380条边(见图3)。并用插件CytoNCA分析PPI网络,以Betweenness、Closeness、Degree的中位数25.1,0.4,7筛选PPI中重要的靶点31个。其中前20个靶点为:TP53、AKT1、IL6、JUN、TNF、EGFR、VEGFA、MMP9、HSP90AA1、CXCL8、CCND1、PTGS2、FOS、CASP3、ESR1、MMP2、CCL2、NOS3、RELA、AR。
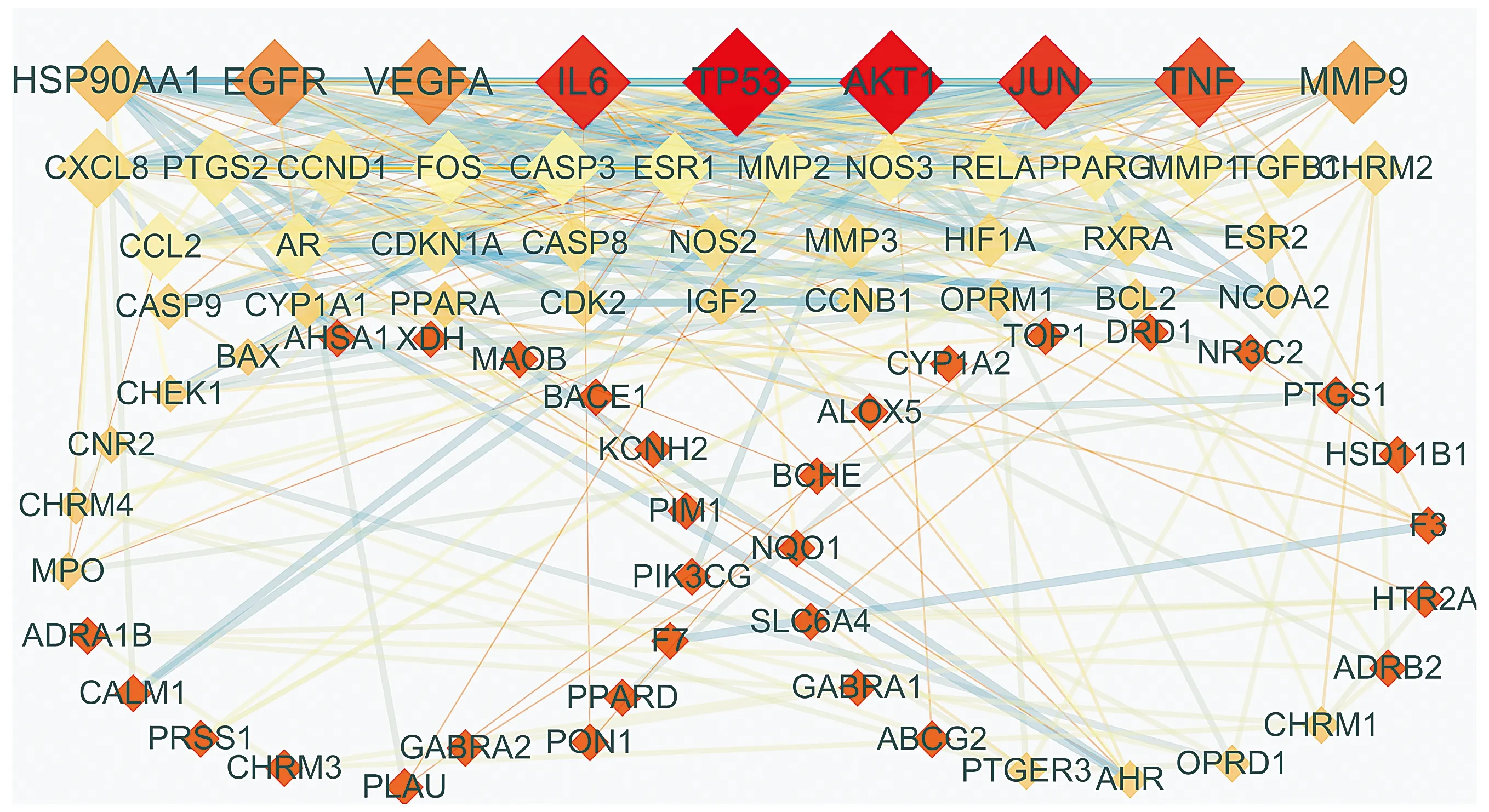
节点面积越大,度值越大;颜色越深,度值越大;面积越大颜色越深表示该靶点越重要;连线越粗,关联性越大
2.3 核心交集靶点的GO和KEGG分析结果
将80个核心靶点导入Metascape进行GO和KEGG分析后,结果显示具有研究意义的KEGG通路129条,GO功能中MF 117条,CC 61条,BP 1 366条。KEGG通路分析结果中,据P值筛选与痴呆症相关的前20条,主要有:AGE-RAGE信号介导的糖尿病并发症通路(AGE-RAGE signaling pathway in diabetic complications)、内分泌抵抗(endocrine resis-tance)、磷脂酰肌醇3激酶-蛋白激酶B信号通路(PI3K-Akt signaling pathway)、钙信号通路(calcium signaling pathway)、IL-17信号通路(IL-17 signaling pathway)、TNF信号通路(TNF signaling pathway)、神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)、p53信号通路(p53 signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)等(见图4)。
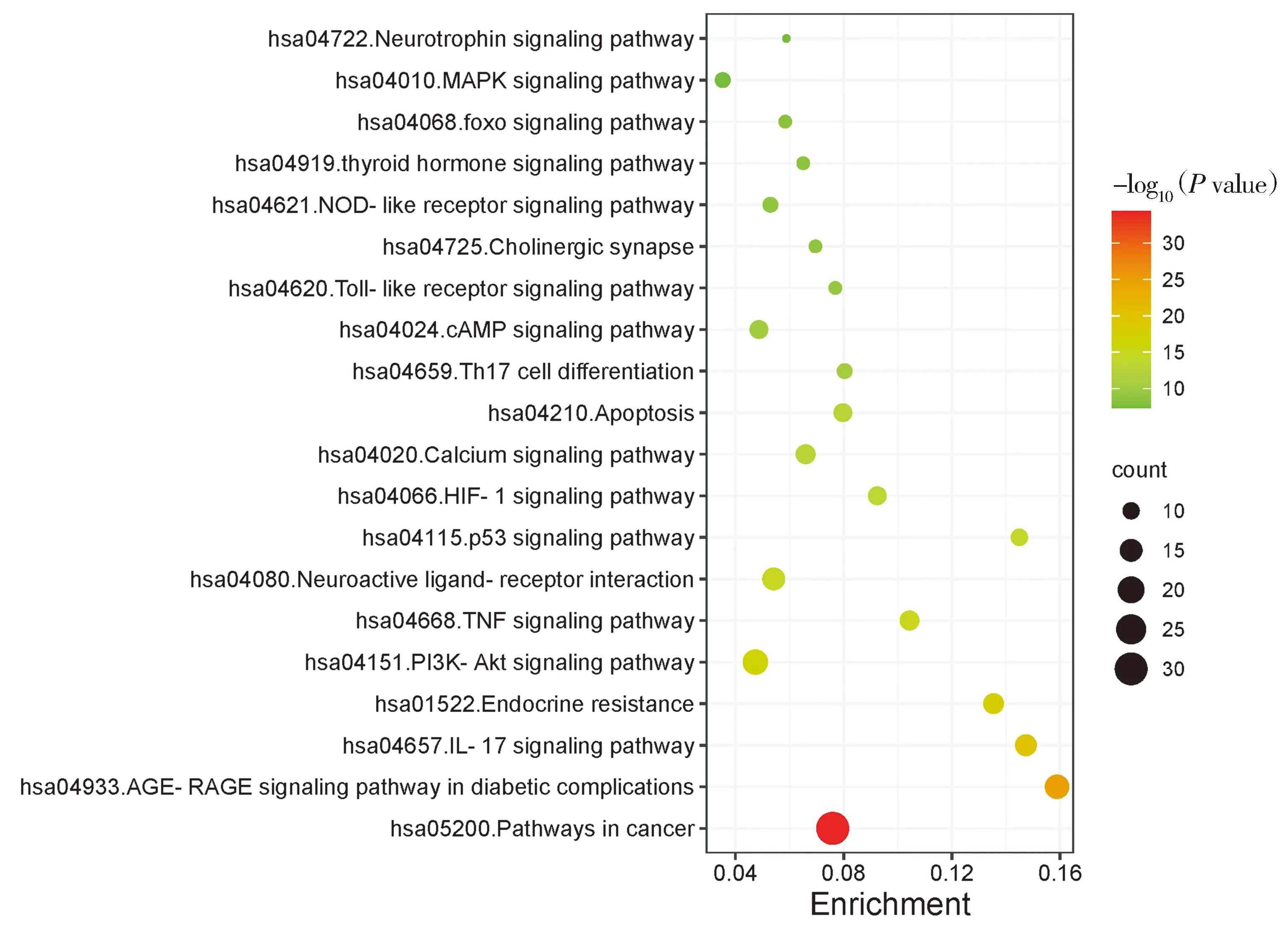
图4 “三黄”治疗痴呆症的KEGG通路
GO功能分析中,主要包括:配体激活转录因子活性(ligand-activated transcription factor activity)、一氧化氮合酶调节活性(nitric-oxide synthase regulator activity)、DNA结合转录因子结合(DNA-binding transcription factor binding)、G蛋白偶联胺受体活性(G protein-coupled amine receptor activity)等分子功能;膜微区(membrane microdomain)、枝晶(dendrite)、树突树(dendritic tree)、突触后膜(postsynaptic membrane)等细胞组成;对药物的反应(response to drug)、活性氧代谢过程(reactive oxygen species metabolic process)、对脂多糖的反应(response to lipopolysaccharide)、炎症反应(inflammatory response)等生物过程(见图5)。
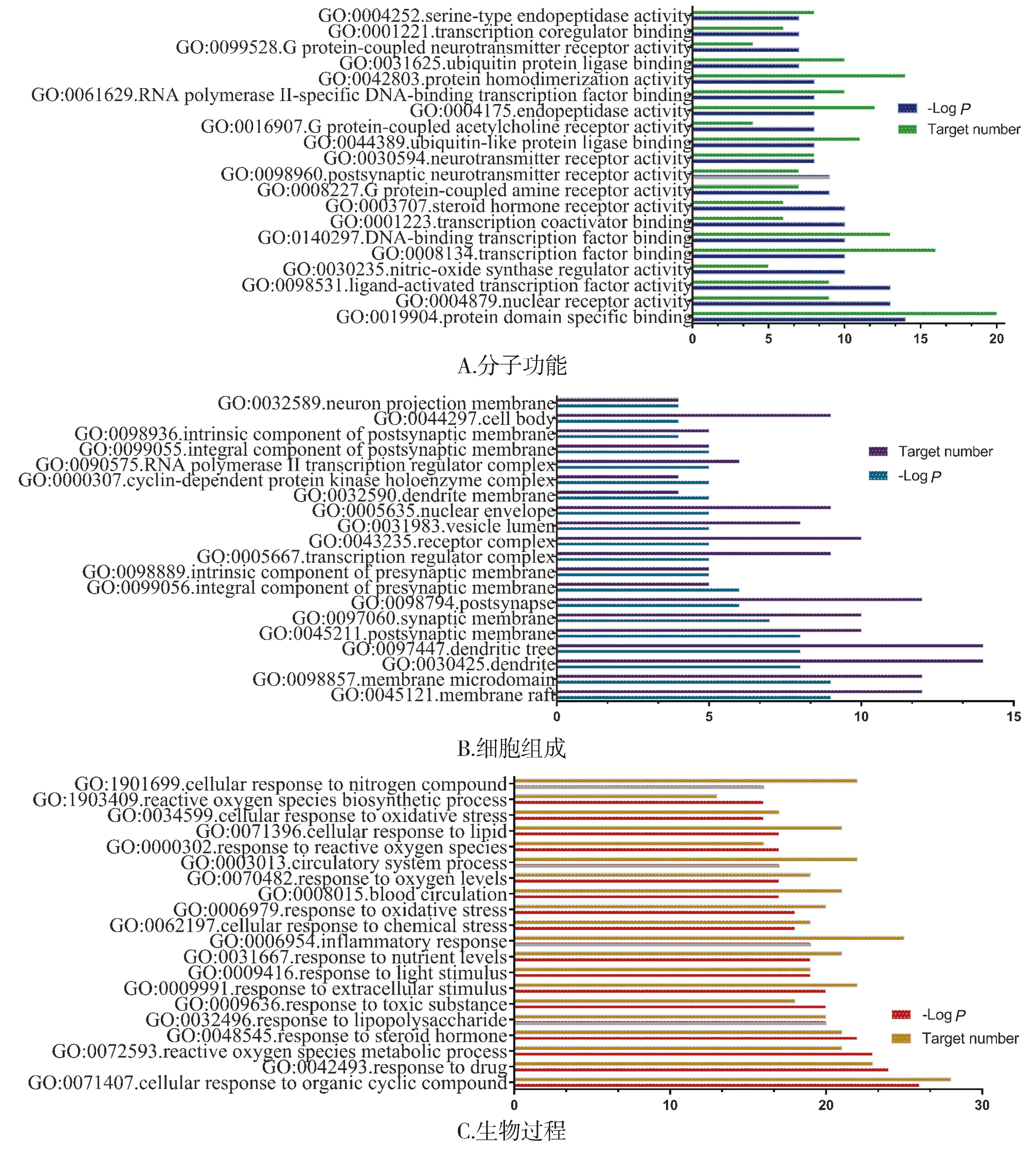
图5 “三黄”治疗痴呆症的GO功能分析
2.4 “三黄”药物-成分-靶点-通路-疾病网络
KEGG通路分析后,筛选与痴呆症相关的前20条通路,收集通路上富集的靶点,然后构建“三黄”成分-靶点-通路-疾病网络(见图6)。用Cytoscape3.7.2中NetworkAnalyzer以及插件CytoNCA分析网络,度值靠前的成分有槲皮素、β-谷甾醇、汉黄芩素、棕榈素A、小檗碱、黄连碱,其中,除汉黄芩素外,均为互相重复成分(见表1)。degree值排名较高的靶点有AKT1、IL6、JUN、MAPK14、FOS、TNF、PRKCA、VEGFA等。
2.5 分子对接结果
根据“药物-成分-靶点”网络以及“药物-成分-靶点-通路-疾病”网络中的degree值,筛选出活性成分槲皮素、β-谷甾醇、汉黄芩素、棕榈素A、小檗碱、黄连碱、黄柏酮、豆甾醇、角鲨烯、烛毒素A、阿魏酰酪胺、5,2′-二羟基-6,7,8-三甲氧基黄酮,根据PPI网络及“药物-成分-靶点-通路-疾病”网络筛选的核心靶点,本研究选取TP53、AKT1、IL6、JUN、TNF、EGFR、TOP1、ESR1、CDK2、AR、RELA、FOS、HSP90AA1等靶点进行分子对接,具体结合能情况见表2,所选取成分与靶点全部对接成功。其中小檗碱、黄连碱、黄柏酮、豆甾醇、β-谷甾醇、汉黄芩素与核心靶点对接效果好,普遍结合能小,结合活性高;而角鲨烯、烛毒素A等与核心靶点结合效果较差,结合能较高,结合活性差。选取部分可视化结果进行展示,结果见图7。
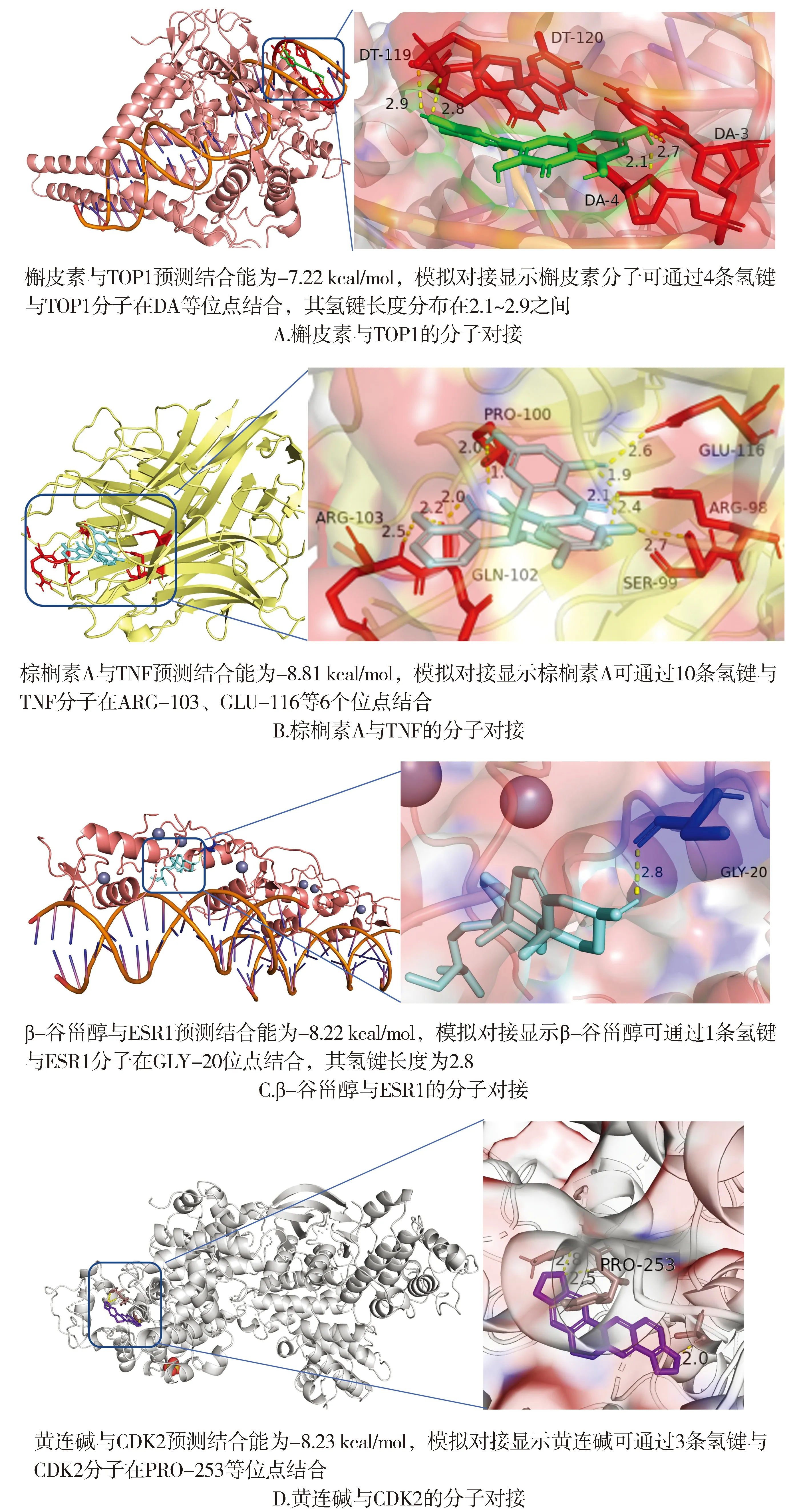
图7 部分核心靶点的分子对接图
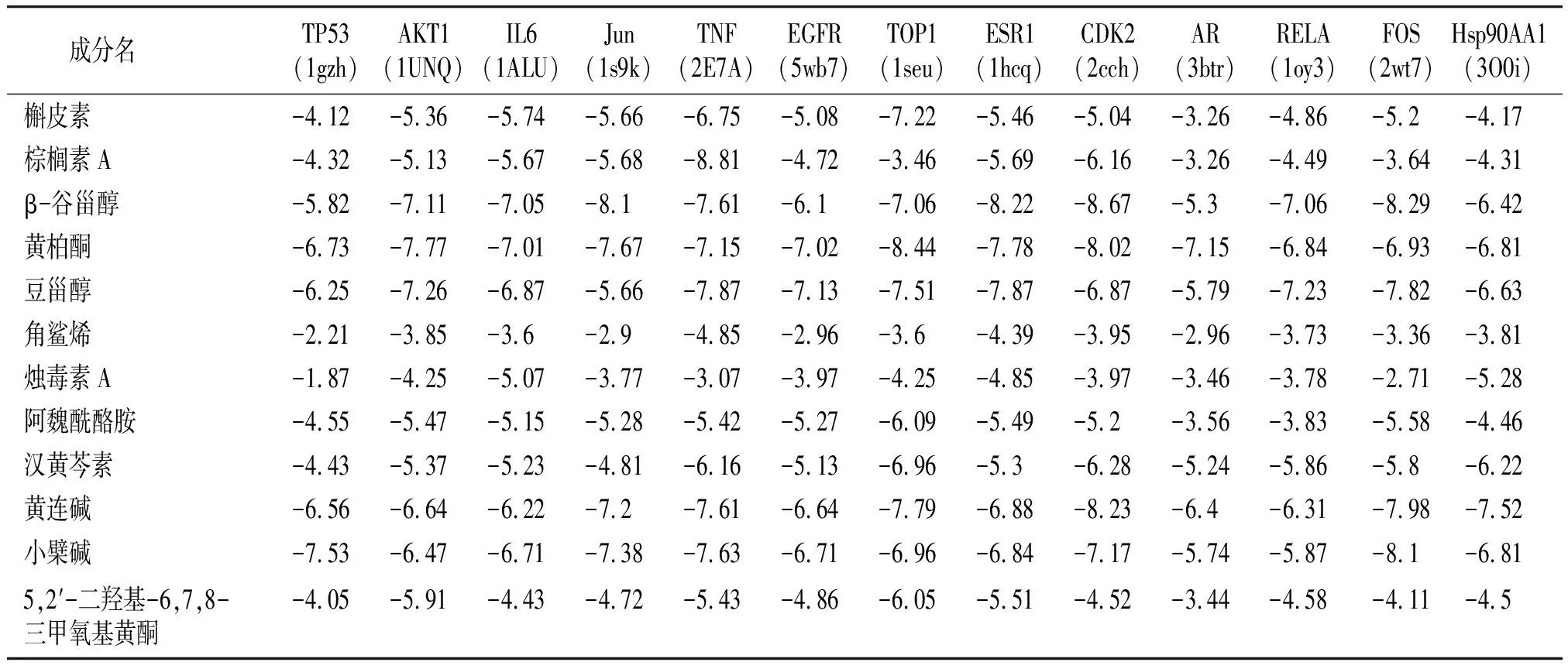
表2 核心靶点的分子对接结合能
3 讨论
当前对痴呆症的研究中,在临床病理等方面已取得很大进展,但对大多数痴呆仍然难以解释所有潜在的病因[1],这也体现了由多种病理引起的痴呆症所表现出的“复杂性”。“三黄”作为寒凉药的代表,本研究希望结合中医基础理论,以网络药理学的方式来挖掘其代表的“药性”优势,探索其治疗痴呆症的分子机制。黄芩的不同提取物可改善慢性神经炎症导致的认知缺陷、神经损伤等[18-20]。黄连可改善认知障碍,主要是其具有显著的抗炎和抗氧化应激活性,可抑制Tau和Aβ蛋白沉积及神经元凋亡[21]。包含黄连、黄柏、栀子的改良中药制剂对预防和治疗AD呈现出一定的效果,而且从黄连中提取出的小檗碱可抑制淀粉样细胞的代谢过程,对于预防或延缓痴呆类疾病十分重要[22,23]。黄连中提取物总生物碱和多糖可缓解认知障碍,起到神经保护的作用[24,25]。黄柏可抑制糖原合成酶激酶-3(glycogen synthase kinase-3-beta,GSK3β)的磷酸化,从而抑制Aβ蛋白沉积,是一种治疗AD的有效方法[26]。另外黄柏可通过抑制细胞凋亡起到神经保护的作用[27]。对于“三黄”的临床研究,主要集中在黄连解毒汤,其由黄芩、黄连、黄柏、栀子组方在治疗痴呆类型疾病的临床研究上疗效显著,受到广泛关注[14,28-31]。
本研究对“三黄”活性成分的分析筛选中,发现涉及多种重要活性成分。槲皮素(quercetin,QT)可以通过增加AMPK活性、提高ATP水平并减少ROS的产生,来减少AD中的Aβ斑块[32];QT可以激活MAPK信号通路,并通过降低Aβ蛋白、Tau蛋白水平,以抑制FOXO信号通路中的细胞周期蛋白,并降低NF-κB活性,达到改善痴呆症的目的[33]。QT结合钠离子形成盐,还可以增强小胶质细胞介导的Aβ蛋白清除作用,减轻神经炎症、改善突触可塑性损伤,达到改善空间学习能力和记忆缺陷的目的[34]。β-谷甾醇可以防止淀粉样蛋白的积累,促进神经突生长和细胞体中神经丝的表达[35,36]。小檗碱在AD模型的体内体外实验中均表现出抗炎活性,研究发现小檗碱能够通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/p70S6K信号的失调和自噬降解途径的激活来抑制不溶性TDP-43(TAR DNA binding protein-43)聚集体的形成[37],其还可降低由Aβ激活的小胶质细胞导致的IκBα的磷酸化[38]。黄连碱可以抑制小胶质细胞和星形胶质细胞的激活,减少淀粉样蛋白斑块的形成,从而起到保护神经、改善认知障碍的作用[39]。豆甾醇可以通过降低β-分泌酶活性,降低所有γ-分泌酶成分的表达,从而减少Aβ蛋白的生成[40]。在本研究的KEGG分析中,也体现了这些活性成分作用方式所涉及的MAPK信号通路、NF-κB信号通路、P53信号通路等。
本研究通过PPI分析及“药物-成分-靶点-通路-疾病”网络筛选出核心靶点。其中肿瘤蛋白(tumor protein P53,TP53)参与痴呆症可能是其他蛋白质异常激活导致的,P53通过与痴呆症相关的关键蛋白质相互作用促进神经退行性病变,其过度表达与神经元的死亡有关[41,42]。正常的pT308AKT1与Aβ蛋白负荷和Tau缠绕密度呈正相关[43]。人载脂蛋白E4(ApoE4)是AD的重要遗传风险因素,它的激活可以形成级联反应,最终激活的ERK1/2会诱导cFos磷酸化,刺激JUN的生成,进而增加Aβ蛋白的水平[44]。IL6、TNF在痴呆症中主要是导致炎症的发生,现阶段研究发现抑制其表达可能会导致自噬的增多,这有益于对痴呆症的治疗[45,46]。抑制TOP1可以增加痴呆小鼠的脑重量,缓解其痴呆症状[47]。Aβ蛋白诱导的c-Fos和O-GlcNAcase相互作用减少会促进神经元细胞死亡[48]。有大量实验证据表明雌激素具有神经保护的作用,雌激素受体1(estrogen receptor 1,ESR 1)存在于与痴呆症相关的大脑边缘区域,并且在痴呆症产生的风险方面ESR1和ESR2的多态性之间存在明显的相互作用[49]。
本研究对“三黄”治疗痴呆症进行GO和KEGG分析,筛选出的通路中,p53通路的促凋亡作用与多种神经退行性疾病有关,氧化应激等导致的细胞损伤会导致核仁应激、p53和p53依赖性细胞周期停滞等[50]。钙信号通路可调节神经元细胞系,其中与星形胶质细胞相关的基因和通路以细胞自主和非细胞自主方式受钙信号调节[51,52]。痴呆症中的AD是糖尿病最常见的一种并发症,在AGE-RAGE信号介导的糖尿病并发症通路中,Aβ蛋白是糖基化的合适底物,可产生AGEs,糖基化通过RAGE的上调会加剧Aβ蛋白的神经毒性,而抑制Aβ-AGE会改善痴呆症状[53]。髓系细胞触发受体2(triggering receptor expressed on myeloid cells-2,TREM2)是一种在小胶质细胞中表达的先天免疫受体,被大家熟知的是其对痴呆症造成的炎症和神经元损伤可起到保护作用,而TREM2正是通过PI3K/Akt信号通路促进小胶质细胞存活,并对痴呆症造成的炎症做出反应和对认知障碍起到缓解作用[54,55]。IL-17、TNF信号通路主要是通过炎症来影响痴呆症,抑制该通路可以很好地缓解痴呆症,现阶段发现一种新的肠脑轴,通过肠道启动的TH17免疫反应,会通过循环IL-17损害大脑功能[46,56,57]。
分子对接结果显示,“三黄”中彼此重复的成分与核心靶点结合活性较高,独有的成分结合活性则较差,这也反向证明了,本研究最初设想以中药“共同药性”的优势,来探索针对痴呆症共同特点的“多成分-多靶点”的治疗方式是正确的。
本研究对“三黄”治疗痴呆症的研究显示,其能以多成分、多靶点、多通路的治疗方式发挥作用,而采用分子对接也验证了本研究的结果。总之,本研究以中医药现代化的角度出发,将中医基础理论与网络药理学相结合,希望能以中药的优势探索出一种治疗痴呆症行之有效的方法,以及为“三黄”治疗痴呆症的临床应用提供依据,但本研究基于生物信息学理论分析,仍需针对相关药物活性成分、作用靶点及通路采用实验室及临床实验研究进行进一步验证。

