长链非编码RNA CDKN2BAS在子宫内膜癌组织表达及其生物学功能研究
彭 浩,张印星,谢 环(.黄石市中心医院/湖北理工学院附属医院妇产科,湖北黄石 435000;.宜昌市第二人民医院/三峡大学第二人民医院妇产科,湖北宜昌 443000)
子宫内膜癌(endometrial cancer,EC)作为绝经后女性高发生殖道恶性肿瘤,发病率和死亡率不断升高[1],对女性健康危害严重。随着现有诊疗水平不断进步,患者总体预后得到了很大改善[2],但鉴于EC 机制尚未明确,晚期患者治疗效果有限[3],加之治疗后易出现复发及多药耐药[4],对患者生存率的提高带来巨大挑战。长链非编码RNAs(long non-coding RNAs,LncRNAs)是一种含有超200nt核苷酸但不具备蛋白编码能力的RNA,可通过调控转录、转录后、表观遗传等而实现生物学作用[5],以被发现与恶性肿瘤进程密切相关,参与了肿瘤细胞恶性增殖及侵袭[6]。LncRNA CDKN2BAS 作为一种反义编码的LncRNA,参与调控多项生理病理过程,与结直肠癌[7]、骨肉瘤[8]和非小细胞肺癌[9]等密切相关。本研究分析了EC 组织中LncRNA CDKN2BAS 表达,并观察该基因对人EC 细胞HEC-1B 生物学功能的影响。
1 材料与方法
1.1 研究对象 收集2018年3月~2021年3月在黄石市中心医院接受手术治疗的EC 患者107 例患者作为研究对象,纳入标准:①初治,术前未接受任何治疗;②术后病理学检查确证;③临床资料完整。排除标准:①重要脏器严重功能不全;②并发有急慢性感染、其他妇科疾病、免疫系统疾患或其他系统恶性肿瘤者。平均年龄52.67±11.57 岁,根据国际妇产科联盟(FIGO)分期标准:Ⅰ~Ⅱ期71 例,Ⅲ~Ⅳ期36 例;组织学分级:G1 级37 例,G2 级36 例,G3 级34 例;伴有淋巴结转移33 例。将术中切除的EC 组织及离EC 边缘>3cm 癌旁组织用生理盐水冲洗后,快速置于液氮中,-80℃保管。本研究由医院伦理委员会审核通过,患者均签署知情同意书。HEC-1B 细胞株购自上海通派生物公司,置于保种管内,于液氮罐中-80℃保存。
1.2 仪器与试剂 酶标仪(美国Thermo 公司);实时荧光定量PCR 仪(美国ABI 公司);总RNA提取液(北京索莱宝公司);逆转录及qPCR 试剂盒(美国Sigma 公司);LncRNA CDKN2BAS 和内参引物(上海生工生物公司);RPMI-1640 培养液、胎牛血清及胰蛋白酶(美国Gibco 公司);Lipofectamine 2000 试剂(美国Invitrogen 公司);LncRNA CDKN2BAS 抑制序列及对照序列(上海美轩生物公司);MTT 液(武汉益普生物公司);Transwell 小室(美国Corning 公司);基质胶(上海研卉生物公司)。
1.3 方法
1.3.1 qRT-PCR方法检测组织中LncRNA CDKN2BAS表达:取冻存组织,按Trizol 法提取总RNA,经检测浓度及纯度合格后,取总RNA 按逆转录试剂盒操作获得cDNA,按qPCR 试剂盒操作步骤以cDNA 为模板扩增引物,序列:LncRNA CDKN2BAS:上游:5’-TGCCGGAGCTGTCGACCC-3’,下游:5’-TTTGA TCTCTGCTGTTGAATCAGAATG-3’;GAPDH 上游:5’-CTCCTGCATGCCACGGA-3’,下游:5’-AGAC CCTTACAGTTAGTCGT-3’。反应条件:94℃ 3min;94℃ 30s,58℃ 30s,76℃ 30s,循环38 次,用2-△△Ct法分析LncRNA CDKN2BAS 表达量。
1.3.2 细胞培养及处理:在含5%(v/v)CO2,37℃培养箱中用RPMI-1640 培养液(含10g/dl 胎牛血清)对HEC-1B 细胞培养。将对数期细胞接种在6 孔板,待细胞生长至90%以上融合度时,用Lipofectamine 2000 试剂开展转染:①siRNA 组:转染LncRNA CDKN2BAS 抑制序列:5’-GGUCAUCUCAU UGCUCUAU-3’;②si-NC 组:转染对照序列:5’-TTCTCCGAACGTGTCACGT-3’;③C 组:不作任何处理。处理后各组培养48h。
1.3.3 qRT-PCR 方法检测细胞中LncRNA CDKN2BAS表达:取处理后培养48h 细胞,加入裂解液,其余操作同1.3.1。
1.3.4 MTT 实验:取方法1.3.2 中处理后培养的各组细胞,制备单细胞悬液,密度2.5×104/ml,按100μl/孔接种在96 孔板,继续培养。分别在12,24,48,72 和96h 时,各孔加入MTT 液20μl,培养4h,去除上清,加入二甲基亚砜150μl,振荡使结晶溶解,使用酶标仪检测各孔吸光度A值。重复实验3 次。
1.3.5 Transwell 实验:①迁移能力:收集方法1.3.2中处理后培养的各组细胞,离心取细胞沉淀,用无血清培养液制备密度2.5×105/ml 的悬液,并取200μl 加入小室上室内,取600μl 含10g/dl 胎牛血清的培养液加入下室,培养24h,将小室取出,将未穿膜细胞用棉签擦去,固定,0.1%结晶紫染色,镜下计数穿膜细胞数。重复实验3 次。③侵袭能力:用预冷培养液对基质胶稀释后均匀铺在小室上室,干燥备用,其余操作步骤同迁移能力检测。
1.4 统计学分析 应用SPSS 21.0 软件对数据进行统计分析,计量资料以均值±标准差(±s)表示,两组数据资料比较采用独立样本t检验,多组间差异比较采用单因素方差分析,组间进一步两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 LncRNA CDKN2BAS 在EC 癌组织和癌旁组织中表达量比较 EC 癌组织中LncRNA CDKN2BAS表达量为2.73±0.25,高于癌旁组织中的1.00±0.13,差异具有统计学意义(t=63.903,P<0.001)。
2.2 EC 癌组织中LncRNA CDKN2BAS 表达量与临床指标相关性 见表1。EC 癌组织中LncRNA CDKN2 BAS 表达量与年龄、浸润深度无关(均P>0.05),LncRNA CDKN2BAS在FIGO分期Ⅲ~Ⅳ期、组织学分级G3 级和出现淋巴结转移的EC 癌组织中的表达量较Ⅰ~Ⅱ期,G1-G2 级和未出现淋巴结转移的EC 组织明显升高,差异具有统计学意义(均P<0.05)。
表1 不同临床指标的EC 组织中LncRNA CDKN2BAS表达量比较(n=107,±s)

表1 不同临床指标的EC 组织中LncRNA CDKN2BAS表达量比较(n=107,±s)
类 别n LncRNA CDKN2BAS表达量tP年龄(岁)<53452.69±0.221.289 0.200≥53622.75±0.26浸润深度 ≤1/2432.68±0.211.633 0.106>1/2642.76±0.26 FIGO 分期 Ⅰ~Ⅱ期712.67±0.233.246 0.002Ⅲ~Ⅳ期362.83±0.25组织学分级 G1~G2 级732.67±0.223.894<0.001 G3 级342.85±0.24淋巴结转移 是332.84±0.263.270 0.001否742.68±0.22
2.3 三组细胞中LncRNA CDKN2BAS 表达量比较 siRNA 组、si-NC 组和C 组细胞中LncRNA CDKN2BAS 表达量分别为0.30±0.12,1.02±0.10和1.01±0.12,与si-NC 组和C 组比较,siRNA 组细胞中LncRNA CDKN2BAS 表达量明显降低,差异有统计学意义(F=77.210,P<0.001)。
2.4 三组细胞增殖活性比较 见表2。siRNA 组细胞24,48,72 和96h 时A值低于si-NC 组和C 组,差异有统计学意义(P<0.05)。
表2 各组细胞增殖活性比较(A 值,±s)
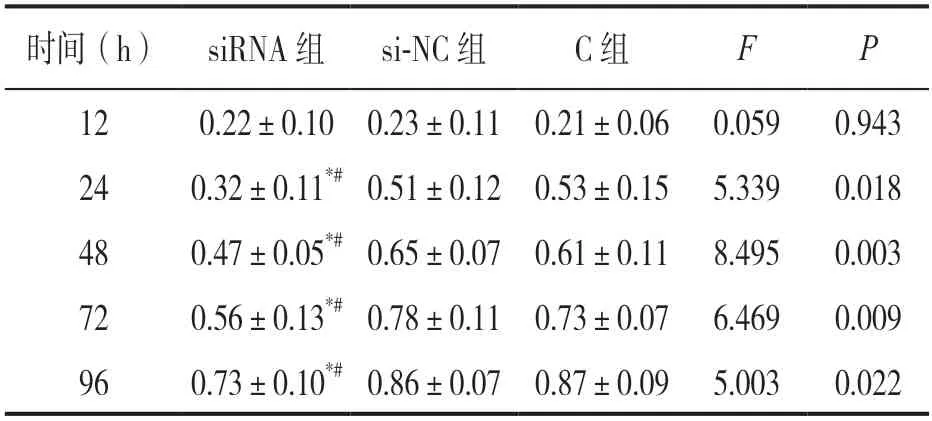
表2 各组细胞增殖活性比较(A 值,±s)
注:与C 组比较,*t=-2.868,-2.942,-2.638,-2.594,均P<0.05;与si-NC 组比较,#t=-2.938,-5.083,-3.049,-2.740,均P<0.05。
时间(h) siRNA 组si-NC 组C 组FP 120.22±0.10 0.23±0.11 0.21±0.06 0.0590.943 240.32±0.11*# 0.51±0.12 0.53±0.15 5.3390.018 480.47±0.05*# 0.65±0.07 0.61±0.11 8.4950.003 720.56±0.13*# 0.78±0.11 0.73±0.07 6.4690.009 960.73±0.10*# 0.86±0.07 0.87±0.09 5.0030.022
2.5 三组细胞迁移和侵袭力比较 见表3。siRNA组迁移细胞数和侵袭细胞数低于si-NC 组(t=-5.468,-5.928)和C 组(t=-5.887,-5.741),差异具有统计学意义(均P<0.05)。
表3 不同组细胞迁移和侵袭力比较(±s 个)

表3 不同组细胞迁移和侵袭力比较(±s 个)
类别siRNA 组si-NC 组C 组FP迁移细胞 104.83±8.38 130.50±6.50 132.50±9.29 21.956<0.001侵袭细胞 86.33±10.01 121.17±10.96 119.33±9.40 22.407<0.001
3 讨论
随着肿瘤治疗手段的不断进步,多数EC 患者早期接受规范诊疗五年生存率较高,但仍有约1/3的患者发现时已至进展期,治疗效果不佳,病死率高[10]。目前,EC 病因不明,发病过程涉及众多基因和信号通路,因此,深入研究EC 发病机制,寻找与病程进展相关基因,对指导患者诊疗意义重大。
LncRNAs 作为一种广泛存在于机体且功能复杂的非编码RNA,可发挥致癌或抑癌功能参与肿瘤病程进展[11],有研究指出[12],EC 和正常内膜组织中LncRNAs 表达出现显著差异。亦有研究指出[13],LncRNAs 有望成为EC 治疗的潜在性靶标。LncRNA CDKN2BAS 也被称作ANRIL(细胞周期蛋白依赖性激酶抑制因子4b(inhibitors of cyclin-dependent kinase 4b,INK4b)位点的反义非编码RNA(antisense noncodina RNA in the INK4 locus),主要定位于细胞核内的LncRNA,与多种疾病病程关系密切,YU 等[14]研究发现,LncRNA CDKN2BAS与颅内动脉瘤之间存在显著关系。有研究指出[15],LncRNA CDKN2BAS基因多态性与南印度人群牙周炎和冠状动脉疾病相关。可能是动脉粥样硬化的遗传标志物[16]。随着研究深入,LncRNA CDKN2BAS在肿瘤发病中的作用越来越受到重视,研究发现[17],LncRNA CDKN2BAS 通过靶向miR-181a,激活HMGB1 诱导细胞自噬是致癌的关键。WANG 等[18]指出,LncRNA CDKN2BAS 可加剧卵巢癌进展。研究发现[19],LncRNA CDKN2BAS 在膀胱尿路上皮癌组织中高表达,且与吉西他滨敏感度有关。本研究中,EC 组织中LncRNA CDKN2BAS 表达量高于癌旁组织,说明LncRNA CDKN2BAS 在EC 癌组织中表达升高,可能作为致癌基因参与了EC 发生。同时,本研究结果显示,LncRNA CDKN2BAS与代表EC 恶性进展的指标密切相关,如FIGO 分期Ⅲ~Ⅳ期、组织学分级G3 级和出现淋巴结转移的EC 组织中表达量显著升高,提示其可能参与了EC 进展。
HUANG 等[20]研究指出,LncRNA CDKN2BAS通过靶向miR-99a 抑制口腔鳞状细胞癌细胞增殖。亦有研究发现[21],敲除LncRNA CDKN2BAS 可通过抑制NF-κB 信号传导增加细胞凋亡,抑制胃癌生长,抑制癌细胞迁移。本研究利用转染小分子干扰物的方式沉默人EC 细胞HEC-1B 中LncRNA CDKN2BAS 表达,结果显示,siRNA 组细胞中LncRNA CDKN2BAS 表达量低于si-NC 组和C 组,说明HEC-1B 细胞中LncRNA CDKN2BAS 表达被干扰。本研究结果显示,siRNA 组细胞24,48,72和96h 时A值低于si-NC 组和C 组,说明LncRNA CDKN2BAS 表达与HEC-1B 细胞增殖活性相关,沉默细胞中LncRNA CDKN2BAS 表达可显著抑制细胞增殖能力。本研究结果显示,siRNA 组迁移细胞数和侵袭细胞数低于si-NC 组和C 组,说明LncRNA CDKN2BAS 基因与HEC-1B 细胞迁移和侵袭有关,沉默LncRNA CDKN2BAS 表达可明显减少迁移和侵袭数量。
综上所述,EC 组织中LncRNA CDKN2BAS表达量升高,沉默人EC 细胞HEC-1B 中LncRNA CDKN2BAS 表达可抑制细胞增殖活性,减少细胞迁移和侵袭数量,有望为EC 机制研究及临床诊疗提供新的靶位,但其具体作用通路有待开展进一步的研究予以证实。

