两种不同前处理方法结合气相色谱串联质谱测定蔬菜中12 种农残效果
张晓鸿,潘剑蕾,张晓强,王钰歆,林慧纯,王 瑞
(深圳市质量安全检验检测研究院,广东深圳 518000)
我国作为农产品生产消费大国,近年来食品安全状况虽有了显著改善,但随着果蔬产业的迅速发展和产量的提高,农药残留超标问题仍层出不穷,影响着人们“舌尖上的安全”[1]。
农药残留检测技术作为保障农产品质量安全的坚强后盾,建立高效、快速、准确和灵敏的蔬菜农药多残留定性定量检测方法十分必要。由于蔬菜、水果、食用菌等不同样品的基质效应不同,各类型仪器条件的灵敏度、精确度等也不同,样品前处理过程和仪器类型的选择会直接影响到最终的定性和定量结果[2]。
农药残留检测前处理方法中常用的主要有固相萃取法[3]、固相微萃取法[4]、凝胶渗透色谱法[5]等,目前ANASTASSIADES 等[6]发明的QuEChERS 前处理检测技术,由于其快速、简便、廉价、高效、稳定和安全等优点已被广泛应用于农残检测过程中。常用的农残检测仪器方法主要有气相色谱法、液相色谱法、气质联用法、液质联用法、液相色谱串联质谱法和气相色谱串联质谱法(Gas Chromatography-Mass Spectrometer,GC-MS/MS)等[7],而气相色谱与质谱联用可更好地发挥两者的优势,有效地排除基质干扰,简化前处理过程,提高检测效率,可分析果蔬菌、动物源食品及其加工品等复杂基质中的农残[8]。
本文就选取传统的手动QuEChERS 法和全自动固相萃取仪进行对比,结合气相色谱串联质谱法,对方法准确度、精密度、灵敏度进行比较和分析,以期更好地满足食用农产品检测技术工作需求,实现多种更加高效、快速、准确的方法用于多农药残留检测,为农产品质检机构提供方法选择和参考。
1 材料与方法
1.1 材料与试剂
乙腈(色谱纯,德国Merck 公司);丙酮(色谱纯,德国Merck 公司);氯化钠(分析纯,广州化学试剂厂);无水硫酸镁(分析纯,CNW 公司);乙二胺-N-丙基硅烷化硅胶(PSA,Agilent 公司);固相萃取盐包(含氯化钠0.1 mg,硫酸镁0.4 mg,柠檬酸钠0.11 g、柠檬酸氢二钠0.05 g);净化内管(含硫酸镁0.6 mg,PSA 0.1 g);陶瓷均质子颗粒;0.45 μm 微孔滤膜(有机相);50 mL 塑料离心管;15 mL 塑料离心管。
1.2 仪器与设备
气相色谱串联质谱仪(Agilent 6890A-7000B,配电子轰击源EI);电子天平(SQP/PRACTUM2102-1CN,北京赛多利斯公司);全自动萃取仪(SiO-6512,北京本立科技有限公司);自动匀浆机(海斯特公司);高速离心机(Sigma 公司);氮吹仪(美国Organomation Associ-ates 公司);旋涡混合器(姜堰市康健医疗器具有限公司)。
1.3 农药混合标准溶液
1.3.1 混合标准储备溶液
蝇毒磷、联苯菊酯、虫线磷、百治磷、灭线磷、特丁硫磷、艾氏剂、狄氏剂、异狄氏剂、甲氰菊酯、异丙威和仲丁威12 种农药混合标准储备溶液,浓度为50 mg·L-1,购于上海安谱实验科技股份有限公司(CNW)。
1.3.2 基质混合标准工作溶液
空白基质溶液氮气吹干,加入1.0 mL 相应质量浓度的混合标准溶液复溶,过微孔滤膜。基质混合标准工作溶液应现用现配。空白基质溶液取样量与相应的样品处理取样量一致。
1.4 前处理方法
1.4.1 前处理方法一(手动QuEChERS 法)
准确称取10 g 试样(精确至0.01 g)于50 mL 塑料离心管中,加入20 mL 乙腈用自动匀浆机提取2 min,加入5 ~7 g 氯化钠,再剧烈振荡1 min,将离心管放入离心机,于10 000 r·min-1离心3 min。移取6 mL 上层乙腈提取液于15 mL 离心管中,加入300 mg PSA,旋涡振荡1 min 后于9 000 r·min-1离心3 min。移取4.00 mL 上清液于试管中,50 ℃水浴下氮气缓慢吹至近干,用丙酮定容至2.00 mL,混匀,过0.45 μm 滤膜,供GC-MS-MS 测定。
1.4.2 前处理方法二(全自动固相萃取法)
准确称取10 g 试样(精确至0.01 g)于50 mL 塑料离心管中,加入陶瓷均质子,加入4 mL 一级水,再加入10 mL 乙腈,最后加入固相萃取盐包后插入净化内管后迅速摇匀1 min 后置于全自动固相萃取仪,上机提取净化后,移取净化内管内上层清液2 mL,50 ℃水浴下氮气缓慢吹至近干,用丙酮定容至1.00 mL,混匀,过0.45 μm 滤膜,供GC-MS-MS 测定。
1.5 GC-MS-MS 仪器条件
色谱柱:HP-5MS(30 m×25 mm,0.25 μm);载气:氦气(纯度为99.999%,流量为1.1 mL·min-1);进样方式:不分流进样;进样量:1.0 μL;离子源:EI;采集方式:MRM;离子源温度:280 ℃;前后四极杆温度:150 ℃;加热器温度:280 ℃;碰撞气:氮气(流量:1.5 mL·min-1);淬灭气:氦气(流量:2.25 mL·min-1);升温程序:初始温度60 ℃,保持1 min 后以40 ℃·min-1升至120 ℃,然后以5 ℃·min-1升至310 ℃。
2 结果与分析
2.1 监测离子对
将12 种农药的单标标准溶液在三重四极杆气质联用仪上采用SCAN 的方法进样,找到特征离子,再打碎一次,进行产物离子扫描,找到下一个离子组成离子对,利用仪器自动优化功能找到最佳碰撞能量后,采用MRM 方法进行样品采集。常规检测只需一组定量和定性离子对即可,本研究采用两组定性离子对,可更加准确定性。12 种农药的监测离子对信息见表1。
2.2 线性范围和定量限
分别用前处理方法一和二对空白基质(以西葫芦为例)进行提取、净化后吹干,加入一系列浓度的混合标准溶液,质量浓度分别为0.01 mg·L-1、0.02 mg·L-1、0.05 mg·L-1、0.10 mg·L-1和0.20 mg·L-1,上机测试后绘制标准工作曲线,得到曲线相关系数。以信噪比S/N=10 时的进样溶液质量浓度为最低定量浓度,样品经过两种前处理方法1.4.1 和1.4.2 分别提取后,经仪器检测确定方法的定量限,结果见表2。
2.3 加标回收率
为验证方法的准确性,以西葫芦为空白基质,称取6 个平行样品,各自添加以上12 种农药的混合标准溶液,添加3 个浓度水平,分别为0.01 mg·L-1、0.05 mg·L-1、0.10 mg·L-1(定量限、5 倍定量限和10倍定量限),依照上述两种前处理方法1.4.1 和1.4.2分别制备提取液,上机检测,采用单点外标法对农药定量。根据6 次平行试验结果计算得到平均回收率,结果见表3。

表3 西葫芦中12 种农药的加标回收率表
2.4 精密度
以西葫芦为空白基质,称取6 个平行样品,各自添加以上12 种农药的混合标准溶液,添加3个浓度水平,分别为0.01 mg·L-1、0.05 mg·L-1、0.10 mg·L-1,依照上述两种前处理方法1.4.1 和1.4.2分别制备提取液,上机检测,根据6 次平行试验结果计算得到相对标准偏差(RSD),用来衡量方法的精密度,结果见表4。
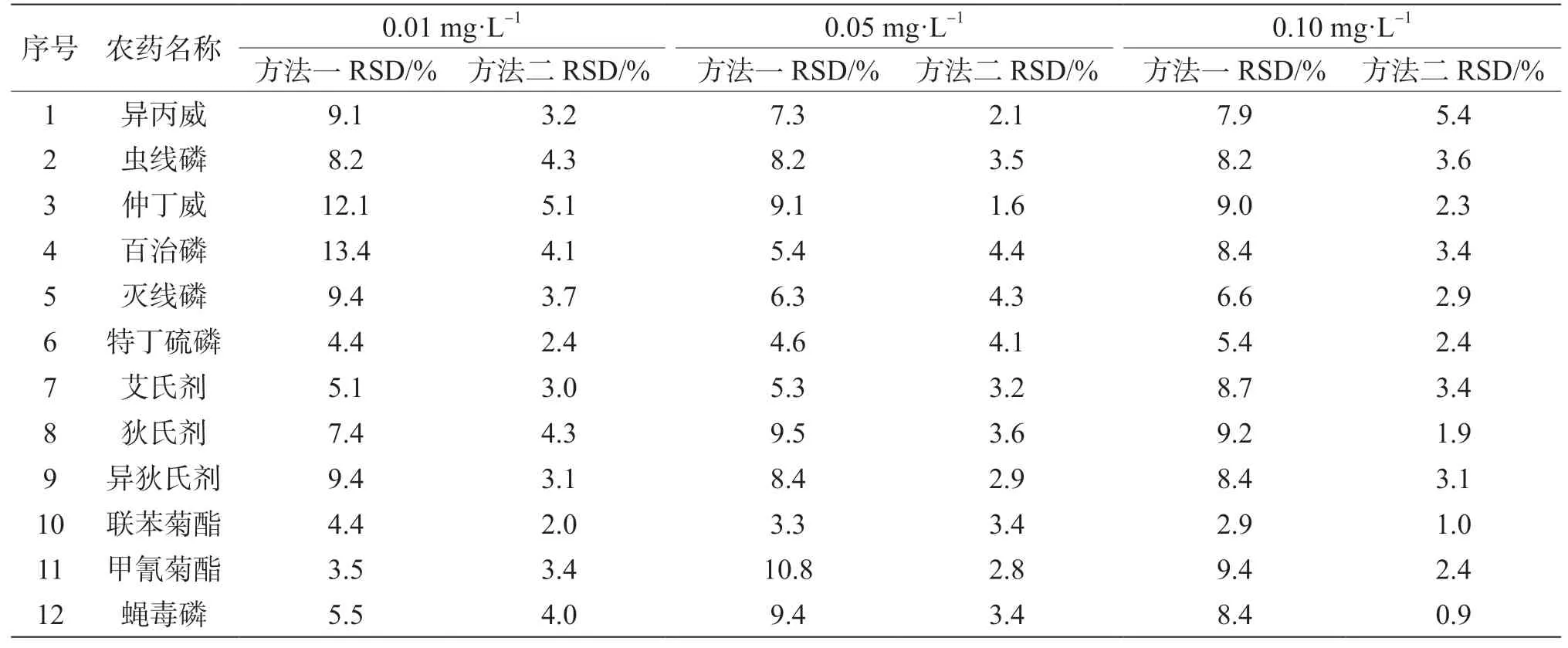
表4 西葫芦中12 种农药的相对标准偏差表
2.5 结果比较
两种前处理方法的实验过程和结果进行比较,从效率上对比,以完成一批10 个样品的前处理为例,传统手动QuEChERS 法与自动固相萃取仪法均需约2 h,而自动固相萃取仪法可在提取和净化过程节省一定的人力;在线性范围、准确度、灵敏度等方面二者均能满足所检测蔬菜中12 种农药的日常检测要求,但从精密度结果可看出,方法一的RSD 值总体比方法二均相对较高,且仲丁威和百治磷用方法一处理结果的精密度存在超过10%的情况,由于传统手动QuEChER 法在提取、净化和浓缩等步骤中存在人为操作的不一致性,而全自动固相萃取法能完成12 个样品的同步实验,可降低人为操作的不稳定性,因此后者的平行性较好,结果精密度较高。
3 结论
本研究中两种不同的前处理方法结合GC-MSMS 技术,检测结果均能满足GB/T 27404—2008[9]和中华人民共和国农业部公告2386 号[10]中关于回收率、精密度、定量限的要求,适用于准确快速地测定蔬菜中12 种农药多残留。方法一传统手动QuEChERS 法操作简单,回收率高,但在平行性控制上存在人工的提取和净化步骤,影响结果的精密度;方法二采用全自动固相萃取仪,可同时操作12个样品的自动提取和净化,减少了人为操作的不平行性和随机误差,精密度较高,回收率也均符合相关标准的要求。
- 食品安全导刊的其它文章
- 加强食安管理,兼顾营养健康,实现共赢发展
——访中国食品工业协会总工程师李宇 - METTLER TOLEDO 升级金属检测系统,以更经济实惠的方式实现合规与数字化
- 京蒙两地肉类食品协会座谈交流会在京举行,助力双方肉食经济发展
- 远见卓识确立目标市场深耕细作锚定发展方向
——访嘉吉食品配料北亚和澳洲董事总经理 彭鸣嘉吉食品配料与生物工业亚太区研发领导 周津 - 洞悉市场发展趋势,制定健康服务战略
——访IFF Nourish 亚太区创新技术总监 Kok Mei Fah IFF Health 事业部亚太区战略市场和产品管理负责人 陆涛IFF Nourish 事业部大中华区总经理 刘卫斌 - 一起由金黄色葡萄球菌和蜡样芽胞杆菌引起食物中毒的实验室检测分析

