PUS7通过调节GSPT1的Ψ修饰促进肝癌HepG2细胞增殖
何晓荣, 吉华亮, 田尧, 马林, 葛桂萍
1.海安市人民医院消化内科,江苏海安 226600; 2.南通市中医院消化内科,江苏南通 226007
肝癌是一种常见的致死性消化系统恶性肿瘤,是世界上癌症相关死亡的第三大原因[1-2]。通常情况下,肝癌一旦确诊,往往已是晚期,只有约20%的肝癌患者适合手术治疗[3],发现肝癌的发生发展机制有利于肝癌的治疗。本研究根据TCGA数据库LIHC数据集发现肝癌患者假尿苷合酶(pseudouridine synthase,PUS)7的表达水平影响预后。PUS包含以下6个家族中的一类蛋白质:TruA、TruB、TruD、RsuA、RluA和PUS10p。这些蛋白主要对RNA进行假尿苷(pseudouridine,Ψ)修饰发挥功能[4]。这些蛋白酶与人类疾病和肿瘤发生有关。例如,PUS1介导的假尿苷化参与乳腺癌细胞中的NR信号转导[5]、PUS7可以影响结直肠癌的转移[6]。然而,关于PUS7在肝癌中的具体作用尚未报道。基于此,本研究旨在探讨PUS7对肝癌HepG2细胞的作用和其潜在机制。
1 材料和方法
1.1 材料
肝癌细胞HepG2购自上海泽叶生物科技有限公司。GSPT1抗体购自Affinity公司。GAPDH抗体购自北京Wellbio公司。PUS7抗体购自云南洛宇生物科技有限公司。Ψ抗体购自Diagenode公司。本研究所有的siRNA、过表达质粒均由北京擎科设计合成。PUS7敲除的HepG2细胞由南京金斯瑞公司提供。siNC的序列:正义链为5′-UGAAGUUCACCUUGAUGCCGU-3′,反义链为5′-GGCAUCAAGGUGAACUUCAAG-3′。siPUS7的序列:正义链为5′-UUUUUUGUCUCUUCAACUGGG-3′;反义链为5′-CAGUUGAAGAGACAAAAAAAC-3′。siGSPT1的序列:正义链为5′-AUUCUUCUGGAGACAUUUCUG-3′,反义链为5′-GAAAUGUCUCCAGAAGAAUCA-3′。PUS7 CRISPR Guide RNA目标序列:5′-TTAATATTGAAACCCCGCTC-3′。
1.2 细胞培养与处理
人肝癌细胞HepG2接种到含10%FBS、100 mg/L青霉素和100 mg/L链霉素的RPMI 1640培养基中,并在5% CO2和37 ℃条件下进行培养。细胞实验分为siNC组(转染siNC)、siPUS7组(转染siPUS7)、siGSPT组(转染siGSPT1)、Vector组(转染过表达空载体)、PUS7组(转染PUS7过表达质粒)、GSPT1组(转染GSPT1过表达质粒)。将siRNA或质粒和Lipofectamine 2000在室温下通过Opti-MEM稀释5 min,混合后在室温下孵育30 min,将该混合物加入到细胞中并孵育6 h,将培养基换回含有10%FBS和1%青霉素-链霉素的RPMI-1640培养基。转染后72 h进行相关实验。
1.3 CCK-8法测定细胞增殖能力
将细胞以每孔1×103个细胞接种在96孔板中。然后,在指示的时间点中向每个孔中加入CCK-8溶液(10 mL,在100 mmol/L DMEM中),培养细胞4 h。使用Rayto-6000系统在450 nm波长处测量光密度值。
1.4 PUS7和GSPT1在肝癌患者中的生存曲线
根据TCGA数据中LIHC数据集,在HPA数据库中分析不同PUS7和GSPT1表达水平在肝癌患者的生存曲线。
1.5 半定量蛋白质质谱
敲低或过表达PUS7后,将肝癌细胞HepG2的总蛋白采用液相色谱-串联质谱法对细胞进行半定量蛋白质组学数据分析。将靶向的凝胶带切成小块并进行凝胶胰蛋白酶消化。凝胶用50%CH3CN、30%CH3CN/100 mmol/L NH4HCO3、50%CH3CN/50 mmol/L NH4HCO3和50%CH3CN/25 mmol/L NH4HCO3固定,直到凝胶开始澄清。干燥后,将凝胶用MS级修饰的胰蛋白酶在4 ℃下消化1 h。然后,添加足够的25 mmol/L NH4HCO3以覆盖凝胶片,并在37 ℃下继续消化16 h。添加50 μL双缩的H2O并孵育10 min。凝胶片中用60%CH3CN/5%TFA提取肽,并干燥至10 μL。然后在Q-TOF质谱仪上鉴定制备的肽,并使用搜索软件分析数据。
1.6 蛋白质稳定性的评估和免疫印迹
为了评估蛋白质稳定性,加入蛋白质合成抑制剂CHX(30 mg/L),在处理后0、6、12 h收获全细胞裂解物。通过免疫印迹分析测定GSPT1蛋白表达。富含蛋白酶抑制剂和磷酸酶抑制剂混合物的RIPA缓冲液用于制备全细胞裂解物。使用BCA蛋白检测试剂盒测定蛋白水平。使用SDS-PAGE凝胶进行蛋白质分级分离,然后将蛋白质印迹到硝酸纤维素膜上。随后,在TBST[0.05%Tween 20、120 mmol/L Tris-HCl(pH 7.4)和150 mmol/L NaCl]中加入5%脱脂奶粉,25 ℃下阻断非特异性结合1 h。将膜与指定的一抗在4 ℃下孵育过夜。之后,用TBST冲洗膜3次,并用HRP标记的二抗接种。使用Bio-Rad ChemiDoc XRS+成像系统使蛋白质条带可视化。
1.7 RNA抽取与实时荧光定量PCR
使用RNA提取试剂盒分离总RNA,然后使用反转录试剂盒通过反转录从总RNA合成cDNA。此后,使用SYBR Green PCR Kit在Bio-Rad CFX96系统上使用以下程序进行RT-PCR:95 ℃预变性10 min,95 ℃变性15 s,引物退火60 ℃ 1 min,最终延伸72 ℃ 30 s。对生成的熔解曲线进行评估,并使用Applied Biosystems-SDS 1.9.1软件确定指数扩增阶段的Ct值。
1.8 Ψ免疫沉淀
在PUS7敲除或没敲除的HepG2细胞中,通过质粒过表达并分为3组:Vector组(转染空载体)、PUS7-WT组(转染PUS7野生型质粒)、PUS7-MT组(转染PUS7TRUD结构域缺失突变型质粒)使用5 μg抗Ψ单克隆抗体或等量的小鼠IgG(用作阴性对照)。对HepG2细胞中分离的40 μg总RNA进行RNA免疫沉淀。随后通过实时荧光定量PCR分析免疫沉淀的RNA。
1.9 统计学分析
采用SPSS软件(V.19.0)和Prism 9.0版进行数据分析。在定量数据的组间比较中,应用双尾t检验。Kaplan-Meier生存分析以及对数秩检验用于生存曲线分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 PUS7促进肝癌细胞HepG2增殖
低表达PUS7的肝癌患者较高表达者具有较好的预后(P<0.05;图1A)。敲低PUS7后,肝癌细胞HepG2的增殖能力下降(P<0.05);过表达PUS7后,肝癌细胞HepG2的增殖能力上升(P<0.05;图1B和图1C)。
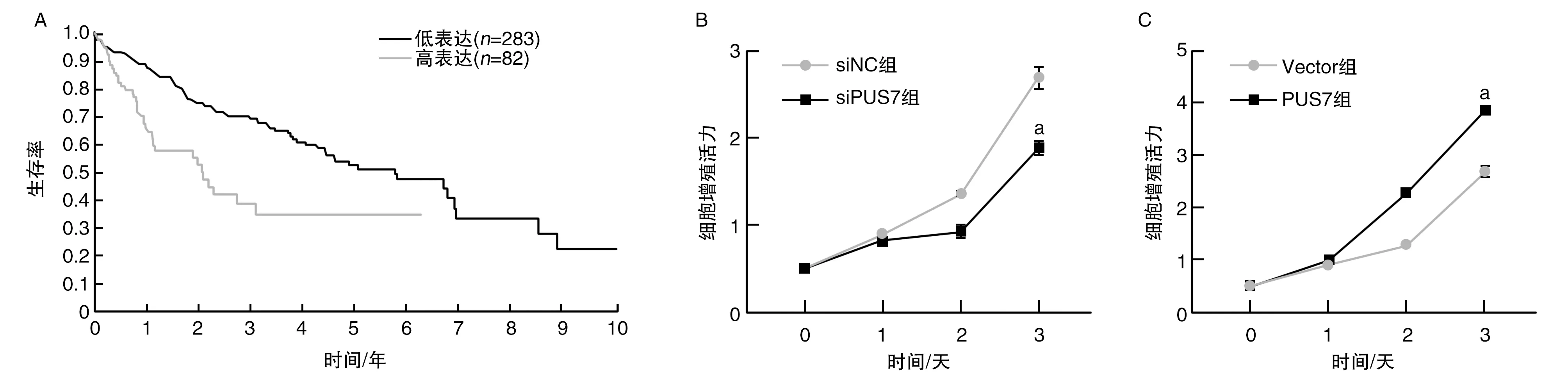
图1 PUS7促进肝癌细胞HepG2增殖A为Kaplan-Meier生存分析以及对数秩检验分析TCGA数据库中不同PUS7表达水平肝癌患者的生存曲线;B为敲低PUS7后肝癌细胞HepG2的增殖能力;C为过表达PUS7后肝癌细胞HepG2的增殖能力。a为P<0.05,与siNC组和Vector组比较。
2.2 PUS7靶向GSPT1促进肝癌细胞HepG2增殖
为了探讨PUS7促进肝癌细胞HepG2增殖的下游分子,敲低或过表达PUS7后将肝癌细胞HepG2的总蛋白进行半定量蛋白质质谱,发现多种蛋白的表达水平受到调控(图2A)。使用siRNA敲低上述受到调控蛋白的相应基因,发现敲低GSPT1后,肝癌细胞HepG2增殖能力下降(P<0.05;图2B);敲低PUS7后,肝癌细胞HepG2中GSPT1的蛋白表达水平下降(P<0.05;图2C);过表达PUS7后,肝癌细胞HepG2中GSPT1的蛋白表达水平上升(P<0.05;图2D),PUS7过表达后肝癌细胞HepG2的增殖水平较Vector组上升(P<0.05);过表达GSPT1后,肝癌细胞HepG2增殖能力上升(P<0.05图2E和图2F)。过表达PUS7的同时敲低GSPT1后肝癌细胞HepG2的增殖水平无显著变化(图2G)。低表达GSPT1的肝癌患者具有较好的预后(χ2=8.47,P<0.05;图2H)。

图2 PUS7调节GSPT1促进肝癌细胞HepG2增殖A为敲低或过表达PUS7后肝癌细胞HepG2进行总蛋白半定量蛋白质质谱的蛋白表达水平;B为siRNA敲低受到PUS7调控基因后肝癌细胞HepG2的增殖能力;C为敲低PUS7后肝癌细胞HepG2中PUS7和GSPT1的蛋白表达水平;D为过表达PUS7后肝癌细胞HepG2中PUS7和GSPT1的蛋白表达水平;E为敲低GSPT1后肝癌细胞HepG2的增殖能力;F为过表达GSPT1后肝癌细胞HepG2的增殖能力;G为过表达GSPT1或/和敲低GSPT1后肝癌细胞HepG2的增殖能力;H为Kaplan-Meier生存分析以及对数秩检验分析TCGA数据库中不同GSPT1表达水平肝癌患者的生存曲线。a为P<0.05,与siNC组和Vector组比较。
2.3 PUS7对GSPT1进行Ψ修饰影响GSPT1翻译
实时荧光定量PCR发现敲低或者过表达PUS7后,肝癌细胞HepG2中GSPT1的mRNA水平均无显著变化(图3A和图3B)。CHX处理后肝癌细胞HepG2中GSPT1的蛋白水平与DMSO组比较无显著变化(图3C)。敲低PUS7后肝癌细胞HepG2中GSPT1 Ψ修饰下降(P<0.05);过表达PUS7后肝癌细胞HepG2中GSPT1 Ψ修饰上升(P<0.05;图3D和图3E)。PUS7敲除后肝癌细胞HepG2中GSPT1 Ψ修饰下降(P<0.05)。在PUS7敲除细胞系中,过表达野生型PUS7后GSPT1 Ψ修饰上升(P<0.05);过表达突变型PUS7(酶活TRUD结构域缺失型)后GSPT1 Ψ修饰无显著改变(图3F)。

图3 PUS7对GSPT1进行Ψ修饰影响GSPT1翻译A为敲低PUS7后,肝癌细胞HepG2中GSPT1 mRNA水平;B为过表达PUS7后,肝癌细胞HepG2中GSPT1 mRNA水平;C为蛋白质合成抑制剂CHX处理0、6、12 h后肝癌细胞HepG2中GSPT1的蛋白水平;D为敲低PUS7后,肝癌细胞HepG2中GSPT1 Ψ修饰水平;E为过表达PUS7后,肝癌细胞HepG2中GSPT1 Ψ修饰水平;F为在PUS7敲除细胞系中,过表达野生型PUS7或突变型PUS7(酶活TRUD结构域缺失型)后GSPT1 Ψ修饰水平。a为P<0.05,与siNC组或Vector组比较。
3 讨 论
肝癌是世界范围内常见的恶性肿瘤之一,发病率呈上升趋势,尤其是在中国[7]。尽管最近在肝癌治疗方面取得了进展,包括手术切除、射频消融、肝移植和经导管动脉化疗栓塞,但大多数肝癌患者的预后仍然很差[8]。因此,阐明肝癌进展的效应分子和信号通路对于开发新的治疗策略和更有效的治疗至关重要。本研究通过半定量蛋白质质谱和遗传学操作鉴定了影响肝癌细胞增殖能力的关键分子PUS7和GSPT1,靶向PUS7/GSPT1轴可能是治疗肝癌的一种新方法。
以前的研究已经证明了PUS7介导的假尿苷化在翻译和肿瘤发生中的作用[6]。然而,PUS7在肝癌发展中的作用仍然知之甚少。在这项研究中,发现PUS7通过依赖mRNA假尿苷化的方式调节GSPT1来增强肝癌细胞的增殖。之前的一项研究发现[9],PUS7的敲低不会影响细胞增殖,但会导致hESCs中细胞大小的增加。PUS10还影响多种人细胞系的细胞增殖[10]。这些结果不仅强调了PUS在细胞过程中的重要性,而且还提供了PUS生物学功能中的组织特异性。由于关于单个假尿苷酸化酶功能的信息很少,因此需要未来的研究来确定PUS在不同细胞表型背景下的作用。
GSPT1被定义为一个真核肽链释放因子,是肝癌和其他实体瘤的增殖相关蛋白[11]。值得注意的是,以前的研究只确定了对GSPT1的调控有贡献的miRNAs名单[12-15]。在此,本研究证明了GSPT1作为PUS7的下游靶点,在功能上负责PUS7介导的肝癌细胞增殖,提供了一个新的调节层。然而,PUS7的基因调控网络是多样化和复杂的。例如,本研究的蛋白质组分析数据说明,PUS7可以改变多种蛋白的表达水平。虽然受到PUS7调控的蛋白并不影响肝癌细胞的增殖,但是是否在肝癌发生发展的其他方面发挥作用仍有待于验证。此外,PUS7是直接调节GSPT1 Ψ修饰来影响GSPT1的蛋白表达,其他蛋白是否也是基于这一机制而受到调控也有待于验证。因此,本研究不能排除其他基因参与PUS7介导的生物功能。
综上所述,PUS7通过调节GSPT1 Ψ修饰促进肝癌细胞增殖。因此,靶向PUS7/GSPT1轴可能是治疗肝癌的一种新方法。

