SHMT2结合并上调SQSTM1促进结肠癌细胞增殖*
陈前智,沈娜,李雪芹
(华中科技大学同济医学院附属协和医院乳腺甲状腺外科,武汉 430022)
结肠癌是一种在结肠组织中形成恶性肿瘤的消化道疾病,是发病率排名第三的癌症,也是全球癌症相关死亡的主要原因之一[1-2]。随着人们饮食结构的变化,中国已成为结肠癌全球每年新增病例和死亡例数最多的国家,我国居民的健康因此受到严重威胁[3]。尽管外科治疗、化学治疗、放射治疗和靶向治疗发展迅速,但晚期结肠癌患者5年生存率仍未见明显改善,预后较差[2,4]。因此,深入探索结肠癌发生发展的分子机制及发现新的调控靶点,对改善结肠癌患者治疗策略具有重大的临床意义。丝氨酸羟甲基转移酶2(serine hydroxymethyltransferase 2,SHMT2)作为丝氨酸代谢的关键酶,是近年来研究热点,在多种恶性肿瘤中的作用已被陆续揭示[5]。但SHMT2在结肠癌中作用和调控机制仍不清楚。本研究拟验证SHMT2在结肠癌中的表达情况及与预后的相关性,进而以探索SHMT2调控结肠癌细胞增殖的分子机制为研究目标,发现结肠癌增殖相关的调控机制和分子靶点,为结肠癌的治疗提供新思路。
1 材料与方法
1.1主要细胞和试剂 HCT116、LoVo、HEK293T是实验室既往冻存的细胞株,源于ATCC细胞库。高糖培养基和胎牛血清均购于美国Gibco公司。蛋白印迹实验相关试剂、NP40细胞裂解液来源于武汉启动子公司;转染试剂TurboFect、BCA蛋白浓度检测试剂盒、增强型化学发光(enhanced chemiluminescence,ECL)显影液购于美国Thermo Fisher公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、SHMT2抗体、SQSTM1抗体均来源于武汉三鹰生物技术有限公司;低表达质粒(shSHMT2#1和#2)和高表达质粒(Flag-SQSTM1)均购自吉凯基因公司;SHIN1(货号:RZ-2994)购于美国MCE公司。
1.2细胞的分组和实验 细胞是以转染不同质粒或加入不同干预因素为分组条件,如shNC或vector组转染对照空载质粒,shSHMT2组转染shSHMT2干扰质粒,Flag-SHMT2组转染SHMT2过表达质粒(6孔板里单孔加质粒2 μg),SHIN1组加入终浓度为10 nmol·L-1抑制剂SHIN1。质粒转染时间均为48 h,转染完成后进行后续实验。
1.3免疫组化染色实验 结肠癌及癌旁组织手术标本来自于武汉协和医院病理科,随机选取20对,其临床分期为Ⅰ—Ⅲ期,取材日期为2021—2022年。用40%甲醛溶液固定组织标本,然后用石蜡进行包埋,将石蜡组织切成厚度4 mm的切片。免疫组化染色检测SHMT2蛋白表达。SHMT2蛋白主要染色于细胞质,部分染色于细胞核。蛋白表达水平通过阳性比例评分与强度评分相乘计算染色指标,其中比例评分为显示阳性染色细胞的比例(0:<10%;1:10%~30%;2:31%~70%;3:>70%),强度评分是染色强度的评分(0:无染色;1:弱染色;2:中等染色;3:强染色)。
1.4数据库筛选及数据处理 从TCGA数据库下载并整理TCGA-COAD(结肠腺癌)项目STAR流程的RNAseq数据,并提取TPM格式的数据以及临床数据。选择合适的统计方法进行统计(运用R语言stats包以及car包),对数据进行可视化(ggplot2包),分析不同组织蛋白表达的差异水平。统计方法: Wilcoxon rank sum test。使用R语言的survival包进行比例风险假设检验并进行拟合生存回归,结果用survminer包及ggplot2包进行可视化,分析不同蛋白表达的生存预后情况。采用Logrank检验。
1.5细胞培养及质粒转染 HCT116细胞用含10%胎牛血清的高糖培养基培养,孵育于含5%二氧化碳(CO2)的37 ℃恒温培养箱内,可用含EDTA的胰酶进行消化传代。在HCT116细胞中用TurboFect试剂转染相关质粒,孵育36~48 h后进行后续操作。
1.6细胞克隆形成实验 将预处理细胞消化后,用完全培养基重悬,并进行细胞计数。取细胞约500个加入6孔板中,补足含血清的培养基。连续培养10~14 d,中间每隔2~3 d换液一次。待细胞克隆数足够后中止实验,用4%多聚甲醛固定细胞,龙胆紫进行染色。洗涤充分后进行摄像,计算单孔内细胞克隆数目,重复3次,取平均值。
1.7蛋白印迹实验(Western blotting)检测蛋白 在冰上用NP40将处理的细胞裂解15 min。将裂解产物在12 000 r·min-1,4 ℃,离心10 min,并使用BCA蛋白浓度检测试剂盒测量上清液的蛋白浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离蛋白后转移到聚偏氟乙烯(Polyvinylidene fluoride,PVDF)膜上。将PVDF膜与特定抗体孵育,并用化学发光溶液进行检测。
1.8蛋白质免疫共沉淀 将HEK293T全细胞裂解液与特异性抗体孵育过夜,然后在4 ℃添加蛋白A/G珠,旋转2~4 h。用NP40溶液洗涤3次,与SDS样品缓冲液混合。蛋白质印迹法验证不同蛋白的结合关系。
1.9统计学方法 采用SPSS 20.0版统计软件和GraphPad prism软件进行统计学分析。对每组数据进行正态检验,符合正态分布的两组间差异比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1SHMT2在结肠癌组织的表达 结果见图1。结果显示SHMT2在癌组织中表达水平显著高于癌旁对照组织。

①与癌旁组织比较,t=11.93,P<0.01。
2.2SHMT2高表达与结肠癌不良预后相关性 对TCGA数据库进行数据分析,结肠腺癌的癌组织中SHMT2的mRNA表达水平显著高于癌旁正常组织(图2A)。相关预后分析发现,SHMT2高表达组5年疾病特异性生存率显著低于SHMT2低表达组(图2B)。说明SHMT2高表达与结肠癌的不良预后密切相关,提示其可能起到致癌作用。
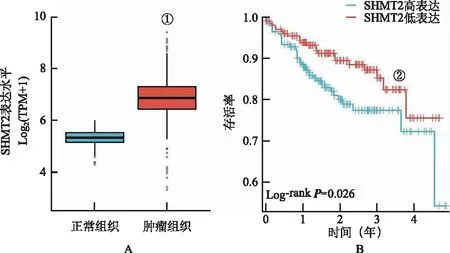
①与正常组织比较,P<0.01;②与SHMT2高表达组比较,P<0.05。
2.3低表达SHMT2或SHMT2抑制剂(SHIN1)对HCT116细胞增殖能力的抑制作用 在HCT116细胞中转染shNC或shSHMT2质粒,用细胞克隆形成实验进行检测。Western blotting结果显示,在HCT116细胞中转染shSHMT2质粒后,SHMT2蛋白被显著下调,低表达SHMT2可显著抑制HCT116细胞的增殖能力。为了验证SHIN1对结肠癌细胞系的具体作用,将HCT116细胞分为NC对照组和SHIN1抑制剂组。根据SHIN1抑制剂说明书及相关参考文献,将其作用终浓度选择为10 nmol·L-1。将细胞处理后进行细胞克隆实验发现,SHMT2抑制剂也可明显抑制HCT116细胞增殖,见图3。

①与shNC空白组比较,t=4.651,P=0.0097;②与NC空白组比较,t=6.413,P=0.003。
2.4SHIN1对HCT116细胞增殖的影响 Western blotting结果显示,在HCT116细胞中转染Flag-SHMT2质粒转染后,SHMT2成功过表达(图4A)。与vector对照组比较,过表达SHMT2组增殖水平显著升高,而加入SHIN1可逆转过表达SHMT2对细胞增殖的促进作用,见图4B和C。

①与vector空载对照组对比,t=6.172,P=0.003 5;②与Flag-SHMT2过表达组比较,t=6.405,P=0.003 1。
2.5SHMT2对SQSTM1蛋白调控作用 在HCT116及LoVo细胞中转染shNC对照质粒、shSHMT2#1或shSHMT2#2干扰质粒,通过蛋白印迹实验发现低表达SHMT2可下调SQSTM1的蛋白水平(图5A)。在293T细胞中,通过蛋白免疫共沉淀实验发现SHMT2可结合SQSTM1蛋白(图5B)。说明SHMT2能够与SQSTM1蛋白结合并调控其蛋白水平。

图5 SHMT2蛋白结合并调控SQSTM1蛋白水平
2.6SHMT2促进HCT116细胞增殖依赖于SQSTM1为了进一步验证SHMT2调控结肠癌细胞增殖是否依赖于SQSTM1通路,本研究设计了相关逆转实验。将HCT116细胞分为三组,即shNC对照组、shSHMT2低表达组、shSHMT2+Flag-SQSTM1回复组,转染相应质粒后,通过细胞克隆形成实验发现,低表达SHMT2对HCT116细胞增殖的抑制作用可被高表达SQSTM1所逆转(图6A和B)。说明SHMT2对HCT116细胞增殖的促进作用依赖于SQSTM1蛋白。

①与shNC对照组对比,t=4.986,P=0.0076;②与shSHMT2低表达组对比,t=7.291,P=0.001 9。
3 讨论
结直肠癌是全球范围内的一种常见恶性肿瘤,在男性和女性癌症发病率中分别是第三和第二常见[2]。尽管在过去的几十年里,其总体发病率和病死率显著下降,但晚期结肠癌患者总体生存率仍然很差。因此,亟需进一步研究结肠癌发生发展的调控机制,发现新的治疗靶点。
SHMT2是一种磷酸吡哆醛依赖性四聚体酶,可催化丝氨酸向甘氨酸的可逆转变,从而促进一碳单位的产生,而一碳单位对于细胞生长以及氧化还原和表观遗传状态的调节是必不可少的[6]。丝氨酸和甘氨酸是一碳单位主要来源,对细胞增殖至关重要[7]。在低氧环境下,SHMT2可以上调并促进还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)和谷胱甘肽的生成,以维持氧化还原平衡[8]。越来越多的证据表明,SHMT2促进细胞增殖和肿瘤生长,并与不良预后密切相关[6,9]。但SHMT2对结肠癌增殖的调控及其具体分子机制并不清楚。
在本研究中,通过数据分析发现SHMT2在结肠癌癌组织中蛋白水平显著高于相应的癌旁组织,而且SHMT2高表达与结肠癌的不良预后相关,进而通过相关细胞实验发现SHMT2在结肠癌细胞系HCT116中可促进肿瘤细胞增殖,验证SHMT2抑制剂也可显著抑制结肠癌细胞增殖。进一步通过免疫共沉淀法发现并验证SHMT2和SQSTM1可以相互结合,而且通过蛋白印迹实验发现低表达SHMT2可下调SQSTM1蛋白的表达水平。SQSTM1是一种自噬的衔接蛋白,在维持细胞稳态中发挥重要作用。此外,它通过与Keap1、TRAF6、IKK2/β等关键信号蛋白相互作用来激活包括Nrf2、mTORC1和NF-κB在内的许多信号通路[10]。SQSTM1在肝细胞癌和乳腺癌等肿瘤中表达上调,与肿瘤细胞增殖密切相关[11]。SQSTM1在多种癌症中被认为是一种新的癌蛋白,具有激活多种致癌信号通路的潜力[12]。自噬受阻可导致p62高表达,与不良临床预后相关[12]。在细胞系HCT116中敲低SHMT2同时高表达SQSTM1,发现高表达SQSTM1可逆转敲低SHMT2对肿瘤细胞增殖的抑制作用。从而验证SHMT2可通过结合并上调SQSTM1表达促进结肠癌细胞增殖。
本研究通过生信分析和细胞实验发现SHMT2是结肠癌细胞增殖的关键因子,并发现SHMT2-SQSTM1信号轴在相关调控中的重要作用,探索了SHMT2抑制剂对结肠癌治疗的潜在应用前景,为结肠癌发生发展的机制研究提供新的线索和思路,为其临床治疗提供潜在的干预靶点。

