壮药双路通脑方对缺血-再灌注脑损伤大鼠神经元自噬和凋亡的影响*
梅小平,翟阳,王凯华,滕红丽,郑光珊,杨鹏,邹敏
(1.广西国际壮医医院医务部,南宁 530200;2.广西国际壮医医院脑病科,南宁 530200;3.广西中医药大学,南宁 530200;4.广西国际壮医医院科技部,南宁 530200;5.广西国际壮医医院儿科,南宁 530200)
缺血性脑卒中(ischemic stroke,IS)是一种具有高发病率和高死亡率的常见疾病[1]。目前,静脉溶栓和取栓是IS的首选治疗手段[2]。然而,血流恢复后,往往导致缺血-再灌注(ischemia-reperfusion,I/R)损伤,进一步加重脑损伤,目前仍无有效的治疗方法。神经保护作用是指抑制神经元凋亡以挽救缺血半影区神经功能。因此,开发能够抑制缺血半影区神经元凋亡的治疗剂已成为该领域的一项重要任务。细胞凋亡和自噬是维持细胞稳态的两个重要细胞过程。自噬是真核细胞用于降解长寿蛋白质和受损细胞器的主要调节分解代谢机制,介导细胞存活和凋亡[3-4]。现代研究表明细胞凋亡[5-6]是IS的重要病理特征之一,IS引起的脑I/R损伤病理机制(如神经元凋亡)与自噬有关[7],自噬对IS具有双向作用,通过调节自噬可抑制神经元凋亡减轻脑损伤[4]。腺苷酸活化蛋白激酶(AMP-activated kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(mammalian target rapamycin,mTOR)信号通路可调节脑I/R后的自噬激活,是一种通过调节自噬来治疗脑I/R损伤的新型治疗靶点。研究显示,AMPK/mTOR可通过Unc-51样激酶1(UNC-51-like Kinase 1,ULK1)的磷酸化调节脑I/R诱导的自噬[8-9]。双路通脑方由广西特色壮药(如扶芳藤、黄花倒水莲、田七、茯苓等)配伍而成,治疗IS疗效显著,能改善患者的神经功能,提高生活质量[10]。双路通脑方在脑缺血损伤中发挥神经保护作用的证据以及其对IS的改善作用是否与AMPK/mTOR信号通路介导的自噬有关尚不完全清楚。因此,本研究基于AMPK/mTOR信号通路探讨壮药双路通脑方对脑I/R诱导的神经元自噬和凋亡的影响,以期为双路通脑方在IS等脑部疾病中的应用提供进一步的证据。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级雄性SD大鼠108只,体质量250~300 g,购自中国科学院上海药物研究所,实验动物生产许可证号:SCXK(沪)2020-0005。所有大鼠均保持在相对湿度(50%~70%)和温度(25±2)℃的环境中,明暗循环为12 h:12 h。术前所有大鼠禁食12 h。
1.2药物与试剂 双路通脑方组成:扶芳藤20 g、黄花倒水莲15 g、田七15 g、茯苓15 g、法半夏20 g、苍术15 g、桂枝尖15 g、南山楂20 g、肉苁蓉15 g、陈皮15 g、生姜15 g、火麻仁15 g、炙甘草5 g,以上中药饮片来源于广西国际壮医医院,批号依次为20210101,20200601,20200901,20210102,20201102,20201201,20200602,20200901,20200701,20210101,20210401,20210101和20201201,并经广西国际壮医医院药学部黄琳芸副主任中药师鉴定均为正品。按常规方法煎煮、过滤,并浓缩至每毫升含原药材2 g。AMPK激活剂阿卡地新(acadesine,AICAR)(美国MedChemExpress公司,批号:HY-13417,含量:99.71%);2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色液(北京Solarbio公司,批号:G3005,含量:2%);苏木精-伊红(HE)染色试剂盒(批号:C0105S)、TUNEL细胞凋亡检测试剂盒(批号:C1086,绿色荧光)、DAPI染色液(批号:C1006)均购自上海碧云天生物技术有限公司;兔源一抗LC3B(批号:ab48394)、Beclin-1(批号:ab207612)、p62(批号:ab155686)购自英国Abcam公司;微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC-3)A/B(#4108)、AMPK(#5831)、p-AMPK(#2535)、mTOR(#2972)、p-mTOR(#5536)、ULK1(#8054)、p-ULK1(Ser757,#14202)、p-ULK1(Ser317,#37762)和山羊抗兔IgG二抗(#14708)购自美国Cell Signaling Technology公司。
1.3仪器 BX61电动显微镜(日本Olympus公司);Hitachi H-7650透射电子扫描显微镜(日本日立公司);TCS SP5共聚焦激光扫描显微镜(德国Leica公司)。
1.4实验分组、给药与造模 采用随机数字表法将SD大鼠分为假手术组、模型对照组和小、中、大剂量双路通脑方组及大剂量双路通脑方+AICAR组,每组18只。采用线栓法制备大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型[11]。首先,腹腔注射戊巴比妥钠溶液3 mL·kg-1对大鼠进行麻醉。然后,在颈部右侧做一个2 cm的纵向切口,分离并暴露右侧颈总动脉、颈内动脉和颈外动脉。结扎颈总动脉近心端和颈内动脉,于颈外动脉远心端剪一“V”形小切口。将线栓通过此切口插入颈内动脉,然后轻轻朝向Willis环推进18~22 mm,遇到阻力后停止。缺血2 h后缓慢拉出线栓以允许再灌注。假手术组不插线栓,仅分离血管。手术期间使用温度调节的加热垫将直肠温度控制在(37±0.5) ℃。待大鼠清醒后,采用5级评分法对其神经功能缺损程度进行评分,评分为1~3分的大鼠纳入研究。
MCAO术前,小、中、大剂量双路通脑方组和大剂量双路通脑方+AICAR组灌胃给予相应剂量双路通脑方煎液,每天1次,连续7 d。假手术组及模型对照组给予等量0.9%氯化钠溶液灌胃;大剂量双路通脑方+AICAR组在造模前60 min腹腔注射AICAR 50 mg·kg-1[12]。剂量换算:根据人和动物的体表面积计算药物的等效剂量(大鼠的日剂量相当于成人的6.3倍)。成人平均体质量按70 kg计,成人每日双路通脑方的给药剂量相当于生药200 g,换算成大鼠的日给药剂量为200 g/70 kg×6.3=18.0 g·kg-1,因此设置9.0,18.0,36.0 g·kg-1为小、中、大剂量。
1.5神经功能缺损评分 在大鼠清醒后和MCAO术后24 h,一名对整个实验不知情的研究人员评估大鼠神经功能缺损的程度。采用5级评分法进行神经功能缺损评估[13]。0分:没有明显的神经功能缺损;1分:对侧前爪未完全伸直;2分:向对面盘旋;3分:跌倒对侧;4分:无法行走。
1.6TTC染色检测脑梗死体积 MCAO术后24 h评估梗死体积。每组按照随机数字表法选取大鼠6只,取出脑组织并在-20 ℃下冷冻30 min,然后切成2 mm厚的冠状切片,并在2% TTC中于37 ℃下孵育30 min。每个切片在4%多聚甲醛中浸泡24 h,然后摄像。Image J软件用于分析梗死区域,计算梗死率。梗死率(%)=梗死脑组织(白色)体积/对侧大脑半球体积×100%。
1.7HE染色观察神经元形态学变化 每组按照随机数字表法随机选取大鼠6只,取脑组织并将其冠状切分为两部分,一部分将海马CA1区切成1 mm×1 mm×1 mm的小块,并在4 ℃下固定在2.5%戊二醛中;另一部分用4%多聚甲醛固定,石蜡包埋,切成5 μm厚的切片,并将切片放置在载玻片上进行HE染色。光学显微镜下观察缺血半影区海马CA1区神经元形态学变化。
1.8TUNEL染色检测神经元凋亡 取脑组织石蜡切片,经脱蜡、水化后将切片用蛋白酶K溶液(20 μg·mL-1)在37 ℃下透化30 min,然后用3%过氧化氢(H2O2)溶液灭活内源性过氧化物酶10 min。磷酸盐缓冲液(PBS)洗涤后,将末端脱氧核苷酸转移酶(TdT)和荧光素添加到切片中,并在37 ℃下避光孵育2 h。随后,用DAPI将细胞核染色。抗荧光淬灭剂封片,用荧光显微镜观察切片并拍摄图像。Image-Pro Plus 6.0版软件用于量化TUNEL阳性神经元的数量,计算凋亡指数(apoptosis index,AI)。AI(%)=TUNEL阳性细胞数/细胞总数×100%。
1.9透射电子显微镜(transmission electron microscope,TEM)观察自噬小体的形成 将固定在2.5%戊二醛中脑组织块用PBS洗涤后,在4 ℃下浸入1%四氧化锇中2 h。然后,将组织块在分级乙醇溶液中脱水并包埋在环氧树脂中,然后将块切成超薄切片(厚度60~70 nm),用柠檬酸铅和醋酸双氧铀染色后,使用TEM观察自噬小体的形成情况。
1.10免疫荧光(immunofluorescence,IF)染色检测LC3-Ⅱ的表达 将脑组织切片(厚度5 μm)脱蜡、水化后进行抗原修复。然后,用3% H2O2孵育10 min灭活,以内源性过氧化物酶,5%牛血清白蛋白封闭后,与兔源LC3B一抗(1:200)在4 ℃下孵育过夜。用PBS冲洗后,切片与山羊抗兔IgG(H+L)荧光二抗(1:200)在室温下孵育2 h。细胞核用DAPI染色。用抗荧光淬灭剂封固后,在荧光显微镜下观察海马神经元中LC3-Ⅱ的阳性表达,并计算LC3-Ⅱ阳性表达的平均荧光强度(mean fluorescent intensity,MFI)。
1.11Western blotting检测自噬标志基因Beclin-1、LC3A/B、p62及AMPK/mTOR信号通路相关蛋白的表达 每组剩余大鼠6只,取脑后分离海马组织,在冰冷的RIPA裂解液中裂解10 min,12 000×g离心15 min。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropho-resis,SDS-PAGE)分离等量的总蛋白。之后,将蛋白质转移到聚偏二氟乙烯膜。在室温下将膜在5%脱脂牛奶中封闭1 h,然后与一抗LC3A/B(1:1000)、Beclin-1(1:2000)、p62(1:1000)、AMPK(1:1000)、p-AMPK(1:500)、mTOR(1:1000)、p-mTOR(1:500)、ULK1(1:1000)、p-ULK1(S757)(1:1000)、p-ULK1(S317)(1:1000)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(1:2000)在4 ℃下孵育过夜。然后,将膜与辣根过氧化物酶缀合的山羊抗兔IgG二抗(1:3000)在室温下孵育1 h。增强型化学发光剂显影后,使用Image J软件测量目标蛋白的灰度值。GAPDH用作上样对照。

2 结果
2.1大鼠神经功能缺损评分 与假手术组神经功能缺损评分0分比较,模型对照组神经功能缺损评分(2.89±0.30)显著升高(P<0.05);与模型对照组比较,小、中、大剂量双路通脑方组神经功能缺损评分分别为(2.46±0.27),(2.01±0.22),(1.50±0.18),均显著降低(均P<0.05),且呈剂量依赖性;与大剂量双路通脑方组比较,大剂量双路通脑方+AICAR组神经功能缺损评分为(2.62±0.29),显著升高(P<0.05)。
2.2大鼠脑梗死体积的影响 与假手术组梗死体积比为0%比较,模型对照组脑梗死体积(32.16±2.57)%,显著升高(P<0.05);与模型对照组比较,小、中、大剂量双路通脑方组脑梗死体积分别为(24.58±2.39)%,(17.43±2.12)%,(9.81±1.45)%,均显著降低(均P<0.05),且呈剂量依赖性;与大剂量双路通脑方组比较,大剂量双路通脑方+AICAR组脑梗死体积(28.50±2.36)%,显著升高(P<0.05)。见图1。
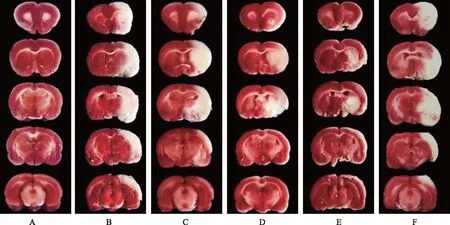
A:假手术组;B:模型对照组;C:小剂量双路通脑方组;D:中剂量双路通脑方组;E:大剂量双路通脑方组;F:大剂量双路通脑方+AICAR组。
2.3大鼠神经元病理损伤的影响 HE染色结果显示,假手术组缺血半影区海马CA1区神经元形态规则,排列整齐,细胞核完整;模型对照组缺血半影区海马神经元结构紊乱,细胞膜破坏,细胞形态肿胀,大量神经元丢失死亡,核部分溶解固缩;与模型对照组比较,小、中、大剂量双路通脑方组缺血半影区神经元形态较规则,有少数神经元退化坏死,核固缩、细胞膜和细胞结构破坏得到明显改善;且大剂量双路通脑方组对神经元损伤的改善程度优于中、小剂量双路通脑方组;大剂量双路通脑方+AICAR组神经元损伤较大剂量双路通脑方组明显加重,神经元数量减少,坏死神经元增多。见图2。

A:假手术组;B:模型对照组;C:小剂量双路通脑方组;D:中剂量双路通脑方组;E:大剂量双路通脑方组;F:大剂量双路通脑方+AICAR组。
2.4大鼠神经元凋亡的影响 与假手术组比较,模型对照组缺血半影区海马CA1区神经元凋亡率显著升高(P<0.05);与模型对照组比较,小、中、大剂量双路通脑方组神经元凋亡率显著降低(P<0.05),且呈剂量依赖性;与大剂量双路通脑方组比较,大剂量双路通脑方+AICAR组神经元凋亡率显著升高(P<0.05)。见图2,表1。
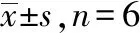
表1 6组大鼠神经元凋亡率和自噬小体数量比较
2.5大鼠缺血半影区海马CA1区神经元自噬小体形成的影响 假手术组神经元正常,具有完整的细胞核、线粒体、溶酶体和内质网;模型对照组神经元可以发现许多溶酶体和自噬体,细胞形态受到严重影响,神经元空泡化,线粒体明显肿胀,嵴部分断裂;与假手术组比较,模型对照组自噬小体数量显著增加(P<0.05);与模型对照组比较,小、中、大剂量双路通脑方组自噬小体数量显著减少(P<0.05),且呈剂量依赖性;与大剂量双路通脑方组比较,大剂量双路通脑方+AICAR组神经元自噬小体数量显著增加(P<0.05)。见图2,表1。
2.6大鼠缺血半影区海马CA1区LC3-Ⅱ阳性表达的影响 与假手术组缺血半影区海马CA1区LC3-Ⅱ阳性表达(0.031±0.004)比较,模型对照组阳性表达(0.084±0.009)显著升高(P<0.05);与模型对照组比较,小、中、大剂量双路通脑方组LC3-Ⅱ阳性表达分别为(0.070±0.008),(0.057±0.006),(0.044±0.005),均显著降低(均P<0.05),且呈剂量依赖性;与大剂量双路通脑方组比较,大剂量双路通脑方+AICAR组LC3-Ⅱ阳性表达为(0.075±0.008),显著升高(P<0.05)。见图3。

A:假手术组;B:模型对照组;C:小剂量双路通脑方组;D:中剂量双路通脑方组;E:大剂量双路通脑方组;F:大剂量双路通脑方+AICAR组。
2.7大鼠海马组织LC3、Beclin-1、p62蛋白表达的影响 与假手术组比较,模型对照组LC3-II/LC3-I比值和Beclin-1蛋白水平显著升高,p62蛋白水平显著降低(P<0.05);与模型对照组比较,小、中、大剂量双路通脑方组LC3-II/LC3-I比值和Beclin-1蛋白水平显著降低,p62蛋白水平显著升高(P<0.05),且呈剂量依赖性;与大剂量双路通脑方组比较,大剂量双路通脑方+AICAR组LC3-II/LC3-I比值和Beclin-1蛋白水平显著升高,p62蛋白水平显著降低(P<0.05)。见图4,表2。
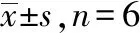
表2 6组大鼠海马组织LC3、Beclin-1、p62蛋白表达比较

A:假手术组;B:模型对照组;C:小剂量双路通脑方组;D:中剂量双路通脑方组;E:大剂量双路通脑方组;F:大剂量双路通脑方+AICAR组。
2.8大鼠海马组织AMPK/mTOR信号通路相关蛋白表达的影响 与假手术组比较,模型对照组的p-AMPK/AMPK和p-ULK1(S317)/ULK1比值显著升高,p-mTOR/mTOR和p-ULK1(S757)/ULK1比值显著降低(P<0.05);与模型对照组比较,小、中、大剂量双路通脑方组p-AMPK/AMPK和p-ULK1(S317)/ULK1比值显著降低,p-mTOR/mTOR和p-ULK1(S757)/ULK1比值显著升高(P<0.05),且呈剂量依赖性;与大剂量双路通脑方组比较,大剂量双路通脑方+AICAR组p-AMPK/AMPK和p-ULK1(S317)/ULK1比值显著升高,p-mTOR/mTOR和p-ULK1(S757)/ULK1比值显著降低(P<0.05)。见图5,表3。
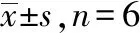
表3 6组大鼠海马组织AMPK/mTOR信号通路相关蛋白表达比较
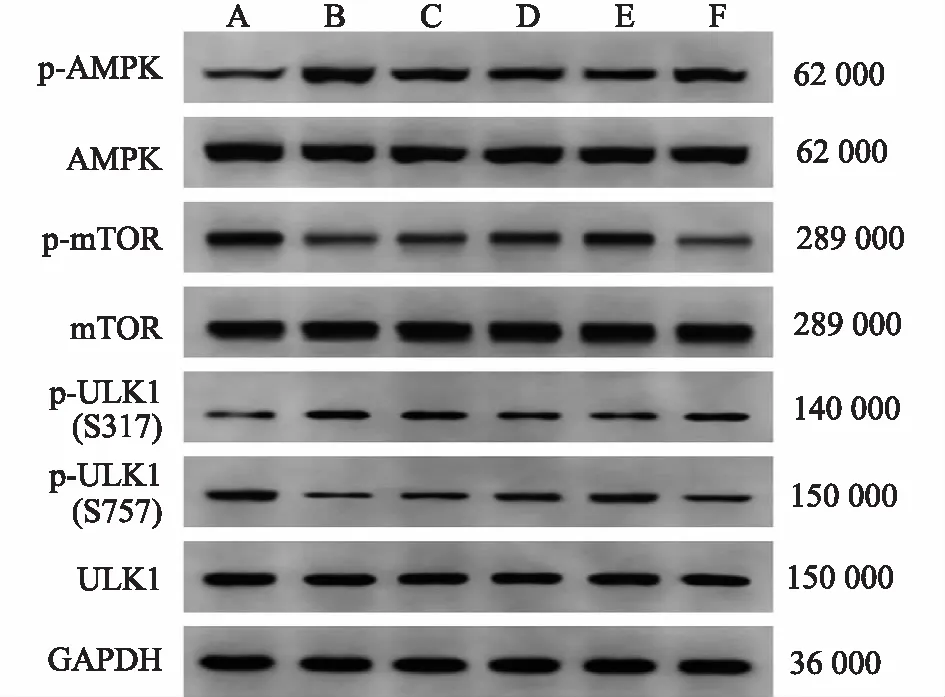
A:假手术组;B:模型对照组;C:小剂量双路通脑方组;D:中剂量双路通脑方组;E:大剂量双路通脑方组;F:大剂量双路通脑方+AICAR组。
3 讨论
在我国,中药已广泛用于预防或治疗脑缺血或IS及其并发症,如补阳还五汤[11]、安宫牛黄丸、银杏叶等[14]。壮医是祖国传统医学的重要组成部分,在IS中有其独特的生理病理观和治疗原则。壮医将大脑称为“巧坞”,人的神智、思维和认知行为均属于“巧坞”的功能。壮医认为“三道两路”(气道、水道、谷道、龙路、火路)是人体内部气血化生和运行的关键。IS的病因毒邪经“三道两路”侵入人体脏腑组织,加之外感毒邪,“三道两路”运行不畅,气血运行失常,脏腑失去濡养,痰瘀阻滞,湿热内生,引发“巧坞崩”。因此,通调“三道两路”提升脏腑功能是IS的重要治疗原则[15-16]。双路通脑方中扶芳藤、黄花倒水莲和田七均是广西特色壮药,具有通火路、龙路、祛湿解毒、活血化瘀的功效。茯苓善渗泄水湿,使湿无处聚,痰无由生;苍术能健运脾胃、祛除寒湿;法半夏、陈皮有燥湿化痰、理气健脾的作用。提示双路通脑方具有祛除体内毒邪,疏通龙路、火路,使“三道两路”恢复平衡的作用。
研究证实,双路通脑方对IS疗效确切[10]。在本研究中,双路通脑方以剂量依赖性方式改善MCAO大鼠的神经功能,并减少脑梗死体积和神经元凋亡。提示双路通脑方对IS具有神经保护作用,这与以往的研究结果一致。此外,双路通脑方减少了海马CA1区自噬小体的形成,抑制LC3-II/LC3-I比值的增加,并增加缺血半影区海马中p62水平,下调了Beclin-1表达;表明双路通脑方的神经保护作用与抑制自噬有关。本研究结果也与之前的其他研究一致[8-9],这表明抑制自噬可改善再灌注24 h后的缺血性脑损伤。然而,SUN等[17]报道,自噬的诱导可防止再灌注24 h后的脑I/R损伤。适当的自噬对缺血性神经组织具有保护作用,而过度的自噬可能导致细胞死亡。自噬在IS中的作用存在争议,可能是由于不同的动物品系、缺血模型和缺血时间以及评估自噬的治疗时间窗的差异造成的。此外,WANG等[18]提出自噬对IS有益还是有害取决于自噬的程度和持续时间。本研究表明,自噬对IS有害,双路通脑方预处理介导的自噬抑制可进一步减少梗死体积并改善神经功能缺损。因此,IS的潜在治疗策略是优化自噬水平,而双路通脑方可能有助于实现这一目标。
AMPK/mTOR信号通路可以通过ULK1的协同磷酸化来调节脑I/R后的自噬激活。AMPK是哺乳动物细胞中mTOR的上游调节因子,AMPK促进自噬,mTOR抑制自噬[19]。AMPK通过Ser317的磷酸化直接激活自噬起始激酶ULK1来促进自噬。高mTOR活性通过磷酸化ULK1 Ser757并破坏ULK1和AMPK之间的相互作用来防止ULK1活化[20]。活化的AMPK可以抑制mTOR激活以减少ULK1在Ser757上的磷酸化。本研究发现,在MCAO术后,p-AMPK和p-ULK1 Ser317水平上调,而p-mTOR和p-ULK1 Ser757水平下调;这些结果与黄亚光等[8]研究结果一致。表明AMPK的活化抑制mTOR减少S757-ULK1磷酸化,然后磷酸化S317-ULK1,在脑I/R损伤期间诱导自噬。双路通脑方显著降低了p-AMPK和p-ULK1 Ser317的水平,同时增加了p-mTOR和p-ULK1 Ser757的水平。在给予AICAR激活AMPK后,自噬水平增加,双路通脑方的神经保护作用和对AMPK/mTOR信号通路的调节作用被明显减弱。提示双路通脑方可能通过调节AMPK/mTOR信号通路抑制神经元的过度自噬。
综上所述,双路通脑方可抑制脑I/R诱导的自噬和神经元凋亡,其作用机制可能涉及抑制AMPK和ULK1在S317处的磷酸化,以及增强mTOR和ULK1在Ser757处的磷酸化。本研究以脑I/R诱导的自噬和神经元凋亡为病理基础,在免疫组织学上对自噬和凋亡进行了分析,以自噬为研究重点,采用TUNEL染色检测神经元凋亡来验证双路通脑方调节自噬改善脑损伤的结果,今后将增加凋亡相关蛋白表达的检测,进一步对神经元凋亡进行验证。此外,在给予AICAR激活AMPK后,与单独应用大剂量双路通脑方组相比,大鼠脑组织自噬水平增加,双路通脑方的神经保护作用和对AMPK/mTOR信号通路的调节作用被明显减弱,提示双路通脑方可能是通过调节AMPK/mTOR信号通路发挥作用。为减少实验动物用量,降低实验成本,符合动物实验的3R原则,故未进行模型对照组+AICAR组相关研究,在后续的研究中将继续对小、中剂量双路通脑方+AICAR组进行研究,验证实验结果是否呈剂量依赖性,来进一步增强实验结果的准确性和可靠性。同时尚不清楚双路通脑方是否还调节其他途径以及其在不同缺血时间中对自噬是否发挥相同作用,还待进一步研究。

