基于网络药理学初探金芪降糖片治疗肥胖的作用机制
王瑾源 原茵 董梦雪 谭雅文 吕萌 王洪武 郑纺
〔摘要〕 目的 观察金芪降糖片对C57BL/6肥胖模型小鼠的治疗效果,并基于网络药理学预测金芪降糖片治疗肥胖的相关机制。方法 选取30只SPF级雄性C57BL/6小鼠,分为正常组、模型组、金芪降糖片组。正常组饲喂正常饲料,模型组及金芪降糖片组饲喂高脂饲料,模型复制成功后给予药物干预。检测C57BL/6小鼠体质量、血脂水平、体内脂肪含量及肝脏、脂肪组织形态。通过TCMSP数据库与GeneCards数据库筛选金芪降糖片治疗肥胖的活性成分及交集靶点;将交集靶点导入STRING数据库分析靶点间的相互作用;通过Biocondoctor数据库进行GO分析和KEGG通路富集分析。基于网络药理学的预测结果,运用Western blot验证关键信号通路的蛋白表达。结果 与空白组相比,模型组小鼠体质量及血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(lipoprotein cholesterol, LDL-C)含量均升高(P<0.05),高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)含量降低(P<0.05),肝脏组织中脂滴蓄积明显增多,脂肪细胞数目增多、体积增大;与模型组相比,金芪降糖片组小鼠体质量及血清TG、TC、LDL-C含量均降低(P<0.05),HDL-C含量升高(P<0.05),肝脏组织中脂滴蓄积情况改善,脂肪细胞数目减少、体积缩小;Micro-CT结果显示,与空白组相比,模型组小鼠体内白色脂肪及棕色脂肪含量均明显升高(P<0.01),而金芪降糖片可减少两类脂肪含量(P<0.01)。同时,金芪降糖片也可改善肥胖小鼠肝脏与脂肪组织变性。通过网络药理学預测得到金芪降糖片治疗肥胖的55个共同靶点及其79条富集通路。KEGG富集分析得到金芪降糖片治疗肥胖的作用机制可能与流体剪切应力和动脉硬化、糖尿病并发症中的AGE-RAGE信号通路、TNF信号通路、PPARγ信号通路等密切相关。Western blot结果显示,与空白组相比,模型组小鼠脂肪组织中PPARγ信号通路关键蛋白明显上调;与模型组相比,金芪降糖片组小鼠脂肪组织中PPARγ信号通路关键蛋白明显下调。结论 金芪降糖片可有效减轻肥胖小鼠体重、改善血脂异常、降低体内脂肪含量、改善肝脏组织中脂滴蓄积及脂肪组织中脂肪细胞数量及大小,其可能通过PPARγ信号通路治疗肥胖。
〔关键词〕 金芪降糖片;肥胖;网络药理学;PPARγ信号通路;实验验证
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.017
Mechanisms of Jinqi Jiangtang Tablet in treating obesity based on network pharmacology
WANG Jinyuan1, YUAN Yin1, DONG Mengxue1, TAN Yawen1, LV Meng2, WANG Hongwu3, ZHENG Fang1*
1. Integrated Chinese and Western Medicine College, Tianjin University of Chinese Medicine, Tianjin 301617, China;
2. Shunrong Pharmaceutical Factory, Da Rentang Group Co., LTD. Tianjin 300457, China; 3. Chinese Medicine College,
Tianjin University of Chinese Medicine, Tianjin 301617, China
〔Abstract〕 Objective To observe the therapeutic effects of Jinqi Jiangtang Tablet on C57BL/6 obese mice, and predict the related mechanism of Jinqi Jiangtang Tablet in treating obesity based on network pharmacology. Methods The total of 30 SPF male C57BL/6 mice were selected and divided into normal group, model group and Jinqi Jiangtang Tablet group. Normal group was fed normal diet, model group and Jinqi Jiangtang Tablet group were fed high-fat diet, and drug intervention was given after successful model replication. Body weight, lipid level, fat content, liver and adipose tissue morphology of C57BL/6 mice were determined. The active ingredients and intersection targets of Jinqi Jiangtang Tablet in treating obesity were screened by TCMSP and GeneCards databases. The intersection targets were imported into STRING database to analyze the interaction between targets. GO analysis and KEGG pathway enrichment analysis were performed with Biocondoctor database. The protein expression of key signaling pathways was verified with Western blot based on the prediction results of network pharmacology. Results Compared with control group, the body weight and serum content of triglyceride (TG), total cholesterol (TC) and low density lipoprotein cholesterol (LDL-C) in model group were higher (P<0.05) while high density lipoprotein cholesterol (HDL-C) content was lower (P<0.05). The lipid droplet accumulation in liver tissue increased significantly, and the number and volume of adipose cells increased. Compared with model group, the body weight and serum content of TG, TC and LDL-C in Jinqi Jiangtang Tablet group were lower (P<0.05), while HDL-C content was higher (P<0.05). The accumulation of lipid droplets in liver tissue was improved, and the number and volume of adipose cells decreased. Micro-CT showed that compared with control group, the content of white fat and brown fat in model group were significantly higher (P<0.01), while Jinqi Jiangtang Tablet could reduce the content of two kinds of fat (P<0.01). Meanwhile, Jinqi Jiangtang Tablet could improve liver and adipose tissue degeneration in obese mice. The total of 55 common targets and 79 enrichment pathways of Jinqi Jiangtang Tablet for obesity were predicted by network pharmacology. KEGG enrichment analysis showed that the mechanism of action of Jinqi Jiangtang Tablet in the treatment of obesity may be closely related to fluid shear stress and AGE-RAGE signaling pathway, TNF signaling pathway and PPARγ signaling pathway in arteriosclerosis and diabetes complications. Western blot showed that compared with control group, the key proteins of PPARγ signaling pathway in adipose tissue of mice in model group were significantly up-regulated. Compared with model group, the key proteins of PPARγ signaling pathway in adipose tissue of mice in Jinqi Jiangtang Tablet group were significantly down-regulated. Conclusion Jinqi Jiangtang Tablet can effectively reduce the weight of obese mice, improve dyslipidemia, decrease the body fat content, and improve the accumulation of fat drops in liver tissue and the number and size of fat cells in adipose tissue. It may take effects in treating obesity through PPARγ signaling pathway.
〔Keywords〕 Jinqi Jiangtang Tablet; obesity; network pharmacology; PPARγ signaling pathway; experimental verification
肥胖是影响人类健康的全球性公共卫生问题,根据流行病学数据显示,近年来肥胖的发病率逐年上升,到2030年全球肥胖人数预计将达到11.2亿[1],已被世界卫生组织列为影响人类健康的第五大危险因素。肥胖是一种以体内脂肪细胞数目和体积过度增加,导致体脂率异常增高并伴有局部脂肪组织沉积为特点的慢性代谢性疾病,也是糖尿病、冠心病、高脂血症等多种疾病的共同危险因素[2-4]。因此,肥胖及其引起的一系列疾病逐渐引起了广泛重视。
目前,西医治疗肥胖的主要方法为减少食物摄入、增加能量消耗、药物干预或手术等,其毒副作用难以避免[5]。中医理论认为水湿、痰浊是肥胖的重要病机,因而,多采用祛痰化濁、利水渗湿法治疗。中药复方金芪降糖片是依据《备急千金要方》中的复方黄连丸,结合现代药理学研发的中成药,由黄芪、黄连、金银花组成,具有清热益气、祛痰化浊、利水渗湿之功效,多用以治疗2型糖尿病合并血脂异常[6],但其治疗肥胖的效果及作用机制尚不明确。因此,本实验拟在明确金芪降糖片治疗肥胖的药效学作用基础上,进一步对其治疗肥胖的作用机制进行分析,为金芪降糖片治疗肥胖的临床应用及今后的药物研发提供一定的理论基础。
1 实验方法
1.1 实验药物
金芪降糖片由黄芪、黄连、金银花3味中药组成,药物由津药达仁堂集团股份有限公司隆顺榕制药厂提供,国药准字Z10920027。
1.2 动物
实验采用SPF级雄性C57BL/6小鼠30只,4~5周龄,体质量(20.1±1.2) g。小鼠购买于北京维通利华实验动物技术有限公司,饲养于天津中医药大学实验动物中心,保持室温(22±3) ℃,相对湿度45%~55%,12 h光照(07:00~19:00)。实验经天津中医药大学实验动物伦理委员会审查通过,审批号:TCM-LAEC2021269。
1.3 主要试剂
谷丙转氨酶(alanine transferase, ALT)(批号:C010-1-1)、谷草转氨酶(aspartate transaminase, AST)(批号:C009-1-1)、甘油三酯(triglyceride, TG)(批号:A110-1-1)、总胆固醇(total cholesterol, TC)(批号:A111-1-1)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)检测试剂盒(批号:A112-1-1)、低密度脂蛋白胆固醇(low-density lipo?鄄
protein cholesterol, LDL-C)检测试剂盒(批号:A113-1-1)、尿素氮(blood urea nitrogen, BUN)检测试剂盒(批号:C013-2),均购于南京建成生物工程研究所;二甲苯、无水乙醇、无水甲醇均购买于天津市风船化学试剂科技有限公司;切片石蜡(熔点48~50 ℃)(批号:YA0010)、切片石蜡(熔点60~62 ℃)(批号:YA0014)、中性树胶(批号:G8950)、高效RIPA裂解液(批号:R0010)均购买于北京索莱宝科技有限公司;SDS-PAGE上样缓冲液(还原,5×)(批号:CW0027S)购买于康为世纪生物科技股份有限公司。PPARγ(C26H12) Rabbit mAb(批号:#2435)、C/EBPα(D56F10) XP■ Rabbit mAb(批号:#8178)均购买于美国SCT公司;辣根过氧化物酶标记山羊抗兔IgG(H+L)(批号:A0208)购买于上海碧云天生物技术有限公司。
1.4 主要仪器
Latheta LCT-200型Micro-CT(日立ALOKA公司);HistoCore Arcadia H型石蜡包埋机(徕卡显微系统有限公司);RM2235型手动轮转式石蜡切片机(德国Leica公司);BH-2型光学显微镜(日本Olympus公司);H1210型摊片(徕卡显微系统有限公司);LT-DBX-220F型精密可编程热风循环烘箱(立德泰勀科学仪器有限公司);1658033蛋白电泳系统垂直电泳仪、1645050基础电泳仪(美国Bio-rad伯乐)。
1.5 数据库及软件
所用数据库包括:中药系统药理学数据库与分析平台(TCMSP):http://ibts.hkbu.edu.hk/LSP/tcmsp.php,GeneCards:https://www.genecards.org、韦恩Venny 2.1.0:http://bioinfogp.cnb.csic.es/tools/venny/、String蛋白质相互作用分析平台:https://string-db.org、DAVID 6.8 GO功能和KEGG通路富集分析平台:https://david.ncifcrf.gov;所用软件包括:Cytoscape 3.7.1、R×64 3.6.3、PERL。
1.6 方法
1.6.1 动物分组及药物干预 C57BL/6小鼠适应性喂养1周后,随机分成正常组、模型组、金芪降糖片组,每组10只。金芪降糖片给药剂量按照人体表面积换算法计算,70 kg成年人一日用药剂量为11.76~16.80 g,小鼠等效药物剂量为人体的9.1倍,则小鼠每日灌胃剂量为1.53~2.16 g/kg。称取20 g金芪降糖片药粉溶于40 mL蒸馏水中,得到浓度为0.5 g/mL的金芪降糖片药液。正常组小鼠每日给予正常饲料喂养,模型组及金芪降糖片组给予高脂饲料喂养复制肥胖模型[7],每周称量小鼠体重,12周造模期满后,以模型组小鼠体重高于正常组小鼠体重20%作为肥胖模型复制成功的标志。肥胖模型复制成功后金芪降糖片组每日给予金芪降糖片药液0.2 mL灌胃,正常组与模型组给予等体积生理盐水灌胃,持续12周。
1.6.2 肝肾功能、体质量、血脂水平检测 每周记录一次体质量。取材前小鼠禁食12 h,称重,麻醉后目内眦取血,全血静置30 min,3000×g离心15 min,分离上层血清,按照试剂盒说明书测定TG、TC、HDL-C、LDL-C、ALT、AST、BUN水平。
1.6.3 Micro-CT检测小鼠体内脂肪重量 Micro-CT可根据CT值判断组织的性质,结合软件的处理算法可准确计算出脂肪参数,为肥胖的诊断提供准确依据[8]。将小鼠麻醉后置于Micro-CT体模中,扫描检测小鼠肌肉量、白色脂肪及棕色脂肪总量、皮下脂肪总量、内脏脂肪总量、脂肪率。
1.6.4 HE染色观察小鼠肝脏和脂肪组织形态 取小鼠肝脏和脂肪组织,用4%多聚甲醛溶液固定48 h以上,梯度乙醇脱水,二甲苯透明,石蜡包埋并切片,厚度为5 μm,将石蜡切片置于65 ℃电热干燥箱中烘烤30 min以上,常规HE染色,中性树胶封片,晾干后显微镜下观察各组小鼠肝脏和脂肪组织病理学特征。
1.6.5 金芪降糖片活性成分及靶点、疾病靶点的收集 将黄芪、黄连、金银花分别输入TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php),以口服生物利用度(oral bioavailability, OB)≥30%,类药性(drug likeness, DL)≥0.18作为指标,筛选金芪降糖片的活性成分,建立活性成分及靶点数据集。在GeneCards数据库(https://www.genecards.org/)中检索“obesity”关键词,获得肥胖的疾病靶点。
1.6.6 中药-成分-靶点-疾病可视化网络图的建立 利用R3.5.3軟件(https://www.r-project.org)筛选金芪降糖片和肥胖的交集靶点并绘制韦恩图。将交集靶点导入Cytoscape 3.7.1软件中,获得“中药-成分-靶点-疾病”网络图。
1.6.7 蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络的构建及分析 将交集靶点导入功能蛋白相互作用数据库(String,https://string-db.org),设定物种为“Homo sapiens”,隐藏网络中出现的断开节点,将最低互作分数设为0.4,获得靶点间的互作关系,构建靶点蛋白可视化互作网络并导出。
1.6.8 GO富集分析与KEGG信号通路富集分析 使用Biocondoctor数据库(http://www.bioconductor.org/)及R软件将筛选出的核心靶标基因转化为基因ID,进一步行GO富集分析与KEGG信号通路富集分析,获得相关生物学过程及通路,利用R软件绘制条形图。
1.6.9 Western blot检测小鼠脂肪组织中关键信号通路的蛋白表达 取小鼠附睾白色脂肪组织50 mg,加入200 μL蛋白裂解液(由99%RIPA和1% PMSF配成)裂解,超声研磨1 min后,将组织置于冰上裂解15 min,12 000×g离心15 min;取上清液,BCA定量,加入loading bufffer于95 ℃水浴锅中变性10 min后,置于4 ℃冰箱备用,用于后续电泳。电泳条件:80 V 30 min,待蛋白跑出浓缩胶后将电压调至120 V直到电泳结束;转膜条件:250 mA 60 min。
1.7 数据统计
运用作图法表示实验数据,图中数据以“x±s”表示,运用SPSS 18.0进行单因素方差分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 金芪降糖片对肥胖小鼠的药效学作用
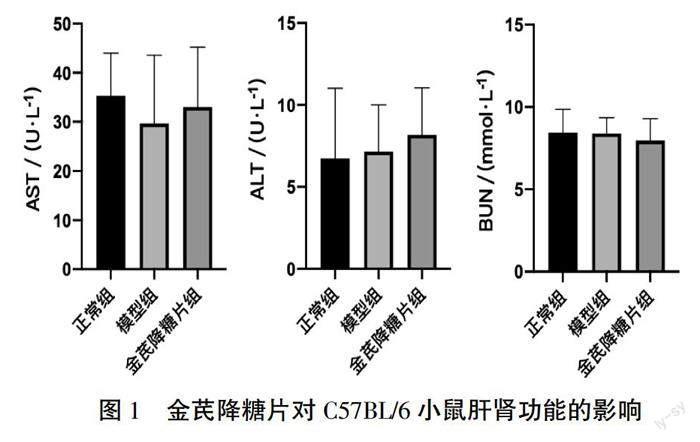
2.1.1 金芪降糖片对肥胖小鼠肝肾功能的影响 与正常组相比,模型组及金芪降糖片组C57BL/6小鼠血清AST、ALT、BUN水平差异无统计学意义(P>0.05),结果提示,金芪降糖片对小鼠无肝肾毒性。详见图1。
2.1.2 金芪降糖片对肥胖小鼠体质量的影响 药物干预第12周,与正常组比较,模型组C57BL/6小鼠体质量明显上升(P<0.01);与模型组比较,金芪降糖片组小鼠体质量明显降低(P<0.01)。详见图2。
2.1.3 金芪降糖片对肥胖小鼠血脂水平的影响 与正常组相比,模型组小鼠血清TG、TC、LDL-C水平显著升高(P<0.05),HDL-C水平显著降低(P<0.05);与模型组比较,金芪降糖片组小鼠血清TG、TC、LDL-C水平显著降低(P<0.05),HDL-C水平显著提高(P<0.05)。详见图3。
2.1.4 金芪降糖片对肥胖小鼠体内脂肪重量的影响
药物干预第12周,使用Micro-CT扫描小鼠腹部及肩胛部,扫描图详见图4—5,图中显示红色为内脏脂肪,黄色为皮下脂肪。与正常组相比,模型组小鼠腹部总白色脂肪量、内脏白色脂肪量、皮下白色脂肪量、白色脂肪率以及肩胛部总棕色脂肪量、内脏棕色脂肪量、皮下棕色脂肪量、棕色脂肪率均显著上调(P<0.05,P<0.01);与模型组相比,金芪降糖片组小鼠腹部总白色脂肪量、内脏白色脂肪量、皮下白色脂肪量、白色脂肪率以及肩胛部总棕色脂肪量、内脏棕色脂肪量、皮下棕色脂肪量、棕色脂肪率显著下调(P<0.01),提示金芪降糖片能够减少小鼠体内白色及棕色脂肪累积,降低小鼠体内白色及棕色脂肪率,详见图6—7。
2.1.5 金芪降糖片对肥胖小鼠体内脂肪形态的影响
与正常组比较,模型组小鼠白色脂肪细胞体积变大;与模型组比较,金芪降糖片组小鼠的白色脂肪细胞体积变小。结果显示,金芪降糖片可改善肥胖小鼠白色脂肪组织形态异常。详见图8。
2.1.6 金芪降糖片对肥胖小鼠肝脏组织形态的影响 正常组小鼠肝脏组织结构完整,肝细胞形态大小正常,无变性坏死,肝细胞内未出现脂滴。与正常组相比,模型组小鼠肝细胞内出现了大小、数量不等的脂滴空泡。与模型组相比,金芪降糖片组小鼠肝细胞内脂滴小空泡体积及数量均明显减少,详见图9。
2.2 金芪降糖片-肥胖的网络药理学预测及实验验证
2.2.1 金芪降糖片活性成分、靶点及药物靶点分析
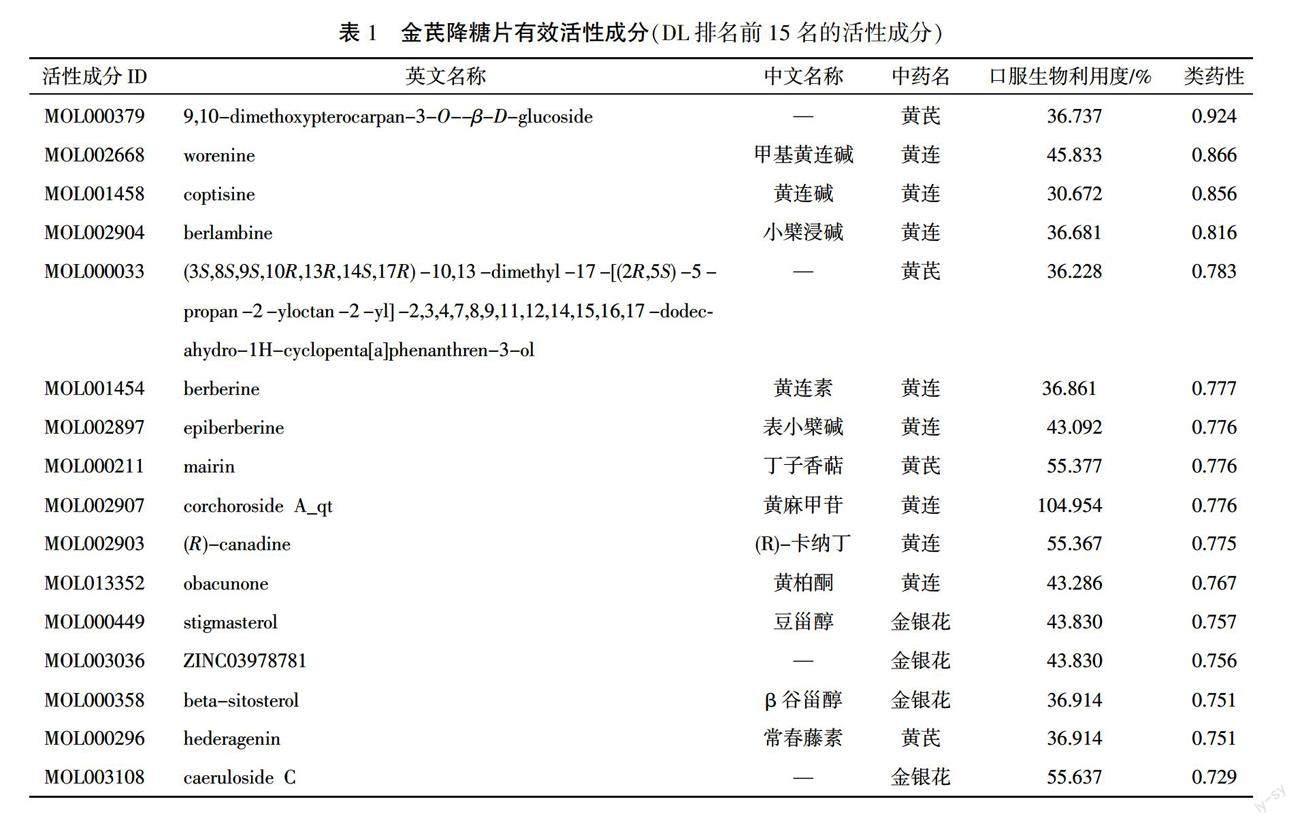
通过TCMSP共收集到金芪降糖片中黄芪、黄连、金银花3味药物的58个有效活性成分。通过GeneCards数据库(https://www.genecards.org/)检索关键词“Obesity”,得到肥胖相关靶点1228个。详见表1。
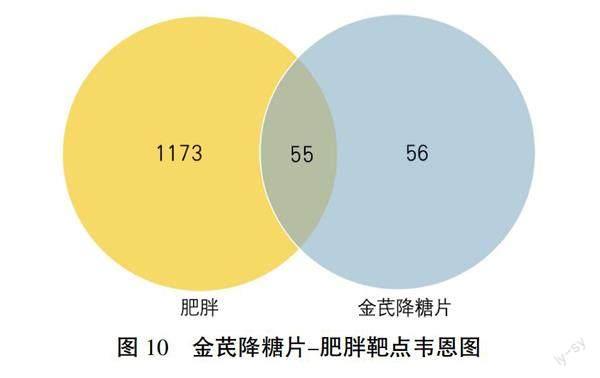
2.2.2 金芪降糖片治疗肥胖的靶点 利用PERL脚本将TCMSP数据库检索得到的121个靶基因,与GeneCards 数据库挖掘到的1228个肥胖的靶基因进行筛选去重,获得55个交集靶点,使用R 3.6.3软件绘制韦恩图(见图10)。将交集靶点导入Cytoscape
3.7.1软件中,获得中药-成分-靶点-疾病网络图(见图11)。
2.2.3 金芪降糖片和肥胖的共同靶点PPI网络构建及关键靶点筛选 对金芪降糖片和肥胖的共同靶点进行PPI网络分析,该网络由55个节点和392条边组成。详见图12。
2.2.4 GO富集分析与KEGG信号通路富集分析 GO富集分析包括生物过程(biological process, BP)、分子功能(molecular, MF)及细胞组件(cellular component, CC),设定阈值为P<0.05。潜在靶点显著富集在膜筏、细胞膜微结构、细胞膜区、突触下膜、转录复合体等位置;交集靶点与类固醇激素调节、DNA结合转录因子活性的调控、氧水平的调节等生物过程相关。BP 880个,CC 52个,MF 62个,将其每个结果前10的条目可视化为条形图。详见图13。
依据P值统计核心条目,预测分析金芪降糖片对肥胖可能产生作用的相关通路为79条,将其中富集相关性位列前20的通路可视化为条形图,KEGG富集分析预测到金芪降糖片治疗肥胖与流体剪切应力和动脉硬化、糖尿病并发症中的AGE-RAGE信号通路、TNF信号通路、PPARγ信号通路等密切相关。详见图14。
2.2.5 金芪降糖片对PPARγ信号通路中关键蛋白的影响 与正常组比较,模型组小鼠附睾白色脂肪中PPARγ表达显著上调(P<0.01),C/EBPα明显上调(P<0.05);与模型组比较,金芪降糖片组小鼠的附睾白色脂肪中PPARγ、C/EBPα表达显著下调(P<0.01)。详见图15。
3 讨论
中医文献对肥胖的记载始于《黄帝内经》。《黄帝内经》将肥胖人群分为“脂人”“膏人”“肉人”3类。李东垣的《脾胃论》中载“脾胃俱旺,能食而肥”[9],指出了患者最初常常由于食欲旺盛、饮食摄入过多而引起肥胖[10]。清代《石室秘录》中载“肥人多痰,乃气虚也,虚则气不运行,故痰生之”[11],提出“气虚、水湿、痰浊”是肥胖的重要病机。中医学理论认为肥胖的发生多与饮食不节、情志失调、劳逸失度有关,而肥胖易产生水湿、痰浊、食积、气滞等病理因素,进而导致体内膏脂聚集,郁久则可化热[12]。因而,中医根据肥胖的不同证型进行辨证论治,多采用清热益气健脾、祛痰化浊、利水渗湿法予以治疗[13]。
中药复方金芪降糖片组成为黄芪、黄连和金银花。金银花,性寒,味甘、苦,能清热解毒;黄芪有补气健脾、恢复脾运的功效,脾主运化,脾气健运才能升清降浊,黄芪性温,温能散郁,郁消则气机条达,则气血精液及水谷精微才能正常代谢;黄连,性寒,味苦,有燥湿泻热之功效,现代药理学研究认为,黄连有调节肥胖引起的全身慢性炎症反应的作用,有防治肥胖和延缓糖尿病并发症的积极疗效[14];《药性赋》中记载黄芪“味甘,气温,无毒。升也,阳也”,三药合用具有清热益气健脾、燥湿化浊之功效。有研究证明,金芪降糖片对2型糖尿病脂代谢紊乱大鼠体内的差异代谢物有一定的回调作用[15]。但是,目前关于该方的临床应用多集中在治疗轻、中度2型糖尿病及改善胰岛素抵抗等方面[16],缺少对于肥胖治疗的相关实验或者临床研究证据。
本研究动物实验结果显示,金芪降糖片能显著降低肥胖小鼠的体质量及TG、TC、LDL-C水平,提高小鼠HDL-C水平,显著减少肥胖小鼠体内白色脂肪及棕色脂肪率,且能显著减少肥胖小鼠肝脏组织中脂滴蓄积、脂肪细胞的数量及大小。综合以上结果,说明金芪降糖片有治疗肥胖的作用。
本研究进一步通过网络药理学预测了金芪降糖片治疗肥胖的潜在机制,共获得了金芪降糖片和肥胖的55个共同靶点及其79条富集通路。本研究中预测的途径大致可分为3种:(1)调节脂质代谢;(2)参与脂质转运;(3)减轻脂肪组织炎症。脂质代谢是指体内脂质在相关酶的帮助下,进行消化吸收、合成与分解的过程,加工成为机体所需要的物质,对于生命活动具有重要意义[17]。
金芪降糖片中直接参与调节脂质代谢的靶点蛋白有CAV-1、PPARγ等。研究表明,CAV-1是一种脂滴蛋白,参与脂质代谢过程,协助细胞吸收和聚集游离脂肪酸,调控TG的合成,对于维持细胞的脂质稳态起着重要调节作用[18]。PPARγ在脂肪组织中高表达,是脂肪生成必不可少的关键调节因子。在PPARγ信号通路中,PPARγ与PPAR反应元件(PPAR responsive element)结合后可增强脂肪酸转运蛋白、脂肪酸结合蛋白、脂蛋白脂肪酶等脂肪酸合成基因的表达,并能抑制过氧化物酶体脂肪酸氧化酶系,脂酰CoA去饱和酶,肾上腺素能受体、瘦素等促脂解基因表达,分别调控脂肪的合成和分解。PPARγ通过调节影响脂质累积的众多基因的表达,影响脂肪生成[19]。PPARγ的缺失或突变,可引起肥胖、胰岛素抵抗、血脂异常、代谢综合征等疾病的发生[20-21]。在脂肪生成过程中,PPARγ除了在维持脂肪细胞分化中发挥至关重要的作用外,还与C/EBPα发挥协同促进作用。研究表明,在成纤维细胞中,PPARγ对C/EBPα诱导的脂肪生成是不可或缺的;而当C/EBPα基因敲除后,PPARγ诱导的脂肪生成严重缺失。PPARγ能直接激活内源性C/EBPα基因转录;而C/EBPα激活后又可与PPARγ结合,诱导并维持PPARγ在成熟脂肪细胞中的表達[22]。此外,金芪降糖片靶点中的细胞色素P450氧化还原酶(CYP3A4亚型),主要分布在细胞内质网和线粒体内膜上,作为一种末端加氧酶,参与了生物体内的胆固醇合成等过程,并可将胆固醇代谢转化为胆汁酸和类固醇激素等[23-24]。
本研究通过体内实验研究了金芪降糖片治疗肥胖的药效学作用,并通过网络药理学预测了金芪降糖片治疗肥胖的作用机制,分析出PPARγ信号通路可能是金芪降糖片治疗肥胖的潜在靶点通路,并对于小鼠附睾白色脂肪组织中PPARγ信号通路中关键蛋白表达进行了验证。后续实验中,本研究团队将提取小鼠体内附睾白色脂肪组织对肥胖相关的脂肪酸合成相关蛋白进行进一步实验验证,为金芪降糖片的临床应用提供更好的理论支撑。
参考文献
[1] 中国营养学会肥胖防控分会,中国营养学会临床营养分会,中华预防医学会行为健康分会,等.中国居民肥胖防治专家共识[J].西安交通大学学报(医学版),2022,43(4):619-631.
[2] 陈 贵,郭桂平,肖水源,等.超重/肥胖青少年的负性情绪与进食障碍倾向[J].中国心理卫生杂志,2015,29(1):16-21.
[3] 王 琦,朱燕波,吴玉娥,等.肥胖、超重与正常体质量高血压患者的中医体质类型分布特点比较研究[J].中华中医药杂志,2011,26(8):676-679.
[4] 刘 俊,郭 毅,刘 晴,等.超重、肥胖与2型糖尿病相关性的Meta分析[J].中国循证医学杂志,2013,13(2):190-195.
[5] 孙铭遥,陈 伟.《中国超重/肥胖医学营养治疗指南(2021)》解读[J].协和医学杂志,2022,13(2):255-262.
[6] 袁雪海,吕 楠,靳学海,等.新工艺金芪降糖片降糖和调脂作用研究[J].中草药,2015,46(21):3219-3222.
[7] KLEINERT M, CLEMMENSEN C, HOFMANN S M, et al. Animal models of obesity and diabetes mellitus[J]. Nature Reviews Endocrinology, 2018, 14(3): 140-162.
[8] 陈春林.基于Micro-CT的脂肪测量软件设计开发[D].西安:西安电子科技大学,2014.
[9] 李东垣.脾胃论[M].北京:中国医药科技出版社,2018.
[10] 李超德,唐红珍.从痰湿论治肥胖[J].广西医学,2018,40(23):2829-2831.
[11] 陈士铎.石室秘录[M].北京:人民军医出版社,2009.
[12] 宋昌梅,杲春阳,付燕来,等.肥胖中医研究进展[J].现代中医药,2021,41(3):6-9.
[13] 钟淑贞,李惠林,熊 倪,等.李惠林从痰瘀论治肥胖症经验[J].中医药导报,2022,28(9):154-157,160.
[14] 程浩洋,李长辉.黄连-黄芩药对治疗肥胖的作用机制探究[J].中医药临床杂志,2022,34(1):82-87.
[15] 朱 磊.金芪降糖片在2型糖尿病患者临床治疗中的意义[J].中国处方药,2016,14(11):87-88.
[16] 姚定国,魏佳平,倪海祥,等.金芪降糖片改善2型糖尿病胰岛素抵抗的研究[J].天津医药,2005,33(5):296-298.
[17] 朱 祥,徐小洁.极端环境下糖、脂肪、氨基酸代谢的研究进展[J].军事医学,2019,43(4):309-313.
[18] FERN?魣NDEZ M A, ALBOR C, INGELMO-TORRES M, et al. Caveolin-1 is essential for liver regeneration[J]. Science, 2006, 313(5793): 1628-1632.
[19] TRIANA R, DEWI N M, DARMAYANTI S, et al. PPAR-gamma signaling in metabolic homeostasis[J]. The Indonesian Biomedical Journal, 2016, 8(3): 147.
[20] APRILE M, AMBROSIO M R, D'ESPOSITO V, et al. PPARG in human adipogenesis: Differential contribution of canonical transcripts and dominant negative isoforms[J]. PPAR Research, 2014, 2014: 537865.
[21] MULLER Y L, BOGARDUS C, BEAMER B A, et al. A functional variant in the peroxisome proliferator-activated receptor γ2 promoter is associated with predictors of obesity and type 2 diabetes in Pima indians[J]. Diabetes, 2003, 52(7): 1864-1871.
[22] WU Z, BUCHER N L, FARMER S R. Induction of peroxisome proliferator-activated receptor gamma during the conversion of 3T3 fibroblasts into adipocytes is mediated by C/EBPbeta, C/EBPdelta, and glucocorticoids[J]. Molecular and Cellular Biology, 1996, 16(8): 4128-4136.
[23] PANDEY A V, FL?譈CK C E. NADPH P450 oxidoreductase: Structure, function, and pathology of diseases[J]. Pharmacology & Therapeutics, 2013, 138(2): 229-254.
[24] 戴永國,赵艳娟,汪 晖,等.细胞色素P450氧化还原酶在发育中的作用[J].武汉大学学报(医学版),2019,40(3):506-511.
〔收稿日期〕2022-11-02
〔基金项目〕天津市教委科研计划项目(2021ZD010);天津中医药大学中西医结学院研究生创新基金(ZXYCXLX202019)。
〔第一作者〕王瑾源,女,硕士研究生,研究方向:中医药防治骨、脂代谢疾病的研究。
〔通信作者〕*郑 纺,女,博士,教授,E-mail:zhengfang_1979@163.com。

