百合主要有效成分对小鼠B-16细胞黑色素含量、酪氨酸酶活性的影响
彭丽丽 刘朝圣 成雪 陈燕 杨娇娇 李翊澜

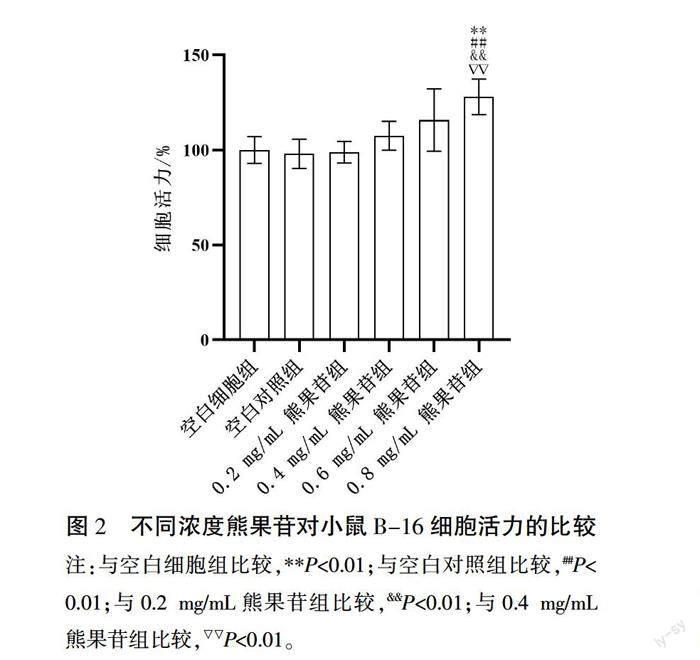
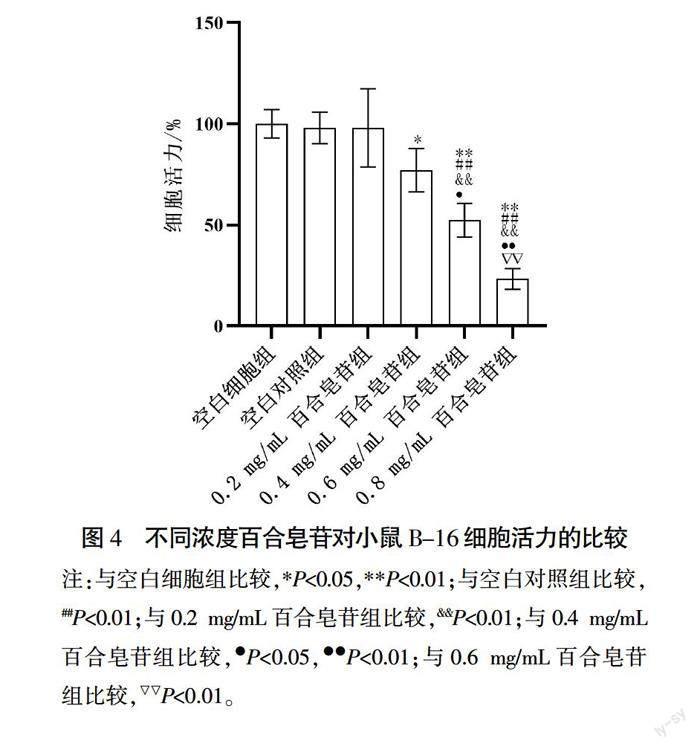
〔摘要〕 目的 觀察百合多糖与百合皂苷对小鼠B-16细胞中细胞活力、酪氨酸酶活性及黑色素含量的影响。方法 选用同一传代小鼠B-16细胞并随机分为空白细胞组、空白对照组、熊果苷组、百合多糖组、百合皂苷组,共5组。空白细胞组加入180 μL RPMI1640培养液;空白对照组加入180 μL RPMI1640培养液和20 μL高密度聚乙烯;熊果苷组、百合多糖组、百合皂苷组分别加入不同浓度(0.2、0.4、0.6、0.8 mg/mL)的熊果苷、百合多糖、百合皂苷,作用3 d后,用CCK-8法检测B-16细胞活力,用酪氨酸酶-多巴速率氧化法检测B-16细胞中酪氨酸酶的活性,以MTT法检测小鼠B-16细胞的黑色素含量。结果 与空白细胞组比较,0.8 mg/mL熊果苷组细胞活力明显升高(P<0.01),0.4、0.6、0.8 mg/mL百合皂苷组细胞活力均明显降低(P<0.05,P<0.01);各浓度熊果苷、百合多糖组和0.6、0.8 mg/mL百合皂苷组酪氨酸酶活性均明显降低(P<0.01),0.2 mg/mL百合皂苷组酪氨酸酶活性明显升高(P<0.01)。与空白对照组比较,0.8 mg/mL熊果苷组细胞活力明显升高(P<0.01),0.6、0.8 mg/mL百合皂苷组细胞活力均明显降低(P<0.01);各浓度熊果苷、百合多糖组和0.6、0.8 mg/mL百合皂苷组酪氨酸酶活性均明显降低(P<0.01),0.2、0.4 mg/mL百合皂苷组酪氨酸酶活性均明显升高(P<0.01)。与0.2 mg/mL熊果苷组比较,0.8 mg/mL熊果苷组细胞活力、0.2 mg/mL百合皂苷组酪氨酸酶活性均明显升高(P<0.01)。与0.4 mg/mL熊果苷组比较,0.8 mg/mL熊果苷组细胞活力、0.4 mg/mL百合皂苷组酪氨酸酶活性均明显升高(P<0.01)。与0.6 mg/mL熊果苷组比较,0.6 mg/mL百合皂苷组酪氨酸酶活性均明显升高(P<0.01)。与0.4 mg/mL百合皂苷组比较,0.6、0.8 mg/mL百合皂苷组细胞活力均明显降低(P<0.05,P<0.01)。与0.6 mg/mL百合皂苷组比较,0.8 mg/mL百合皂苷组细胞活力明显降低(P<0.01)。在0.2、0.4 mg/mL浓度下,百合皂苷组酪氨酸酶活性均明显高于百合多糖组(P<0.01)。结论 相较于百合皂苷、熊果苷,百合多糖能够在不影响小鼠B-16细胞活性的情况下,对B-16细胞内酪氨酸酶活性和黑色素含量起到抑制作用,推测百合多糖可能通过抑制细胞内酪氨酸酶的活性,进一步抑制黑色素的合成,达到美白的效果。
〔关键词〕 百合多糖;百合皂苷;熊果苷;B-16细胞;酪氨酸酶;黑色素
〔中图分类号〕R275.9 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.005
Effects of the main active ingredients from Baihe (Bulbus Lilii) on melanin content and
tyrosinase activity in mice B-16 cells
PENG Lili1, LIU Chaosheng2, CHENG Xue1, CHEN Yan1*, YANG Jiaojiao1, LI Yulan1
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Hospital of Hunan
University of Chinese Medicine, Changsha, Hunan 410007, China
〔Abstract〕 Objective To investigate the effects of Baihe (Bulbus Lilii) polysaccharides and Baihe (Bulbus Lilii) saponins on cell viability, tyrosinase activity, and melanin content in mice B-16 cells. Methods Mice B-16 cells from the same passage were randomly allocated into 5 groups: blank cell group, blank control group, arbutin group, Baihe(Bulbus Lilii) polysaccharide group, and Baihe(Bulbus Lilii) saponin group. The blank cell group was supplemented with 180 μL RPMI1640 culture medium, while the blank control group received 180 μL RPMI1640 culture medium and 20 μL HDPE. The arbutin, Baihe (Bulbus Lilii) polysaccharide, and Baihe (Bulbus Lilii) saponin groups were treated with varying concentrations (0.2, 0.4, 0.6 and 0.8 mg/mL) of arbutin, Baihe (Bulbus Lilii) polysaccharide, and Baihe (Bulbus Lilii) saponin, respectively. After 3 d, B-16 cell viability was assessed by CCK-8, tyrosinase activity within B-16 cells was determined via the tyrosinase-dopa oxidation method. Meanwhile, the melanin content in murine B-16 cells was quantified by MTT. Results The cell viability demonstrated a significant increase in the 0.8 mg/mL (P<0.01) and a decrease in the 0.4, 0.6 and 0.8 mg/mL Baihe (Bulbus Lilii) saponin groups (P<0.05, P<0.01) compared with the blank cell group. Tyrosinase activity declined obviously in arbutin groups, Baihe (Bulbus Lilii) polysaccharide groups, and Baihe (Bulbus Lilii) saponin group (P<0.01). Tyrosinase activity was notably elevated in the 0.2 mg/mL Baihe (Bulbus Lilii) saponin group (P<0.01). Compared with the blank control group, cell viability was significantly enhanced in the 0.8 mg/mL arbutin group (P<0.01) and markedly reduced in the 0.6 and 0.8 mg/mL Baihe (Bulbus Lilii) saponin groups (P<0.01). Tyrosinase activity displayed a significant decrease in the arbutin and Baihe(Bulbus Lilii) polysaccharide groups and the 0.6 and 0.8 mg/mL Baihe (Bulbus Lilii) saponin groups across all concentrations (P<0.01), while a substantial increase was observed in the 0.2 and 0.4 mg/mL Baihe (Bulbus Lilii) saponin groups (P<0.01). The cell viability in the 0.8 mg/mL arbutin group and the tyrosinase activity in the 0.2 mg/mL Baihe (Bulbus Lilii) saponin group were significantly elevated compared with the 0.2 mg/mL arbutin group (P<0.01). In comparison with the 0.4 mg/mL arbutin group, the cell viability in the 0.8 mg/mL arbutin group and the tyrosinase activity in the 0.4 mg/mL Baihe (Bulbus Lilii) saponin group exhibited a significant increase (P<0.01). The tyrosinase activity in the 0.6 mg/mL Baihe (Bulbus Lilii) saponin group was notably elevated compared to the 0.6 mg/mL arbutin group (P<0.01). The cell viability was significantly reduced in the 0.6 and 0.8 mg/mL Baihe(Bulbus Lilii) saponin groups compared to the 0.4 mg/mL Baihe(Bulbus Lilii) saponin group (P<0.05, P<0.01). The cell viability in the 0.8 mg/mL Baihe (Bulbus Lilii) saponin group was markedly lower compared to the 0.6 mg/mL Baihe (Bulbus Lilii) saponin group (P<0.01). At the concentration of 0.2 and 0.4 mg/mL, the tyrosinase activity in Baihe (Bulbus Lilii) saponin group was significantly higher than that in the Baihe (Bulbus Lilii) polysaccharide group (P<0.01). Conclusion In comparison to Baihe (Bulbus Lilii) saponins and arbutin, Baihe (Bulbus Lilii) polysaccharides were capable of inhibiting tyrosinase activity and melanin content in mice B-16 cells without affecting cell viability. It is speculated that Baihe (Bulbus Lilii) polysaccharides may further suppress melanin synthesis and achieve the whitening effect by inhibiting intracellular tyrosinase activity.
〔Keywords〕 Baihe (Bulbus Lilii) polysaccharides; Baihe (Bulbus Lilii) saponins; arbutin; B-16 cells; tyrosinase; melanin
百合主要生长在北温带及亚热带地区,全世界约有115种,我国产39种及26变种[1-2]。现代药理学研究发现,百合富含多种有效化学成分,如多糖类、甾体皂苷类、生物碱类、黄酮类以及酚类化合物等,有抗氧化、抗炎等药理作用。其中,百合多糖含量最高可达19.42%,具有明显的清除氧自由基、提高超氧化物歧化酶和过氧化氢酶活性、降低丙二醛水平的作用[3-6];百合皂苷含量约为10.45%,有清除羟自由基的强大作用,与剂量成正相关,体外抗氧化能力优于人参皂苷[7]。因此,百合具有较好的抗衰、养颜功效,而且本身色白晶莹,近年来,其在皮肤美白领域的作用被逐渐重视。本团队前期研究证实,道地药材湘西龙山百合提取液对小鼠B-16黑色素瘤细胞酪氨酸酶活性有较强的抑制作用,同时也有一定的细胞毒性作用,但未明确其中起作用的主要成分[8]。本研究选择百合多糖、百合皂苷这两种百合主要药效成分,探析其对小鼠B-16细胞的细胞活力、酪氨酸酶活性和黑色素活性的影响,进而发掘百合发挥美白作用的成分及机制,为百合在美白领域的临床应用提供理论依据和研究基础。
1 材料
1.1 细胞
小鼠B-16黑色素瘤细胞购自百纳生物细胞库。
1.2 主要药物和试剂
龙山百合(湖南龙山新世纪实业有限责任公司,货号:AH2ke8Ky)。
二甲基亚砜(货号:S24295)、熊果苷(货号:B21402)、MTT试剂盒(货号:S19063)、胰酶(2.5 g/L,货号:S10031)、Triton X-100溶液(货号:R21239)均购自上海源叶生物科技有限公司;小牛血清(上海锐聪科技有限公司,批号:RC03046A);RPMI1640培养基(北京诺为生物技术有限公司,货号:11875093);L-多巴(货号:SL8050)、AB-8大孔吸附树脂(货号:M0042)均购自北京索莱宝科技有限公司;PBS(青岛海博生物技术有限公司,货号:02-24-1ACS);1,2-丙二醇(中海壳牌石油化工有限公司,批号:MPGTF3T12);丙酮(北京万佳首化生物科技有限公司,批号:SH-CA1001900);D-100大孔吸附树脂(廊坊淼阳化工有限公司,货号:DA201);氯仿(货号:B01037501)、正丁醇(货号:B00001801)均购自成都贝斯特试剂有限公司;CCK-8法细胞增殖检测试剂盒(江苏凯基生物技术股份有限公司,货号:KGA317);无水乙醇(上海麦克林生化科技股份有限公司,货号:E809056)。
1.3 主要仪器
CO2培养箱(上海一恒科学仪器有限公司,型号:BPN-80CW);倒置荧光显微镜(广州市明美光电有限公司,型号:MF53);洁净工作台(BIOBASE山东博科,型号:BBS-SDC);离心机(长沙英泰仪器有限公司,型号:TD4A);多功能酶标仪(Rayto,型号:RT-6100);全自动高速冷冻离心机(湘仪离心机仪器有限公司,型号:HT165R);恒温干燥机(嘉兴市中新医疗仪器有限公司,型号:DHG-9140AS);微波超声波组合催化萃取仪(上海新诺仪器集团有限公司,型号:BILON-CW-1000)。
2 方法
2.1 百合多糖提取
采用微波萃取法[9]。方法如下:鲜百合→干燥(恒温干燥箱,50 ℃,3 h)→粉碎→过筛(100目)→水浸泡(75 ℃,10 h)→微波萃取(功率700 W,25 min)→4000 r/min半径12 cm离心15 min,3次→浓缩(原体积的1/5)→醇沉(4倍量无水乙醇)→4000 r/min半径12 cm离心15 min,1次→复溶(45 ℃水)→去蛋白(Sevag法,氯仿∶正丁醇=5∶1)→醇沉(无水乙醇)→4000 r/min半径12 cm离心15 min,1次→洗涤(无水乙醇、丙酮、无水乙醇各洗涤3次)→真空干燥→百合多糖。
2.2 百合皂苷提取
采用醇提-大孔树脂吸附法[10]。方法如下:百合烘干(含水量6%左右)→粉碎(过80目筛)→醇提(70%无水乙醇,固液比1∶8,60 ℃水浴回流提取3 h,提取3次,和/或超声波30 min)→再用AB-8大孔吸附树脂分离→无水乙醇→收集脱洗液,并浓缩→百合浸膏→加无水乙醇溶解→丙酮-乙醚混合液分布沉淀→干燥→纯百合皂苷。
2.3 主要试剂配制
高密度聚乙烯(high density polyethylene, HDPE):将无水乙醇、1,2-丙二醇、双蒸水按照体积比3∶5∶2的比例超声混合均匀,使用0.01 mol/L的PBS稀释10倍得到100 mL/L的HDPE,作为溶媒。
熊果苷:向20 mg熊果苷粉末中加入400 μL HDPE,得到50 mg/mL的母液,根据实验浓度进行对应倍数稀释。
百合多糖:称取百合多糖粉末136 mg,加入2.72 mL HDPE,过滤除菌,得到50 mg/mL的母液,根据实验浓度进行对应倍数稀释。
百合皂苷:称取百合多糖粉末152 mg,加入3.04 mL HDPE,过滤除菌,得到50 mg/mL的母液,根据实验浓度进行对应倍数稀释。
L-多巴:向20 mg L-多巴粉末中加入2 mL二甲基亞砜溶解,混合均匀,得到10 mg/L的L-多巴溶液。
2.4 B-16细胞培养及传代
待B-16黑色素瘤细胞生长至融合状态,弃上清液,用PBS洗两遍,加入0.25%胰酶(含0.02% EDTA)消化,待细胞变圆后,加入含有10%小牛血清的RPMI1640培养液终止消化并收集细胞悬液至10 mL离心管中,1000 r/min半径12 cm离心3 min,弃上清液,加入培养基重悬细胞;将细胞悬液按照1∶3的比例分配至准备好的培养皿中,做好标记,将细胞置于CO2培养箱37 ℃、5% CO2饱和湿度环境中进行培养[11]。每一次实验取自同一传代细胞,初始接种细胞浓度为5000个/cm2左右。详见图1。
2.5 实验分组及细胞培养
将同一传代小鼠B-16细胞随机分为空白细胞组、空白对照组、熊果苷组、百合多糖组、百合皂苷组,共5組。取第3~4代的B-16细胞,以6×104个/cm2的密度分别接种于2个96孔板中,分别用于测定黑素细胞活力和酪氨酸酶活性。37 ℃、5%CO2孵箱中培养1 d后,弃上清液,空白细胞组加入180 μL RPMI1640培养液;空白对照组加入180 μL RPMI1640培养液和20 μL HDPE;百合多糖组每孔加入180 μL RPMI1640培养液及20 μL不同浓度(0.2、0.4、0.6、0.8 mg/mL)的百合多糖,百合皂苷组中每孔加入180 μL RPMI1640培养液及20 μL不同浓度(0.2、0.4、0.6、0.8 mg/mL)的百合皂苷;熊果苷组每孔加入180 μL RPMI1640培养液和不同浓度(0.2、0.4、0.6、0.8 mg/mL)的熊果苷。37 ℃、5% CO2孵箱中孵育3 d。每一浓度4个孔,实验重复3次。
2.6 指标检测
2.6.1 CCK-8法检测B-16细活力 药物作用3 d后,将96孔板中的溶液吸出,每孔加入100 μL 细胞培养液和10 μL CCK-8法细胞增殖检测试剂,置于培养箱中37 ℃孵育2 h,酶标仪在450 nm波长处检测每孔的吸光值。
细胞活力[12]=实验组吸光值/对照组吸光值×100%。
2.6.2 酪氨酸酶活性检测 以L-多巴为底物,采用酪氨酸酶-多巴速率氧化法[13]检测细胞酪氨酸酶活性。药物作用3 d后,将待测96孔板中的细胞弃上清液,用0.01 mol/L PBS洗涤两次,每孔加入90 μL 10 mL/L的TritonX-100,震荡5 min溶解细胞后,每孔加入10 μL 10 mg/mL的L-多巴,于37 ℃孵育30 min,酶标仪在490 nm波长处检测每孔的吸光值。 酪氨酸酶活性[14]=(1-实验组吸光值/对照组吸光值)×100%。
2.6.3 黑色素含量检测 黑色素含量的测定采用MTT法[15]。将培养的第3~4代黑素细胞以6×104个/cm2的密度接种于6孔板,24 h后换液,实验组1、实验组2每孔加入4.5 mL RPMI1640培养液及0.5 mL不同浓度的百合多糖或百合皂苷,对照组以熊果苷溶液代替,空白对照组孔加入4.5 mL RPMI1640培养液和0.5 mL HDPE。每种浓度3个孔,实验重复3次。3 d后将6孔板中的细胞消化,离心,弃上清液,重悬成单个细胞并计数,再次离心弃上清液,每组加入1 mL 1 mol/L的NaOH溶液,震荡5 min,吸取每组液体加入96孔板中,每组设置4个复孔,酶标仪在490 nm波长处检测每孔的吸光值。
黑色素合成率[16]=[1-(实验组吸光值/实验组细胞密度)/(对照组吸光值/对照组细胞密度)]×100%。
2.7 统计学方法
数据采用SPSS 18.0统计软件进行统计分析。计量资料若符合正态分布,用“x±s”形式表示,否则用中位数表示。计量资料服从正态分布及方差齐性时,采用参数检验,组内比较采用单因素方差分析,组间比较采用t检验,方差不齐者用Tambane's T2检验;不符合正态分布时,采用非参数检验。等级资料多样本比较采用Kruskal-wallis H秩和检验。对于多次重复测量数据,采用重复测量方差分析。取P<0.05为差异有统计学意义。
3 结果
3.1 不同百合有效成分与熊果苷对小鼠B-16细胞活力的影响
与空白细胞组比较,0.8 mg/mL熊果苷组小鼠B-16细胞活力明显升高(P<0.01)。与空白对照组比较,0.8 mg/mL熊果苷组细胞活力明显升高(P<0.01)。与0.2 mg/mL熊果苷组比较,0.8 mg/mL熊果苷组细胞活力明显升高(P<0.01)。与0.4 mg/mL熊果苷组比较,0.8 mg/mL熊果苷组细胞活力明显升高(P<0.01)。详见图2。
各浓度百合多糖与空白细胞组或空白对照组间细胞活力比较,差异均无统计学意义(P>0.05)。详见图3。
与空白细胞组比较,0.4、0.6、0.8 mg/mL百合皂苷组细胞活力均明显降低(P<0.05,P<0.01)。0.2 mg/mL百合皂苷组细胞与空白细胞组间细胞活力比较,差异无统计学意义(P>0.05)。与空白对照组比较,0.6、0.8 mg/mL百合皂苷组细胞活力均明显降低(P<0.01)。0.2、0.4 mg/mL百合皂苷组与空白对照组间细胞活力比较,差异均无统计学意义(P>0.05)。与0.4 mg/mL百合皂苷组比较,0.6、0.8 mg/mL百合皂苷组细胞活力均明显降低(P<0.05,P<0.01)。与0.6 mg/mL百合皂苷组比较,0.8 mg/mL百合皂苷组细胞活力明显降低(P<0.01)。详见图4。
3.2 不同百合有效成分与熊果苷对小鼠B-16细胞酪氨酸酶的影响
与空白细胞组比较,各浓度熊果苷、百合多糖组和0.6、0.8 mg/mL百合皂苷组酪氨酸酶活性均明显降低(P<0.01),0.2 mg/mL百合皂苷组酪氨酸酶活性明显升高(P<0.01)。0.4 mg/mL百合皂苷组与空白细胞组间酪氨酸酶活性比较,差异无统计学意义(P>0.05)。与空白对照组比较,各浓度熊果苷、百合多糖组和0.6、0.8 mg/mL百合皂苷组酪氨酸酶活性均明显降低(P<0.01),0.2、0.4 mg/mL百合皂苷组酪氨酸酶活性均明显升高(P<0.01)。在0.2、0.4、0.6 mg/mL浓度下,百合皂苷组酪氨酸酶活性均明显高于熊果苷组(P<0.01)。在0.2、0.4 mg/mL濃度下,百合皂苷组酪氨酸酶活性均明显高于百合多糖组(P<0.01)。详见图5。
3.3 不同百合有效成分和熊果苷对小鼠B-16细胞黑色素合成的影响
与空白细胞组比较,各浓度熊果苷组、百合多糖组和0.2、0.4 mg/mL百合皂苷组黑色素合成率均明显降低(P<0.01),0.6、0.8 mg/mL百合皂苷组黑色素合成率均明显升高(P<0.01)。详见图6。
4 讨论
随着经济发展和人们生活水平的提高,越来越多的现代女性推崇以白皙肌肤为美的观念,各种美白护肤产品层出不穷,使近年来美白类护肤产品在我国美容护肤品消费市场的份额占比升至30%左右[17]。由此可见,美白类护肤品的开发具有广阔的发展前景和市场价值。
导致黑色素在皮肤表面生成的原因复杂多样,主要包括遗传因素和环境因素。目前研究结果表明,黑色素的主要成因为:在酪氨酸酶的作用下,皮肤细胞中的酪氨酸受各种因素的影响,渐渐被氧化为多巴和多巴醌,经过一系列的代谢反应,最终转化为皮肤黑色素,导致皮肤暗沉或者在皮肤表面形成各种斑点[18]。因此,在美白护肤品的开发过程中,要解决的主要问题就是抑制细胞中酪氨酸酶的活性,减少黑色素的形成和积累。植物类美白剂来自天然,安全性好,同时资源丰富易获得。中草药作为在我国有悠久使用历史的植物,具有较好安全性的同时,还有多种药理价值,在美白护肤品市场中有巨大的开发和应用价值[19]。大量研究表明,我国许多传统中草药具有美白功效。王佳其[20]研究表明,丹参挥发油对酪氨酸酶有较好的抑制作用,可作为一种抗氧化、美白功效物质应用于膏霜等日化产品中;叶峻宏等[21]研究结果表明,川芎中含有的川芎嗪能够有效抑制酪氨酸酶的活性和活性氧基的作用,从而抑制黑色素细胞生长增殖和减少黑色素生成;SONG等[22]研究发现,玫瑰花瓣提取物RPE通过激活MAPKK-MAPK信号通路,抑制酪氨酸酶活性和减少黑色素积累;任煜等[23]研究发现,绿茶提取物中的没食子酸和没食子儿茶素有利于其发挥美白功效,可作为添加剂应用于美白护肤品中。
基于前期的研究基础[8],本研究旨在明确两种百合有效成分对小鼠B-16细胞活力、细胞内酪氨酸酶活性和黑色素含量的影响,初步探讨百合有效成分的美白机制。熊果苷因其美白效果好且不良反应很少,被广泛地添加于美白类化妆品中[24-25]。因此,本实验选用熊果苷作为实验阳性对照药物,评价百合多糖和百合皂苷的活性。研究结果显示:(1)百合多糖与熊果苷在实验浓度范围内均未表现出对小鼠B-16细胞活力的抑制作用,相反,熊果苷在一定程度上能够促进B-16细胞的活性,其促进作用随浓度的增高而增强;百合皂苷则对小鼠B-16细胞活性表现出明显的抑制作用,且浓度越高,其对B-16细胞活性的毒性越强。(2)百合多糖与熊果苷对酪氨酸酶的抑制作用在浓度为0.4 mg/mL时最强,且百合多糖的抑制作用强于熊果苷;而百合皂苷则在作用浓度较高时对小鼠B-16细胞的酪氨酸酶有抑制作用,其最强作用浓度为0.6 mg/mL。(3)百合多糖和熊果苷对小鼠B-16细胞黑色素合成率的抑制作用随浓度的增加而变强,而百合皂苷组浓度为0.6、0.8 mg/mL时,对细胞黑色素合成有促进作用;百合皂组浓度为0.6、0.8 mg/mL时,对细胞黑色素抑制作用弱于相同浓度的熊果苷、百合多糖。
本研究初步阐明百合多糖的美白作用机制,为其在美白产品中的应用上提供了理论依据,有利于为百合开发更广阔的临床市场。
参考文献
[1] TANG Y C, LIU Y J, HE G R, et al. Comprehensive analysis of secondary metabolites in the extracts from different lily bulbs and their antioxidant ability[J]. Antioxidants, 2021, 10(10): 1634.
[2] 郎楷永.中国的百合[J].科技导报,2003,21(7):24-37,65.
[3] 粟 倩,吴 萍,夏伯候,等.百合化学成分及药理活性研究进展[J].中国药学杂志,2021,56(11):875-882.
[4] 孙佳宁,连希希,孙伶俐,等.百合主要成分及药理作用研究进展[J].中国野生植物资源,2022,41(7):45-50.
[5] 何 丹,张海潮,李世慧,等.百合化学成分、药理作用及质量标志物的预测分析[J].中华中医药学刊,2022,40(12):205-212,303.
[6] 白光剑,陈少丹,张普照,等.百合多糖的化学结构表征和生物活性研究进展[J].中草药,2022,53(20):6583-6592.
[7] 张永莉,陈清智,耿文慧,等.百合皂苷类化学成分提取及药理活性研究进展[J].亚热带植物科学,2022,51(3):233-240.
[8] 刘朝圣,龚 坚,申梦洁.湘西龙山百合对小鼠B-16黑色素瘤细胞黑色素含量、酪氨酸酶活性的影响[J].湖南中医药大学学报,2017,37(2):145-148.
[9] 黄群惠,黄志芸,田文静,等.微波提取对百合多糖流变性及生物活性的影响[J].食品与发酵工业,2021,47(15):171-177.
[10] 金伟文.论百合深加工的现状[J].甘肃科技纵横,2021,50(11):11-13.
[11] 穆 静,马惠昇,刘 镭,等.四种含药血清对小鼠B16黑素瘤细胞黑素合成的影响[J].宁夏医科大学学报,2020,42(2):194-197.
[12] 高章远致,李国浩,郭 凡,等.五倍子单宁酸体外诱导人膀胱癌EJ细胞凋亡及机制研究[J].湖北中医药大学学报,2021,23(5):5-8.
[13] MAEDA K, FUKUDA M. Arbutin: Mechanism of its depigmenting action in human melanocyte culture[J]. The Journal of Pharmacology and Experimental Therapeutics, 1996, 276(2): 765-769.
[14] 于丽娟,刘 悦,李智敏,等.清香木提取物抗氧化能力和酪氨酸酶活性抑制能力的研究[J].云南大学学报(自然科学版),2020,42(1):172-178.
[15] VIRADOR V M, KOBAYASHI N, MATSUNAGA J, et al. A standardized protocol for assessing regulators of pigmentation[J]. Analytical Biochemistry, 1999, 270(2): 207-219.
[16] 彭布成,聂兰兰,甘 露,等. LED单独光源及组合光源对B16细胞内黑色素合成的抑制作用[J].中国皮肤性病学杂志,2022,36(9):1021-1025,1038.
[17] 丰丕雪,易 弋,黄锦翔,等.半夏等15种常见中草药提取物的抗氧化能力比较研究[J].广西科技大学学报,2022,33(3):91-99.
[18] 黄惠珠,恽 昊,温博栋,等.白术、茯苓和珍珠不同配比的美白功能评价[J].广州化工,2022,50(17):46-48,62.
[19] 何毅帆,龙芸鸾,李 征,等.天然植物美白成分作用机理的研究进展[J].日用化学品科学,2022,45(10):37-43.
[20] 王佳其.丹参挥发油等天然产物美白与抗氧化活性研究及应用[D].上海:上海应用技术大学,2021.
[21] 叶峻宏,韩宪伟,吕 雯,等.五味子甲素通过MAPK/ERK途径拮抗黑素细胞中黑素生成的机制研究[J].中国医院用药评价与分析,2022,22(10):1184-1188.
[22] SONG Y R, LIM W C, HAN A, et al. Rose petal extract (Rosa gallica) exerts skin whitening and anti-skin wrinkle effects[J]. Journal of Medicinal Food, 2020, 23(8): 870-878.
[23] 任 煜,劉婷婷,祁冰洁.人参皂苷Rh2对黑色素瘤B16细胞作用及机制研究[J].牡丹江医学院学报,2021,42(6):1-5.
[24] 祝上宾,王英飒,敬凡尘,等.熊果苷磷脂复合物的制备、表征及理化性质研究[J].中草药,2020,51(22):5698-5704.
[25] 严 俊,王 容,李泽桦,等.祛斑美白类化妆品中6种功效成分的同时测定及使用情况分析[J].日用化学工业,2022,52(7):791-796.
〔收稿日期〕2022-10-24
〔基金项目〕湖南省教育厅科学研究项目(17C1231);湖南省中医药科研计划项目(201519);湖南省卫生健康委员会科学研究课题(20201181)。
〔第一作者〕彭丽丽,女,副教授,硕士研究生导师,研究方向:中医护理。
〔通信作者〕*陈 燕,女,博士,教授,E-mail:969639737@qq.com。

