白虎人参汤合枳实薤白桂枝汤对糖尿病心肌病MKR小鼠心肌细胞焦亡的影响
史留阳 谭丹妮 刘秀 向琴 谭艳 喻嵘
〔摘要〕 目的 探究白虎人参汤合枳实薤白桂枝汤对糖尿病心肌病模型MKR小鼠心肌细胞焦亡相关蛋白表达的影响。方法 造模成功后将MKR小鼠随机分成模型组,中药低、中、高剂量组,二甲双胍组,同时设FVB鼠为正常组。给药4周后观察小鼠糖脂代谢变化;超声成像平台检测小鼠心功能;HE染色及MASSON染色观察心肌组织形态;ELISA法测定血清中白细胞介素-18(interleukin-18, IL-18)、白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)水平;Western blot法检测小鼠心肌组织NOD样受体蛋白3(nucleotidebinding oligomerization domain-like receptors 3, NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein contain a CARD, ASC)、半胱氨酸的天冬氨酸蛋白水解酶-1(cysteinyl aspartate specific proteinase-1, Caspase-1)蛋白水平。结果 与正常组比较,模型组小鼠空腹血糖(fasting blood glucose, FBG)显著升高(P<0.01),血清总胆固醇(serum total cholesterol,TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白(low density lipoprotein, LDL)水平升高(P<0.05),高密度脂蛋白胆固醇(high density liptein cholesterol, HDL-C)水平降低(P<0.05),左室射血分数(rejection fraction, EF)、左室短轴缩短率(fractional shortening, FS)数值明显降低(P<0.01);细胞肥大变形,心肌纤维排列紊乱,纹理不齐,血清IL-1β、IL-18、TNF-α含量升高(P<0.01),心肌组织IL-1β、IL-18、TNF-α蛋白表达水平提升(P<0.01),心肌组织NLRP3、ASC、Caspase-1蛋白表达均显著增高(P<0.01)。与模型组比较,各用药组小鼠FBG、TC、TG、LDL水平降低(P<0.05),HDL-C水平升高(P<0.05), EF、FS值均有升高(P<0.05),小鼠心肌组织病理学损伤明显改善,血清IL-1β、IL-18、TNF-α含量降低(P<0.05),NLRP3、ASC、Caspase-1蛋白表达均明显降低(P<0.05),其中中药高剂量组作用最为明显。结论 白虎人参汤合枳实薤白桂枝汤对心肌有保护作用,其机制可能与抑制NLRP3炎癥小体过度激活,减少心肌细胞焦亡,降低炎症反应有关。
〔关键词〕 糖尿病心肌病;白虎人参汤合枳实薤白桂枝汤;NOD样受体蛋白3炎性小体;炎症;细胞焦亡
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.003
Effects of Baihu Renshen Decoction combined with Zhishi Xiebai Guizhi Decoction on
myocardial pyroptosis in MKR diabetic cardiomyopathy mice
SHI Liuyang, TAN Danni, LIU Xiu, XIANG Qin, TAN Yan, YU Rong*
Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To investigate the effects of Baihu Renshen Decoction combined with Zhishi Xiebai Guizhi Decoction on the expression of pyroptosis-related protein in myocardial cells of MKR diabetic cardiomyopathy model mice. Methods After successful modeling, MKR mice were randomly divided into model group, low-, medium- and high- dose of Chinese medicine group, and metformin group. FVB mice were set as normal group. After 4 weeks of administration, the changes of glucose and lipid metabolism in mice were observed; the cardiac function of mice was checked by ultrasound imaging platform; the myocardial histomorphology was observed by HE staining and MASSON staining; the serum levels of interleukin-18 (IL-18), interleukin-1β (IL-1β), and tumor necrosis factor-α (TNF-α) were measured by ELISA; the nucleotidebinding oligomerization domain-like receptor 3 (NLRP3), apoptosis-associated speck-like protein containing a CARD (ASC), and cysteinyl aspartate specific proteinase-1 (Caspase-1) protein levels in mouse myocardial tissue were measured by Western blot. Results Compared with the normal group, fasting blood glucose (FBG) was significantly higher (P<0.01), serum total cholesterol (TC), triglyceride (TG) and low density lipoprotein (LDL) levels increased (P<0.05),while high density lipoprotein cholesterol (HDL-C) levels decreased (P<0.05), left ventricular ejection fraction (EF) and left ventricular fractional shortening (FS) values were significantly reduceed (P<0.01) in the model group; cell hypertrophy and deformation, myocardial fibers were disorganized, texture was irregular, serum IL-1β, IL-18 and TNF-α content increased, IL-1β, IL-18 and TNF-α protein expression levels in myocardial tissue increased, and NLRP3, ASC and Caspase-1 protein expression in myocardial tissue were significantly elevated (P<0.01). Compared with the model group, in each treatment group, FBG, TC, TG and LDL levels decreased (P<0.05), HDL-C level was higher (P<0.05), EF and FS values increased (P<0.05), myocardial histopathological damage was significantly alleviated, serum IL-1β, IL-18 and TNF-α content decreased (P<0.05), and NLRP3, ASC and caspase-1 protein expressions significantly decreased (P<0.05), with the most significant effect in the high dose group of Chinese medicine. Conclusion Baihu Renshen Decoction combined with Zhishi Xiebai Guizhi Decoction has protective effects on myocardium, and the mechanism may be related to the inhibition of NLRP3 inflammasome overactivation, the reduction of myocardial cell pyroptosis, and the reduction of inflammatory response.
〔Keywords〕 diabetic cardiomyopathy; Baihu Renshen Decoction combined with Zhishi Xiebai Guizhi; NOD-like receptor protein 3 inflammasome; inflammation; pyroptosis
近年来,随着人民生活水平的提高及生活习惯改变,糖尿病及其并发症在我国发病率逐年升高[1]。糖尿病心肌病(diabetic cardiomyopathy, DCM)是最常见的糖尿病并发症之一,可导致心律失常、心力衰竭,甚至引发猝死,是DM患者心力衰竭发生率和死亡率较高的主要原因[2]。DCM发病机制复杂,当前研究认为高血糖、胰岛素抵抗、高甘油三酯等因素可导致氧化应激和炎症反应的发生,引起心肌细胞坏死、凋亡、纤维化等改变,最终引起心肌结构、功能改变[3]。炎症反应在在DCM的发展中起到关键作用[4],焦亡被称为细胞炎性坏死,是一种炎症性较高的细胞程序性死亡[5],具有细胞凋亡与坏死的共同独特特征。NOD样受体蛋白3(nucleotidebinding oligomerization domain-like receptors 3, NLRP3)炎性小体可激活半胱氨酸的天冬氨酸蛋白水解酶-1(cysteinyl aspartate specific proteinase-1, Caspase-1),有活性的Caspase-1可使白细胞介素-18(interleukin-18, IL-18)和白细胞介素-1β(interleukin-1β, IL-1β)活化,引起下游炎症反应[6],提示心肌细胞焦亡在DCM的发生、发展过程中起到促进作用。
本研究所使用的2型糖尿病动物模型MKR小鼠为良好的T2DM模型鼠,具有发病快、死亡率低等特点[7]。课题组前期已成功制备DCM模型[8],本研究沿用课题组前期方法,采用链脲佐菌素(streptozotocin, STZ)干预加速成模、高脂饲料持续喂养MKR小鼠的方法制备DCM模型,以探讨白虎人参汤合枳实薤白桂枝汤对MKR小鼠DCM的治疗作用,并且进一步阐述该方对炎症、对心肌细胞细胞焦亡的影响,为DCM治疗及中药合方的临床应用提供了新思路。
1 材料
1.1 实验动物
MKR小鼠是由美国国立卫生研究院糖尿病研究中心LeRoith D提供的纯合子MKR小鼠,本课题组将自然交配后繁殖的后代用于实验研究(伦理审批编号:ZYFY20210728),饲养于湖南中医药大学SPF级实验动物中心[动物合格证号:SYXK(湘)2013-0005];FVB鼠(FVB鼠與MKR鼠源自同一遗传背景作为正常组)购自斯贝福(北京)动物技术有限公司[动物许可证号:SCXK(京)2019-0010,动物质量合格证号:No.110324221102357848]。
1.2 主要药物
白虎人参汤合枳实薤白桂枝汤组成:石膏50 g,知母18 g,甘草6 g,粳米9 g,人参10 g,枳实12 g,厚朴12 g,瓜蒌12 g,薤白9 g,桂枝6 g。粳米于市面购买,其余药物饮片均购自湖南中医药大学第一附属医院门诊中药药房,由湖南中医药大学药学院吴勇军副教授鉴定为正品。按比例称取上述药材,先蒸馏水浸泡30 min,后煎煮2次,合并煎液后纱布过滤,旋转蒸发仪将滤液浓缩至含生药量2 g/mL后,置于4 ℃冰箱备用。
盐酸二甲双胍片(浙江亚太药业股份有限公司,批号:H33020106,0.25 g/片);葡萄糖溶液(湖南科伦制药有限公司,批号:H20058338,规格10 g/20 mL),均购自湖南中医药大学第一附属医院门诊西药药房。
1.3 主要试剂和仪器
IL-18、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)酶联免疫吸附测定试验(ELISA)检测试剂盒(上海酶联生物科技有限公司,批号分别为LOT20220607A、LOT20220607A、LOT20220607A);NLRP3一抗、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein contain a CARD, ASC)一抗、Caspase-1一抗(美国Proteintech公司,货号分别为19771-1-AP、10500-1-AP、22915-1-AP)。
GA-3型血糖仪(三诺生物传感股份有限公司);MB-530型多功能酶标分析仪(深圳市汇松科技发展有限公司);DYY-6C型电泳仪、DYCZ-40D型转膜仪(北京六一生物科技有限公司);H1650R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.4 DCM小鼠造模、分组及给药剂量
4周龄MKR小鼠30只,FVB小鼠6只。MKR小鼠采用高脂饲料喂养,FVB小鼠予以普通饲料喂养。4周后对MKR鼠进行STZ腹腔注射以加速成模,前一天禁食不禁水8 h,将STZ溶于0.1 mmol/L柠檬酸钠缓冲液(pH4.0),按20 mg/kg剂量行腹腔注射,1次/d,连续3 d。STZ注射后第3天测小鼠空腹血糖,FBG≥11.1 mmol/L为成模条件。4周后采用超声成像平台检测小鼠心功能,出现心功能减退,则证明DCM小鼠造模成功。造模成功后,将小鼠按性别、体质量、空腹血糖随机分为模型组,二甲双胍组,白虎人参汤合枳实薤白桂枝汤低剂量组、中剂量组、高剂量组(简称为中药低、中、高剂量组)。共计5组,每组6只,FVB小鼠为正常组。
按人和动物体表面积的等效剂量系数折算法,选用70 kg成人用量换算,中药中剂量组18.75 g/kg、中药低剂量组9.37 g/kg、中药高剂量组37.5 g/kg、二甲双胍组0.065 g/kg予以灌胃。正常组、模型组则以等体积蒸馏水灌胃持续4周,灌胃容积为20 mL/kg,每天1次。
2 方法
2.1 血糖、血脂水平检测
给药第0天和第28天,检测DCM小鼠血糖值(fasting blood glucose, FBG)变化,小鼠断食不断水8 h后测空腹血糖,用血糖仪尾末端采血,测量各小鼠FBG。血脂四项血清总胆固醇(serum total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白(low density lipoprotein, LDL)由上海酶联生物科技有限公司全自动生化法检测。
2.2 超聲成像平台检测MKR小鼠心功能
糖尿病小鼠造模成功后,持续高脂饲料喂养4周,用超声成像平台检测MKR小鼠心功能。若检测到小鼠左室射血分数(ejection fraction, EF),左室短轴缩短率(fractional shortening, FS)值降低,说明DCM小鼠造模成功[9]。灌胃4周后,再次检测MKR小鼠EF、FS值。
2.3 光镜下观察小鼠心肌组织病理形态
取心肌组织,多聚甲醛固定后脱水、石蜡包埋、切片、贴片,采用常规HE及MASSON染色,观察心肌组织形态结构。
2.4 ELISA检测炎症因子相关指标
按照ELISA试剂盒说明书,将眼眶取血采集到的血清进行IL-1β、IL-18、TNF-α指标检测。
2.5 Western blot法检测心肌组织蛋白表达
取适量心肌组织标本提取总蛋白,根据蛋白定量的结果,于第一孔点入marker 2 μL,其他每孔上样10 μL已变性蛋白;开始电泳,电泳恒定电压75 V,时间为130 min,待溴酚蓝电泳至胶底部时终止电泳;电泳结束后电转移到硝酸纤维素膜(NC膜),4 ℃封闭过夜,封闭后加入NLRP3(1∶300)、Caspase-1(1∶500)、ASC(1∶1000)一抗,室温孵育90 min。再加入HRP标记的山羊抗鼠IgG(1∶5000)、山羊抗兔IgG(1∶5000)二抗,室温孵育90 min。使用ECL化学发光液与膜孵育1 min,在暗盒内与X射线胶片曝光20 min,显影冲洗。以Tubulin蛋白表达量校正,用Quantity One专业灰度分析软件进行数据分析。
2.6 统计学方法
采用SPSS 25.0软件统计分析数据,计量资料以“x±s”表示,多组计量资料符合正态性、方差齐性采用单因素方差分析,组间比较采用最小显著性差异法(LSD法);若不满足方差齐性采用Dunnett-T3检验;不满足正态性时,用秩和检验。以P<0.05表示差异有统计学意义。
3 结果
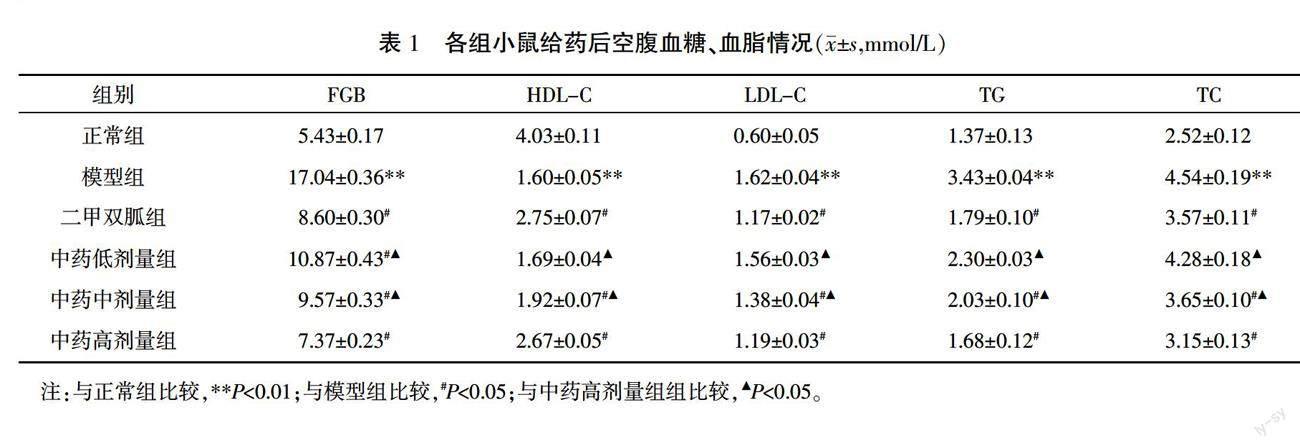
3.1 中药对DCM小鼠血糖、血脂的影响
与正常组比较,模型组的血清FBG、TC、TG、LDL-C水平显著升高(P<0.01),血清HDL-C水平明显降低(P<0.01)。与模型组相比,中药各剂量组及二甲双胍组血清TC、TG、LDL-C水平明显降低(P<0.05),血清HDL-C水平明显增高(P<0.05);与二甲双胍组比较,中药高剂量组差异无统计学意义(P>0.05);与中药低、中剂量组相比,中药高剂量组血清TC、TG、LDL-C水平降低,血清HDL-C水平升高(P<0.05)。详见表1。
3.2 中药对DCM小鼠心功能的影响
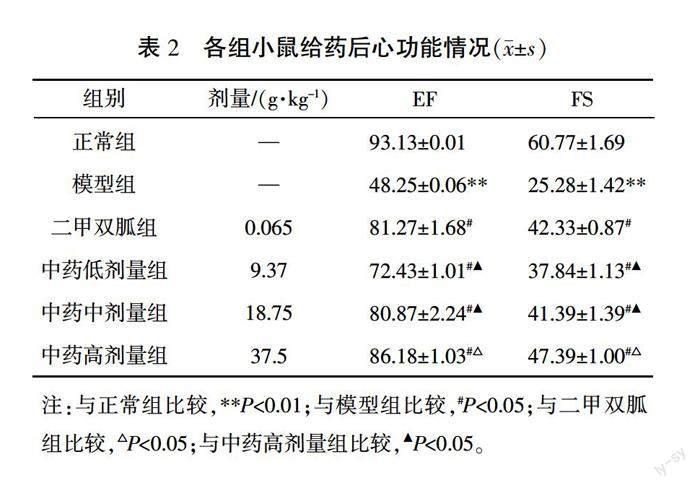
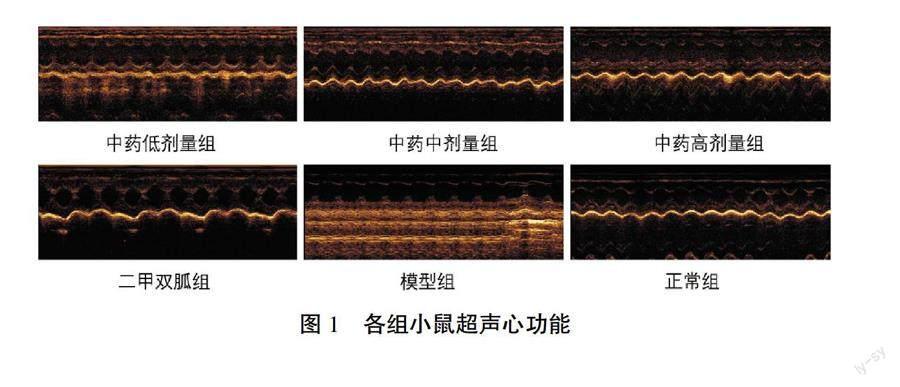
中药合方灌胃4周后,与正常组比较,模型组EF、FS值明显降低(P<0.01);与模型组比较,中药各剂量组及二甲双胍组EF、FS值均有不同程度升高(P<0.05);与二甲双胍及中药低、中剂量组比较,中药高剂量组EF、FS值更高,差异有统计学意义(P<0.05)。详见图1、表2。
3.3 中药合方对DCM小鼠心肌组织病理形态的影响
HE染色、MASSON染色结果显示,正常组小鼠心肌细胞形态正常,纹理整齐,心肌细胞间纤维较少,细胞核位于细胞正中,大小均匀;而模型组小鼠细胞变形、肥大,细胞质、核分离,细胞之间间隙增大,可见到炎性浸润,心肌纤维排列紊乱,纹理不齐。中药各剂量组及二甲双胍组与模型组相比较,小鼠细胞与心肌纤维均有不同程度改善,其中中药高剂量组心肌改善相对明显,细胞排列较整齐,纤维相对完整。详见图2—3。
3.4 中药对各组小鼠IL-1β、IL-18、TNF-α炎症因子表达的影响
与正常组相比,模型组中血清IL-1β、IL-18、TNF-α明显升高(P<0.01);中药各剂量组及二甲双胍组与模型组相比,血清IL-1β、IL-18、TNF-α水平降低(P<0.05);中药高剂量组与二甲双胍组差异无统计学意义(P>0.05),且含量低于中药低、中剂量组(P<0.05)。详见表3。
3.5 中药对DCM小鼠心肌组织中NLRP3、ASC、Caspase-1蛋白表达的影响
与正常组比较,模型组心肌组织NLRP3、ASC、Caspase-1蛋白表达明显升高(P<0.01);与模型组比较,中药各剂量组及二甲双胍组心肌组织中NLRP3、ASC、Caspase-1蛋白表达均降低(P<0.05);中药高剂量组蛋白表达低于二甲双胍和中药低、中剂量组(P<0.05)。详见图4、表4。
4 讨论
调查显示,截至2017年,全球18岁以上人群中糖尿病患者约计4.51亿人,预计2045年将达6.93亿人[10]。DCM为糖尿病心血管并发症,以心脏结构改变和持续的收缩与舒张功能不全为特征,主要病理特征为心肌细胞坏死、心肌纤维化等心肌结构变化[11]。目前仍缺乏有效的防治DCM手段。中医药有毒副作用小、成分多、多靶点作用等特点,因此,探讨中医药在DCM的治疗方面的作用有积极意义。DCM发病机制包括炎症反应、代谢障碍、氧化应激等多种途径,其中炎症反应贯穿始终,促进DCM的发生发展[4,12]。炎症通路的激活可介导细胞及细胞外损伤、心脏重塑,引起收缩和舒张功能障碍[13]。NLRP3炎性小体是近年来研究热点,在DCM发生中发挥关键作用。研究表明,抑制NLRP3炎性小体可有效减轻DCM炎症反应,从而改善DCM心肌损伤和心肌纤维化等过程[14]。LUO等[15]发现在沉默NLRP3基因后,糖尿病大鼠心脏功能改善,心肌纤维化和心肌细胞焦亡显著减少。ZHANG等[16]实验研究表明高糖环境可间接介导NLRP3炎性小体的激活,导致新生大鼠心肌纤维化。NLRP3炎性小体复合物由NLRP3、ASC和pro-Caspase-1组成[17],可通过炎症反应、细胞焦亡、心肌纤维化多种方式促进DCM的发生发展[18]。NLRP3炎性小体可诱导pro-Caspase-1自我剪切产生有活性的Caspase-1。Caspase-1的活化将无活性的pro-IL-1β、pro-IL-18切割为有活性的IL-1β和IL-18,IL-1β为成熟的分泌因子,可通过激活下游信号通路诱发系列炎症反应,研究表明促炎性细胞因子IL-1β、TNF-α的释放增加会促进DCM的发展[19];IL-18、IL-1β等炎症产物还可刺激心肌成纤维细胞合成大量胶原,导致过度胶原堆积、心肌纤维化和心脏重构[20-21];同时,Caspase-1还可触发gasdermin D(GSDMD)的N端寡聚化,诱发心肌细胞细胞焦亡,是细胞焦亡的经典途径[22]。
中医学中并无“糖尿病心肌病”病名,根据临床表现,当将其归于“消渴”并发“胸痹”“心痛”等范畴。古代医家认为阴虚内热是消渴病的主要病机[23]。消渴病久,气阴两虚,心脉失养,或阴虚燥热炼液成痰,痰浊闭阻心脉,从而引发DCM[24]。现代研究证明,中医药有良好的降血糖、保护心肌等功能,可有效缓解DCM不适症状[25]。白虎人参汤与枳实薤白桂枝汤均出自东汉·张仲景《伤寒杂病论》。白虎人参汤为治疗消渴病的经典名方,具有益氣、养阴功效;枳实薤白桂枝汤可祛痰、散结。两者合用,共奏益气、养阴、化痰之功,可针对DCM气阴两伤、痰阻心脉之病机。
本实验研究根据课题组前期造模方法,予以4周龄MKR小鼠腹腔注射STZ联合高脂饲料喂养的方式成功制备DCM模型。研究结果显示,与空白组比较,模型组小鼠血糖、血脂升高;超声心动显示小鼠EF、FS值均有下降,说明心脏功能减退;HE染色及MASSON染色显示心肌细胞肥大、变性坏死,可见炎性浸润,心肌纤维化,提示DCM模型成功;血清中TNF-α、IL-1β、IL-18水平明显上升,心肌组织NLRP3、ASC、Caspse-1蛋白表达显著增加,提示小鼠存在炎症反应、细胞焦亡、心肌组织中NLRP3炎症小体活化过度的情况,加速了DCM的病情进展。中药各组干预4周后,DCM小鼠FBG、TC、TG、LDL下调,HDL升高,表明白虎人参汤合枳实薤白桂枝汤可改善DCM大鼠血糖、血脂水平;EF、FS值均有不同程度上升;HE及MASSON染色心肌组织形态则较模型组有不同程度改善;ELISA检测血清中TNF-α、IL-1β、IL-18含量降低;Western blot结果表明DCM小鼠心肌组织NLRP3、ASC、Caspase-1蛋白表达降低,表明中药各组可抑制NLRP3炎症小体活化、减轻焦亡、降低炎症因子水平、减轻炎症反应,其中高剂量组效果最好。
综上所述,本研究发现白虎人参汤合枳实薤白桂枝汤可有效抑制NLRP3炎症小体活化水平,降低DCM小鼠炎症反应,改善心肌纤维化,延缓DCM病程进展。同时,在实验中白虎人参汤合枳实薤白桂枝汤剂量越高,其抗炎、保护心肌作用就越明显。研究表明,NLRP3炎症小体是治疗DCM的潜在靶点,为白虎人参汤合枳实薤白桂枝汤治疗DCM提供理论依据,丰富了中药合方治疗DCM的临床策略。但关于该方的最佳用药剂量尚不明确,有待进一步研究。
参考文献
[1] 谭 艳,周 聪,黄 柔,等.茵陈蒿汤对MKR鼠2型糖尿病合并非酒精性脂肪性肝病的作用[J].中国实验方剂学杂志,2021,27(21):105-113.
[2] 杨洛琦,谢连娣,周莉君.从藏象理论探析糖尿病心肌病[J].陕西中医,2022,43(10):1423-1426.
[3] WESTERMEIER F, NAVARRO-MARQUEZ M, LóPEZ-CRISOSTO C, et al. Defective insulin signaling and mitochondrial dynamics in diabetic cardiomyopathy[J]. Biochimica et Biophysica Acta, 2015, 1853(5): 1113-1118.
[4] WILLIAMS L J, NYE B G, WENDE A R. Diabetes-related cardiac dysfunction[J]. Endocrinology and Metabolism (Seoul, Korea), 2017, 32(2): 171-179.
[5] KOVACS S B, MIAO E A. Gasdermins: Effectors of pyroptosis[J]. Trends in Cell Biology, 2017, 27(9): 673-684.
[6] CHANG, JIA. Role of pyroptosis in cardiovascular diseases[J]. International Immunopharmacology, 2019, 67: 311-318.
[7] 余望贻,刘乐平,孟 琼,等. MKR转基因小鼠生物学特性的初步探讨[J].中国畜牧兽医,2009,36(6):99-101.
[8] 苏丽清,喻 嵘,吴勇军,等.左归降糖舒心方对糖尿病心肌病MKR鼠心肌细胞损伤和凋亡的影响[J].世界科学技术-中医药现代化,2022,24(2):554-562.
[9] 徐慧琳,徐郭王君,姚 君,等.阿魏酸对糖尿病小鼠心肌病变的影响及其机制[J].中国应用生理学杂志,2018,34(3):238-241.
[10] CHO N H, SHAW J E, KARURANGA S, et al. IDF diabetes atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2018, 138: 271-281.
[11] JIA G H, WHALEY-CONNELL A, SOWERS J R. Diabetic cardiomyopathy: A hyperglycaemia- and insulin-resistance-induced heart disease[J]. Diabetologia, 2018, 61(1): 21-28.
[12] 周 江,武建英,杨 佳.糖尿病心肌病发病机制的研究进展[J].中西医结合心脑血管病杂志,2022,20(6):1025-1028.
[13] TAN Y, ZHANG Z G, ZHENG C, et al. Mechanisms of diabetic cardiomyopathy and potential therapeutic strategies: Preclinical and clinical evidence[J]. Nature Reviews Cardiology, 2020, 17(9): 585-607.
[14] 黄芷棋,宁一博,贺润铖,等. NLRP3炎性小体与糖尿病心肌病的发生发展[J].中国药理学通报,2021,37(4):463-467.
[15] LUO B B, LI B, WANG W K, et al. NLRP3 gene silencing ameliorates diabetic cardiomyopathy in a type 2 diabetes rat model[J]. PLoS One, 2014, 9(8): e104771.
[16] ZHANG X H, FU Y, LI H, et al. H3 relaxin inhibits the collagen synthesis via ROS- and P2X7R-mediated NLRP3 inflammasome activation in cardiac fibroblasts under high glucose[J]. Journal of Cellular and Molecular Medicine, 2018, 22(3): 1816-1825.
[17] YU Z W, ZHANG J, LI X. A new research hot spot: The role of NLRP3 inflammasome activation, a key step in pyroptosis, in diabetes and diabetic complications[J]. Life Sciences, 2020, 240: 117138.
[18] 赵奕凯,吴帮卫,李 剑. NLRP3炎症小体在糖尿病心肌病(DCM)中作用机制的研究进展[J].复旦学报(医学版),2020,47(1):117-121.
[19] WANG Y Q, LI H, LI Y, et al. Coriolus versicolor alleviates diabetic cardiomyopathy by inhibiting cardiac fibrosis and NLRP3 inflammasome activation[J]. Phytotherapy Research, 2019, 33(10): 2737-2748.
[20] TURNER N A. Inflammatory and fibrotic responses of cardiac fibroblasts to myocardial damage associated molecular patterns (DAMPs)[J]. Journal of Molecular and Cellular Cardiology, 2016, 94: 189-200.
[21] FIX C, BINGHAM K, CARVER W. Effects of interleukin-18 on cardiac fibroblast function and gene expression[J]. Cytokine, 2011, 53(1): 19-28.
[22] LIU X, ZHANG Z B, RUAN J B, et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores[J]. Nature, 2016, 535(7610): 153-158.
[23] 喻 嶸.紧扣糖尿病病机辨病辨证结合诊治[J].中国中西医结合杂志,2019,39(3):267-269.
[24] 苏丽清,喻 嵘,吴勇军,等.糖尿病心肌病从“久病入络”论治探讨[J].湖南中医药大学学报,2017,37(8):838-841.
[25] 王贞贞,赵泉霖,宋亚一,等.中医药防治糖尿病心肌病进展[J].中国中医急症,2020,29(4):728-731.
〔收稿日期〕2022-11-01
〔基金项目〕国家自然科学基金项目(82074400,U21A20411,82004185);湖南省教育厅创新平台开放基金项目(20K094);湖南省科学厅重点研发计划项目(2020SK2101);湖南省教育厅科技计划青年项目(20B450)。
〔第一作者〕史留阳,男,硕士,研究方向:仲景杂病证治及经方应用基础研究。
〔通信作者〕*喻 嵘,女,博士,教授,博士研究生导师,E-mail:yuron@21.cn.com。

