六味地黄汤通过miR-210/HIF-1α信号通路对CoCl2诱导的HK-2细胞上皮间质转化的影响和机制研究
张海英 王晖 潘佳俊 高海波 赵欣然 刘春燕 唐群
〔摘要〕 目的 觀察六味地黄汤(Liuwei Dihuang Decoction, LWDHD)调控miR-210/HIF-1α信号通路对CoCl2诱导的HK-2细胞上皮间质转化(epithelial mesenchymal transdifferentiation, EMT)的作用和机制。方法 体外培养HK-2细胞,分对照组(N组)、模型组(M组)、LWDHD血清组(LW组)、空白血清+miR-210过表达组(LV-miR-210组)、空白血清+miR-210沉默组(LV-anti-miR-210组)、空白血清+miR-210阴性对照组(LV-miR-210 NC组)、LWDHD血清+miR-210过表达组(LW+LV-miR-210组)、LWDHD血清+miR-210沉默组(LW+LV-anti-miR-210组)、LWDHD血清+miR-210阴性对照组(LW+LV-miR-210 NC组),除N组外,其他各组加入CoCl2处理。CCK-8法检测不同浓度LWDHD、CoCl2在24 h后对HK-2细胞活性的影响并选择最佳干预浓度。细胞免疫荧光和Western blot法检测各组HK-2细胞中缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)、β-联蛋白(β-catenin)、波形蛋白(Vimentin)、上皮钙黏素(E-cadherin)蛋白表达情况;qPCR法检测miR-210、HIF-1α、β-catenin、Vimentin mRNA表达情况。通过慢病毒感染HK-2细胞,实现miR-210的过表达和抑制,并加入CoCl2,观察miR-210、HIF-1α、β-catenin、Vimentin蛋白和mRNA表达以及LWDHD的干预作用。结果 CCK-8结果显示,LWDHD、CoCl2最佳干预浓度分别为10%、200 μmol/L。与N组相比,M组细胞形态由铺路石样向长梭形改变,HIF-1α、β-catenin、Vimentin蛋白和mRNA表达升高(P<0.05,P<0.01),miR-210 mRNA表达升高(P<0.01),E-cadherin蛋白表达降低(P<0.01);与M组相比,LW组HIF-1α、β-catenin、Vimentin蛋白和mRNA表达降低(P<0.05,P<0.01),miR-210 mRNA表达降低(P<0.05),E-cadherin蛋白表达升高(P<0.01)。与LV-miR-210 NC组相比,LV-anti-miR-210组HIF-1α、β-catenin、Vimentin蛋白和mRNA表达降低(P<0.05,P<0.01);与LV-miR-210 NC组相比,LV-miR-210组HIF-1α、β-catenin、Vimentin蛋白和mRNA表达升高(P<0.05,P<0.01)。在慢病毒转染各组的基础上,加入LWDHD处理后,LWDHD可降低各组HIF-1α、β-catenin、Vimentin蛋白和mRNA表达(P<0.05,P<0.01)。结论 LWDHD抗纤维化作用机制与其下调miR-210/HIF-1α信号通路,抑制肾小管EMT有关。
〔关键词〕 肾纤维化;六味地黄汤;上皮间质转化;miR-210;缺氧诱导因子1α;HK-2细胞
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.007
Effects and mechanism of Liuwei Dihuang Decoction on CoCl2-induced epithelial-mesenchymal transition of HK-2 cells through the miR-210/HIF-1α signaling pathway
ZHANG Haiying, WANG Hui, PAN Jiajun, GAO Haibo, ZHAO Xinran, LIU Chunyan*, TANG Qun*
Medical College, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To observe the effects and mechanism of Liuwei Dihuang Decoction (LWDHD) regulating epithelial
mesenchymal transition (EMT) of HK-2 cells induced by CoCl2 through miR-210/HIF-1α signaling pathway. Methods HK-2 cells were cultured in vitro and divided into normal group (N group), model group (M group), LWDHD medicated serum group (LW group), blank serum+over-espressed miR-210 group (LV-miR-210 group), blank serum+silent miR-210 group (LV-anti-miR-210 group), blank serum+miR-210 negative group (LV-miR-210 NC group), LWDHD medicated serum+over-expressed miR-210 group (LW+LV-miR-210 group), LWDHD medicated serum+silent miR-210 group (LW+LV-anti-miR-210 group) and LWDHD medicated serum+miR-210 negative group (LW+LV-miR-210 NC group). Except for N group, the other groups were treated with CoCl2. CCK-8 was used to detect the effect of different concentrations of LWDHD and CoCl2 on the activity of HK-2 cells after 24 hours, and the best intervention concentration was selected. Cell immunofluorescence and Western blot were used to determine hypoxia-inducible factor-1α (HIF-1), β-catenin, Vimentin, and E-cadherin protein expression levels. miR-210, HIF-1α, β-catenin and Vimentin mRNA expression levels were measured by qPCR. By lentivirus transfection of HK-2 cells, miR-210 was overexpressed and inhibited. Then CoCl2 was added to the medium. The miR-210, HIF-1α , β-catenin, Vimentin protein and mRNA expression of the regulation effect of LWDHD were observed. Results The CCK-8 showed that the optimal intervention concentrations of LWDHD and CoCl2 were 10% and 200 μmol/L, respectively. Compared with N group, the morphology of cells in group M changed from the shape of paving stone to the shape of long spindle. HIF-1α, β-catenin, Vimentin protein and mRNA expression increased (P<0.05, P<0.01) while miR-210 mRNA expression increased (P<0.01) and E-cadherin protein expression decreased (P<0.01). Compared with M group, LW group can significantly reduce the expression of HIF-1α, β-catenin, Vimentin protein and mRNA (P<0.05, P<0.01), down-regulate the expression of miR-210 mRNA (P<0.05) and up-regulate the expression of E-cadherin protein (P<0.01). Compared with the LV-miR-210 NC group, LV-anti-miR-210 group showed lower HIF-1α, β-catenin, Vimentin protein and mRNA (P<0.05, P<0.01), and LV-miR-210 group showed higher HIF-α, β-catenin, Vimentin protein and mRNA (P<0.05, P<0.01). After LWDHD administration to each group of lentivirus transfection, HIF-1α, β-catenin, Vimentin protein and mRNA expression decreased (P<0.05, P<0.01). Conclusion The anti-fibrosis mechanism of LWDHD is related to its down-regulation of miR-210/HIF-1α signaling pathway, which is related to the inhibition of renal tubular EMT.
〔Keywords〕 renal fibrosis; Liuwei Dihuang Decoction; epithelial-mesenchymal transition; miR-210; hypoxia inducible factor-1α; HK-2 cells; HK-2 cells
慢性肾脏病(chronic kidney disease, CKD)是世界范围内的公共卫生问题[1]。CKD的主要病理特征是肾纤维化(renal fibrosis, RF)。肾小管上皮间质转化(epithelial mesenchymal transdifferentiation, EMT)是RF的重要机制之一。由于治疗方法有限,CKD患者的长期生存率和生活质量都很低。因此,如何有效预防EMT是肾脏疾病研究领域的焦点之一[2]。CKD早期普遍存在低氧,慢性低氧是导致RF的关键因素[3]。目前研究已证实,低氧通过表达低氧诱导因子-1α(hypoxia inducible factor, HIF-1α)信号途径引起RF,参与EMT过程[4]。微小RNA(micro RNA, miRNA)是一种功能性非编码RNA,长度约22个核苷酸。低氧可诱导大量miRNA表达的变化,其中miR-210与HIF-1α的关系最为密切[5]。HIF-1α的累積促进miR-210表达的增加,而miR-210反过来可以通过抑制HIF-1α的降解来增强其分子的稳定性[6]。miR-210可以参与体内各种生理和病理过程,例如细胞增殖[7]、炎症损伤[8]、EMT[9]等。已经证实,miR-210广泛存在于各种恶性肿瘤如乳腺癌、肝癌等,并参与EMT发生发展,导致恶性肿瘤细胞侵袭和转移[10]。miR-210/HIF-1α通路促进EMT的发生可能是RF的重要发病机制。六味地黄汤(Liuwei Dihuang Decoction, LWDHD)是临床治疗CKD的有效方剂,但其有效机制尚未完全阐明[11]。现代药理学研究发现,该方具有抗氧化、抗缺氧、抗纤维化的药理作用[12]。本研究以CoCl2诱导的HK-2细胞为研究对象,探讨LWDHD通过miR-210/HIF-1α信号通路调控EMT的作用机制,以期为临床防治CKD提供理论和实验依据。
1 材料与方法
1.1 动物及细胞
雄性SD大鼠34只,体质量(200±20) g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SYXK(湘)2019-0009,所有动物饲养在湖南中医药大学SPF级实验动物中心。HK-2(人肾皮质近曲肾小管上皮细胞)细胞株(批号:CL-0109,武汉普诺赛生命科技有限公司)。本研究由湖南中医药大学实验动物伦理委员会审查通过,审查批号:LLBH-202105100002。
1.2 主要试剂与仪器
CoCl2(批号:C118624,上海阿拉丁生化科技股份有限公司);LV-hsa-miR-210慢病毒、LV-hsa-miR-210-inhibition慢病毒、阴性对照病毒CON137、嘌呤霉素(批号分别为:13462E6、13462E4、1343EAA、134635C,上海吉凯基因科技有限公司);BCA蛋白定量试剂盒(批号:E-BC-K318,武汉伊莱瑞特生物科技股份有限公司);HIF-1α抗体、β-联蛋白(β-catenin)抗体、波形蛋白(Vimentin)抗体、上皮钙黏素(E-cadherin)抗体、GAPDH抗体(批号分别为:10002313、00069064、00103236、20000258、B2202101,武汉三鹰生物技术有限公司);PAGE蛋白预制胶(批号:J67319002S,南京艾思易生物科技有限公司);总RNA快速抽提试剂盒(货号:Cat#220011,上海飞捷生物技术有限公司);miRNA逆转录试剂盒、SYBR扩增试剂盒(批号分别为:05231416、05227808,苏州近岸蛋白质科技股份有限公司)。miR-210正向引物(货号:Cat#HmiRQP0317,广州复能基因有限公司)。
酶标仪(型号:Spark 20M,瑞士Tecan公司);化学发光成像分析仪(型号:721BR17573,美国Bio-Rad公司);正置荧光显微镜(型号:Axioscope,德国Carl·Zeiss公司);实时荧光定量RCR仪(型号:LightCycler 96,瑞士Roche公司)。
1.3 药物与含药血清制备
中药LWDHD配方:熟地黄、山药、山茱萸、泽泻、茯苓、牡丹皮(批号分别为:2012213、TH21092703、SX20180904、SX21093006、CK21092703、CK21100804)按照8∶4∶4∶3∶3∶3比例配制,所有药材均购自湖南中医药大学第一附属医院。按照随机数字表将34只雄性SD大鼠分为2组:空白对照组、LWDHD组,各17只。根据前期实验,LWDHD组以每日33.75 g/kg六味地黄煎液灌胃(相当于70 kg成人剂量的5倍)[13],空白对照组以每日10 mL/kg蒸馏水灌胃。适应性饲养5 d,灌胃7 d后,收集血清,血清分装储存于-80 ℃冰箱内备用。
1.4 细胞分组
HK-2细胞系,分为对照组(N组)、模型组(M组)、LWDHD血清组(LW组)、空白血清+miR-210过表达组(LV-miR-210组)、空白血清+miR-210沉默组(LV-anti-miR-210组)、空白血清+miR-210阴性对照组(LV-miR-210 NC组)、LWDHD血清+miR-210过表达组(LW+LV-miR-210组)、LWDHD血清+miR-210沉默组(LW+LV-anti-miR-210组)、LWDHD血清+miR-210阴性对照组(LW+LV-miR-210 NC组)。除N组外,其他组加入CoCl2模拟肾内缺氧环境,同时加入空白或含药血清,培养24 h后收集细胞。
1.5 细胞转染
接种体积:用完全培养基(10% FBS DMEM)制备密度5×104个/mL细胞悬液,接种5 mL至25 cm2培养瓶中,37 ℃培养16~24 h,至细胞汇合度为20%~30%。感染体积:用完全培养基5 mL,按说明书加入相应病毒量。病毒体积=(感染复数×细胞数目)/病毒滴度,感染复数=10。37 ℃培养12~16 h,更换为完全培养基,继续培养;中途可对细胞换液,保持细胞活性;感染后约72 h,观察感染效率;将细胞继续培养于含有1 ?滋g/mL嘌呤霉素的培养基中进行稳定株筛选。
1.6 CCK-8法筛选最佳血清及CoCl2干预浓度
细胞悬液密度5×104个/mL、100 μL/孔接种在96孔板中,37 ℃培养24 h;吸弃培养基,每孔分别加入100 μL含有0、2.5%、5%、10%、20%浓度药物血清的培养基或0、100、200、300、400、800 μmol/L CoCl2,干预24 h后取出96孔板;去旧培养液,加入CCK-8工作液,37 ℃继续孵育2 h;450 nm处测量光密度值,通过细胞存活率选择最佳的血清浓度和缺氧时间。
1.7 Western blot法检测各组HK-2细胞中HIF-1α、β-catenin、Vimentin、E-cadherin的蛋白水平
给药24 h后,收集蛋白,测定蛋白浓度;用PAGE预制胶分离并转移蛋白到PVDF膜;3%~5%牛奶封闭2 h;一抗4 ℃孵育过夜[HIF-1α(1∶8000)、β-catenin(1∶5000)、Vimentin(1∶5000)、E-cadherin(1∶10000)、GAPDH(1∶15000)];次日,TBST洗膜3次,10 min/次,二抗(1∶15000)孵育2 h;ECL檢测蛋白条带;Image J软件分析。
1.8 qPCR法检测各组HK-2细胞中miR-210、HIF-1α、β-catenin、Vimentin mRNA表达
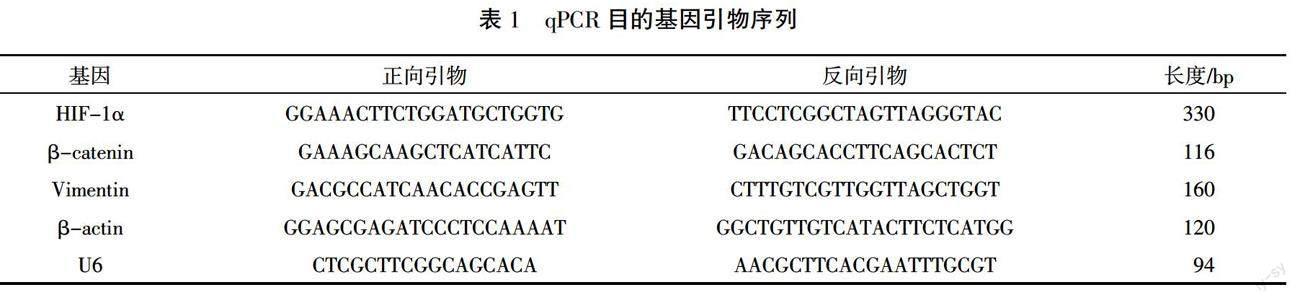
给药24 h后,用总RNA快速抽提试剂盒提取总RNA。根据试剂盒进行RNA逆转录和扩增。miR-210正向引物购自广州复能基因有限公司,反向引物来自试剂盒,引物序列均未知。其余引物均购自擎科生物有限公司,序列详见表1。相对定量采用2-ΔΔCt法,U6或β-actin作为内参。
1.9 免疫荧光法检测各组HK-2细胞中HIF-1α、β-catenin、Vimentin、E-cadherin蛋白水平
将细胞以5×104个/mL、1 mL/孔密度接种于24孔板爬片中;培养24 h,待细胞生长至80%后进行分组造模;每孔加适量4%多聚甲醛进行细胞固定15 min;0.1%曲拉通通透10 min;5% BSA 封闭30 min;一抗4 ℃孵育过夜[HIF-1α(1∶500)、β-catenin(1∶500)、Vimentin(1∶400)、E-cadherin(1∶200)];次日,室温静置30 min;荧光二抗(1∶200) 37 ℃避光孵育1 h;DAPI染核2 min,以上每个步骤间使用TBST清洗3次,5 min/次;抗荧光淬灭剂封片;正置荧光显微镜下观察、拍照。
1.10 统计方法
运用SPSS 25.0软件进行数据分析。计量资料以“x±s”表示,先进行正态性和方差齐性检验,满足正态性时,采用单因素方差分析,组间比较若方差齐时采用LSD检验,方差不齐时用Kruskal-Wallis检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 LWDHD可减弱CoCl2对HK-2细胞的影响
培养24 h后,随着CoCl2刺激剂量增加后,细胞从铺路石到长梭形的形态学变化明显,甚至大量死亡。详见图1。与0 μmol/L CoCl2组比较,200、300、400、800 μmol/L CoCl2组显著降低了细胞活力(P<0.01),而100 μmol/L CoCl2组无明显变化(P>0.05)。因此,在随后实验中,CoCl2的剂量为200 μmol/L。增加LWDHD剂量作用于HK-2细胞后,与0 LWDHD组相比,20% LWDHD组细胞活力明显降低(P<0.01),2.5%、5%、10% LWDHD组无明显变化(P>0.05)。因此,后续实验LWDHD浓度选用10%。详见图2。与N组比较,M组HK-2细胞中HIF-1α、β-catenin、Vimentin蛋白和mRNA表达增加(P<0.01),E-cadherin蛋白表达降低(P<0.01),CoCl2成功诱导HK-2细胞EMT;与M组比较,LW组HK-2细胞中HIF-1α、β-catenin、Vimentin蛋白和mRNA表达降低(P<0.05,P<0.01),E-cadherin蛋白表达增加(P<0.01)。详见图3、表2—3。免疫荧光结果证实CoCl2诱导缺氧24 h后HK-2细胞HIF-1α、β-catenin、Vimentin高表达,阳性信号分别定位于细胞核、细胞膜、细胞膜;E-cadherin低表达,阳性信号定位于细胞质。详见图4。
2.2 LWDHD下调CoCl2处理的HK-2细胞中miR-210的表达
与N组比较,M组HK-2细胞中miRNA-210表达水平增加(P<0.01);与M组比较,LW组HK-2细胞中miR-210表达水平降低(P<0.05)。详见图5。
2.3 LWDHD通过下调miR-210减轻HK-2细胞EMT
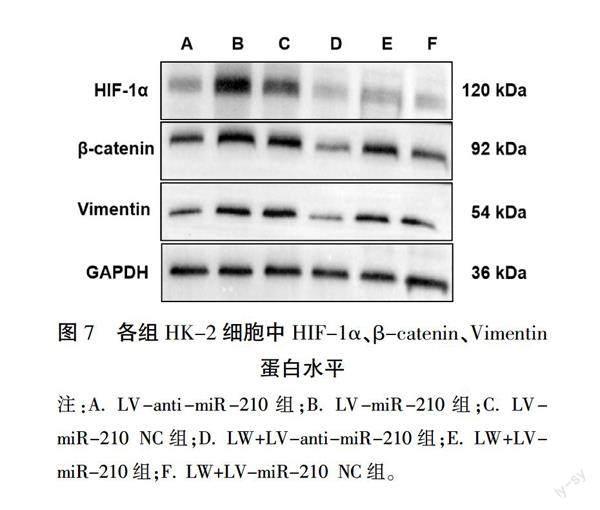
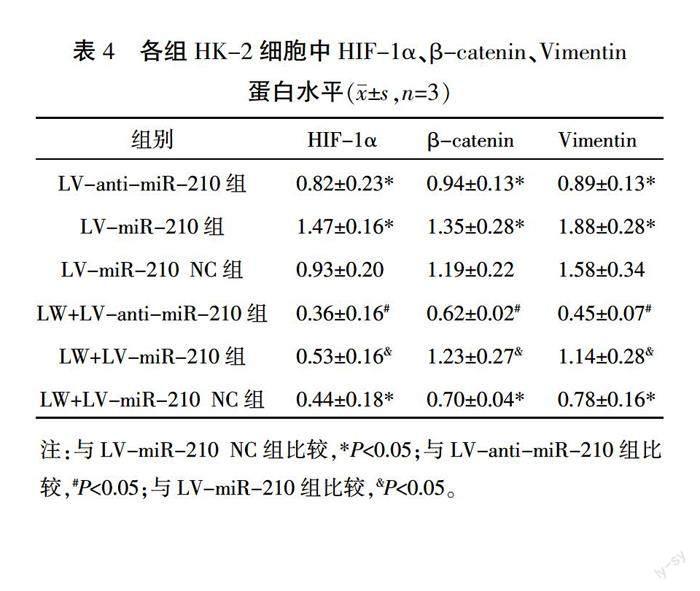
细胞转染后,LV-miR-210组HK-2细胞中miR-210水平高于LV-miR-210 NC组(P<0.05),而LV-anti-miR-210组miR-210水平显著低于LV-miR-210 NC组(P<0.01),慢病毒转染成功。详见图6。与LV-miR-210 NC组比较,LV-miR-210组HK-2细胞中HIF-1α、β-catenin、Vimentin蛋白和mRNA表达增加(P<0.05,P<0.01);与LV-miR-210 NC组比较,LV-miR-210组HIF-1α、β-catenin、Vimentin蛋白和mRNA表达升高(P<0.05,P<0.01),抑制miR-210的表达可抑制EMT。与上述3组比较,在此基础上加LWDHD的3组HK-2细胞中HIF-1α、β-catenin、Vimentin蛋白和mRNA表达水平降低(P<0.05,P<0.01),LWDHD可通过下调miR-210/HIF-1α表达,抑制EMT。免疫荧光结果显示:与LV-miR-210 NC组比较,LV-miR-210组HK-2细胞中HIF-1α、β-catenin、Vimentin高表达,E-cadherin低表达;反之,LV-anti-miR-210组HK-2细胞中HIF-1α、β-catenin、Vimentin低表达,E-cadherin高表达。与上述3组比较,在此基础上加LWDHD的3组HK-2细胞中HIF-1α、β-catenin、Vimentin低表达,E-cadherin高表达。详见图7—8,表4—5。
3 讨论
LWDHD为北宋时期钱乙所创制,收录于《小儿药证直诀》,由熟地黄、山茱萸、山药、泽泻、牡丹皮、茯苓组成,具有三补三泻的特点。熟地黄滋阴补肾,山茱萸补养肝肾,山药补益脾阴,为“三补”;泽泻利湿泄肾浊,牡丹皮清泻虚热,茯苓淡渗脾湿,为“三泻”。中医学认为,气和血关系密切,气行则血行,气滞则血瘀,因此,肾气虚可导致血瘀,进而引致肾内缺氧。熟地黄、山茱萸、山药能调节免疫系统的功能,提高机体抗氧化能力,改善肾气虚,纠正肾内缺氧。泽泻、牡丹皮、茯苓具有活血散瘀、渗湿利水泻热功效。LWDHD是目前临床治疗CKD的有效方剂[14]。
近期研究证实,miR-210是一种重要的低氧相关miRNA,其茎-环结构位于染色体11p15.5上AK123483基因转录的内含子中,受缺氧诱导因子调节,后者参与EMT的调节,导致恶性肿瘤细胞的侵袭和转移[15-16]。反过来,miR-210表达增加也可以促进HIF-1α表达。Vimentin是肌成纤维细胞的标志性蛋白。E-cadherin是上皮细胞的标志性蛋白,参与形成和维护细胞间的连接。HIF-1α的下游调控因子β-catenin在调节细胞增殖和分化中起重要作用。在正常情况下,β-catenin参与E-cadherin与肌动蛋白的连接,促进诱导EMT的基因转录。HIF-1α对EMT的调节作用部分受β-catenin的调控[17]。
EMT引起肾间质纤维化,最终导致肾损伤。CoCl2是一种常用的化学缺氧诱导剂,已广泛用作EMT和缺氧损伤诱导剂[18-20]。本研究使用CoCl2在HK-2细胞中构建EMT模型,模拟RF的病理过程。结果显示,CoCl2降低了细胞活力,诱导EMT间质标记物Vimentin表达升高(P<0.01),上皮标志物E-cadherin表达降低(P<0.01),HIF-1α、β-catenin表达降低(P<0.01),表明EMT模型构建成功。在此基础上,进一步研究LWDHD对CoCl2诱导的HK-2细胞EMT的影响。以往主要通过TGF-β/Smad途径研究LWDHD对RF的影响。例如,有研究表明在糖尿病肾病大鼠中,六味地黄丸通过抑制TGF-β诱导的Smad2磷酸化和α-SMA的表达来保护肾小球系膜细胞并预防RF[21]。本课题组前期研究已證实,LWDHD可以上调5/6肾切除大鼠肾组织中E-cadherin的表达,并下调HIF-1α和Twist的表达,从而延缓RF[22]。本研究结果显示:LWDHD可减轻CoCl2对HK-2细胞的影响,表现为EMT间质标记物Vimentin表达降低(P<0.05,P<0.01),上皮标志物E-cadherin表达升高(P<0.05,P<0.01),HIF-1α、β-catenin表达降低(P<0.05,P<0.01)。随后检测miR-210在HK-2细胞中的表达水平,CoCl2诱导条件下miR-210表达水平升高(P<0.01),经LWDHD处理后,miR-210表达水平降低(P<0.05)。进一步通过转染miR-210抑制、过表达、空载体慢病毒,实验结果表明,抑制miR-210可降低CoCl2诱导的HK-2细胞EMT,反之,过表达miR-210则加重EMT。在慢病毒转染各组的基础上,加入LWDHD处理后,LWDHD可降低各组HIF-1α、β-catenin、Vimentin表达(P<0.05,P<0.01)。上述结果说明,miR-210/HIF-1α信号通路可促进EMT的发生发展,而LWDHD可抑制miR-210的表达,提示LWDHD可能通过调节miR-210调控EMT。
综上所述,LWDHD能显著提高CoCl2处理的HK-2细胞的存活率,并改善EMT;在CoCl2诱导的HK-2细胞中,miR-210高表达,LWDHD可下调miR-210/HIF-1α信号通路,进而抑制肾小管EMT,从而延缓RF。
参考文献
[1] KIBRIA G M A, CRISPEN R. Prevalence and trends of chronic kidney disease and its risk factors among US adults: An analysis of NHANES 2003-18[J]. Preventive Medicine Reports, 2020, 20: 101193.
[2] PANIZO S, MART?魱NEZ-ARIAS L, ALONSO-MONTES C, et al. Fibrosis in chronic kidney disease: Pathogenesis and consequences[J]. International Journal of Molecular Sciences, 2021, 22(1): 408.
[3] LEE P, CHANDEL N S, SIMON M C. Cellular adaptation to hypoxia through hypoxia inducible factors and beyond[J]. Nature Reviews Molecular Cell Biology, 2020, 21(5): 268-283.
[4] 李姗姗,孙 倩,杨少宁,等.中医药基于HIF-1α信号通路调节肾间质纤维化[J].现代中西医结合杂志,2022,31(10):1450-1454.
[5] 王加豪.益气温阳活血法治疗特发性肺纤维化的临床效应及其调控miR-210-3P表达的实验研究[D].济南:山东中医药大学,2021.
[6] 杜 洁,陈艳梅,丁丽敏,等.血清miR-210、HIF-1α水平变化与急性脑梗死患者神经功能缺损评分的相关性[J].中国卫生工程学, 2021,20(5):818-820.
[7] WEI N, SONG H B. Circ-0002814 participates in proliferation and migration through miR-210 and FUS/VEGF pathway of preeclampsia[J]. Journal of Obstetrics and Gynaecology Research, 2022, 48(7): 1698-1709.
[8] ZHANG J T, HE J G, LUO Y M, et al. MiR-210 regulates the inflammation of otitis media with effusion by inhibiting the expression of hypoxia-inducible factor (HIF)-1a[J]. Biochemical and Biophysical Research Communications, 2021, 534: 401-407.
[9] RONGLI, WANG. MicroRNA-210/Long non-coding RNA MEG3 axis inhibits trophoblast cell migration and invasion by suppressing EMT process[J]. Placenta, 2021, 109: 64-71.
[10] BOUKROUT N, SOUIDI M, LAHDAOUI F, et al. Antagonistic roles of the tumor suppressor miR-210-3p and oncomucin MUC4 forming a negative feedback loop in pancreatic adenocarcinoma[J]. Cancers, 2021, 13(24): 6197.
[11] LIAO T T, ZHAO K N, HUANG Q, et al. A randomized controlled clinical trial study protocol of Liuwei Dihuang pills in the adjuvant treatment of diabetic kidney disease[J]. Medicine, 2020, 99(31): e21137.
[12] SUN X Y, WU B, GENG L G, et al. Xiaokang Liuwei Dihuang Decoction ameliorates the immune infertility of male rats induced by lipopolysaccharide through regulating the levels of sex hormones, reactive oxygen species, pro-apoptotic and immune factors[J]. Biomedecine & Pharmacotherapie, 2021, 139: 111514.
[13] 王 茜,成細华,刘春燕,等.六味地黄汤含药血清对CoCl2诱导HK-2细胞后E-cadherin、α-SMA表达的影响[J].湖南中医药大学学报,2022,42(4):557-563.
[14] 詹苏欣.六味地黄汤联合参苓白术散治疗慢性肾衰竭的临床效果[J].中外医学研究,2022,20(10):9-12.
[15] DONG B, LI S Y, ZHU S L, et al. MiRNA-mediated EMT and CSCs in cancer chemoresistance[J]. Experimental Hematology & Oncology, 2021, 10(1): 1-12.
[16] RAHMATI M, FERNS G A, MOBARRA N. The lower expression of circulating miR-210 and elevated serum levels of HIF-1α in ischemic stroke: Possible markers for diagnosis and disease prediction[J]. Journal of Clinical Laboratory Analysis, 2021, 35(12): e24073.
[17] 杜 江.阿托伐他汀通过降低HIF-1α/β-catenin表达抑制百草枯中毒致上皮-间质转化[D].南京:南京医科大学,2018.
[18] KANG M K, KIM S I, OH S Y, et al. Tangeretin ameliorates glucose-induced podocyte injury through blocking epithelial to mesenchymal transition caused by oxidative stress and hypoxia[J]. International Journal of Molecular Sciences, 2020, 21(22): 8577.
[19] GE H, LIU J, LIU F X, et al. Long non-coding RNA ROR mitigates cobalt chloride-induced hypoxia injury through regulation of miR-145[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1): 2221-2229.
[20] MU?譙OZ-S?魣NCHEZ J, CH?魣NEZ-C?魣RDENAS M E. The use of cobalt chloride as a chemical hypoxia model[J]. Journal of Applied Toxicology, 2019, 39(4): 556-570.
[21] XU Z J, SHU S, LI Z J, et al. Liuwei Dihuang pill treats diabetic nephropathy in rats by inhibiting of TGF-β/SMADS, MAPK, and NF-kB and upregulating expression of cytoglobin in renal tissues[J]. Medicine, 2017, 96(3): e5879.
[22] 董 翔,胡 爽,王 茜,等.六味地黄汤对5/6肾切除大鼠肾脏缺氧诱导因子-1α及Twist和E-cadherin表达的影响[J].北京中医药大学学报,2020,43(11):927-934.
〔收稿日期〕2022-09-02
〔基金项目〕湖南省自然科学基金项目(2021JJ30506);湖南省教育厅项目(21A0242,20C1398);长沙市自然科学基金项目(kq2014089);湖南中医药大学研究生科研创新项目(2021CX32)。
〔第一作者〕张海英,女,硕士研究生,研究方向:肾纤维化病理机制及防治。
〔通信作者〕*刘春燕,女,博士,副教授,E-mail:liuchunyan0221@126.com;唐 群,男,博士,教授,硕士研究生导师,E-mail:tangqun460@126.com。

