黄芪-当归6种活性成分配伍对大鼠血管外膜成纤维细胞合成细胞外基质的影响
徐顺洲 陈凌波 阎卉芳 邓常清
〔摘要〕 目的 观察黄芪-当归活性成分阿魏酸(ferulic acid, FA)、毛蕊异黄酮苷(calycosinglucoside, CG)、芒柄花素(formononetin, FMN)、黄芪皂苷Ⅰ(astragalosideⅠ, ASⅠ)、黃芪甲苷(astragaloside Ⅳ, AS Ⅳ)、毛蕊异黄酮(calycosin, CAL)配伍对血管紧张素Ⅱ(angiotensinⅡ, AngⅡ)诱导的大鼠血管外膜成纤维细胞(vascular adventitia fibroblasts, VAF)合成细胞外基质(extracellular matrix, ECM)的影响。方法 以AngⅡ诱导VAF增殖模型,采用目标成分“敲除/敲入”的方法,将细胞分为空白组、模型组、IC10配伍组、某一活性成分敲除组、某一活性成分敲入组,分别检测细胞及培养液中纤维连接蛋白(fibronectin, FN)、层粘连蛋白(laminin, LN)、Ⅰ型胶原(collagen typeⅠ, COLⅠ)、Ⅲ型胶原(collagen typeⅢ, COLⅢ)含量,并检测细胞基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)、基质金属蛋白酶组织抑制剂2(tissue inhibitor of metalloproteinase 2, TIMP2)、转化生长因子β1(transforming growth factor-β1, TGF-β1)蛋白表达,研究黄芪-当归6种活性成分配伍对VAF合成ECM的影响。结果 黄芪-当归6种活性成分配伍抑制VAF合成FN、LN、COLⅠ、COLⅢ(P<0.01)。FA、CG、FMN、ASⅠ敲入后抑制FN、LN合成的作用增强(P<0.05或P<0.01),FA、CAL、FMN、ASⅠ、AS Ⅳ敲入后抑制COLⅠ、COLⅢ合成的作用增强(P<0.05或P<0.01)。黄芪-当归6种活性成分配伍促进MMP2、TIMP2的表达(P<0.01),FA、CG、FMN、AS Ⅳ、CAL敲入后促进MMP2表达的作用增强(P<0.05或P<0.01),FMN、AS Ⅳ、CAL敲入后促进TIMP2表达的作用增强(P<0.05或P<0.01);黄芪-当归6种活性成分配伍抑制TGF-β1表达(P<0.05),FA、CG、FMN敲入后抑制TGF-β1表达的作用增强(P<0.05或P<0.01)。结论 黄芪-当归6种活性成分配伍可抑制VAF合成ECM,其作用可能是通过调节TGF-β1、MMP2、TIMP2发挥的。
〔关键词〕 黄芪;当归;活性成分;血管外膜成纤维细胞;细胞外基质
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.001
Effects of compatibility of 6 active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) on extracellular matrix synthesis by vascular adventitia fibroblasts in rats
XU Shunzhou1,2, CHEN Lingbo1, YAN Huifang1, DENG Changqing1*
1. School of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Department of Cardiology, The First Hospital of Hunan College of Chinese Medicine, Zhuzhou, Hunan 412000, China
〔Abstract〕 Objective To observe the effects of 6 active components of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis), namely ferulic acid (FA), calycosinglucoside (CG), formononetin (FMN), astragalosideⅠ (ASⅠ), astragalosideⅣ(ASⅣ) and calycosin (CAL), on the synthesis of extracellular matrix (ECM) by vascular adventitia fibroblasts (VAF) induced by angiotensinⅡ (AngⅡ) in rats. Methods By employing VAF proliferation model induced by AngⅡ, and the target component "knock-out/knock-in" method, the cells were divided into blank group, model group, 10% inhibitory concentration compatibility group, active component knock-out group, and active component knock-in group. Then, the content of fibronectin (FN), laminin (LN), collagen typeⅠ(COLⅠ), and collagen type Ⅲ(COLⅢ) in cells and culture medium were measured respectively. The expression levels of matrix metalloproteinase2 (MMP2), tissue inhibitor of matrix metalloproteinase2 (TIMP2), and transforming growth factor-β1 (TGF-β1) were detected. Based on the above, we studied the effects of compatibility of six active components of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) on extracellular matrix synthesis by vascular adventitia fibroblasts in rats. Results The compatibility of 6 active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) can inhibit the synthesis of FN, LN, COLⅠ and COLⅢ by VAF (P<0.01); after the knock-in of FA, CG, FMN and AS I, the synthesis of FN and LN was more inhibited (P<0.05 or P<0.01); and after the knock-in of FA, CAL, FMN, AS I, and AS Ⅳ, the synthesis of COLI and COLⅢ was more inhibited (P<0.05 or P<0.01). The compatibility of 6 active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) can promote the expression of MMP2 and TIMP2 (P<0.01); after the knock-in of FA, CG, FMN, ASⅣ and CAL, the expression of MMP2 was enhanced (P<0.05 or P<0.01), and after the knock-in of FMN, ASⅣ and CAL, the expression of TIMP2 was enhanced (P<0.05 or P<0.01); the compatibility of six active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) can inhibit the expression of TGF-β1 (P<0.05); after the knock-in of FA, CG and FMN, the expression of TGF-β1 was more inhibited (P<0.05 or P<0.01). Conclusion The compatibility of six active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) can inhibit the synthesis of ECM by VAF in rats, possibly by regulating TGF-β1, MMP2 and TIMP2.
〔Keywords〕 Huangqi (Radix Astragali); Danggui (Radix Angelicae Sinensis); active ingredients; vascular adventitia fibroblasts; extracellular matrix
病理性血管重构是诸多心血管疾病发生发展的共同病理基础[1],是一个动态变化的过程,主要包括细胞增殖、迁移、凋亡以及细胞外基质(extracellular matrix, ECM)合成、降解和重新排列等。目前研究发现,血管外膜对损伤的反应最为灵敏,先于内膜及中膜,可能是介导内膜及中膜病变的始动因素和“主导者”[2]。ECM是血管壁的重要组成部分,研究发现,ECM对生理和病理刺激的反应是高度动态的[3]。外膜的胶原成分主要由血管外膜成纤维细胞(vascular adventitia fibroblasts, VAF)合成与分泌,因此,VAF决定了血管ECM的组成。当血管损伤时,血管壁细胞合成大量ECM,同时合成基质金属蛋白酶(matrix metalloproteinase, MMP)增加,导致原有基质发生降解,被激活的细胞侵入病变区,膠原蛋白、纤维连接蛋白(fibronectin, FN)等沉积增加,最后形成胶原纤维交互连接,血管在ECM降解和新的基质成分沉积增加过程中发生重构[4-5]。因此,调节ECM成为改善血管重构治疗的潜在靶点[6]。课题组前期研究表明,黄芪和当归配伍可抑制血管内膜增生,改善局部血管炎症反应,减轻ECM在血管壁的沉积,抑制血管平滑肌细胞(vascular smooth muscle cell, VSMC)表型转化和增殖[7-11]。药物吸收实验表明,黄芪-当归配伍活性成分阿魏酸(ferulic acid, FA)、毛蕊异黄酮苷(calycosin glycoside, CG)、芒柄花素(formononetin, FMN)、黄芪皂苷Ⅰ(astragalosideⅠ, ASⅠ)、黄芪甲苷(astragaloside Ⅳ, AS Ⅳ)、毛蕊异黄酮(calycosin, CAL)可吸收入血[12-13]。血管内皮细胞(vascular endothelial cell, VEC)氧化损伤模型相关研究发现,上述6种成分及配伍可减轻氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)诱导的VEC氧化损伤,促进VEC增殖,对VEC氧化损伤具有保护作用[14]。VSMC异常增殖模型研究发现,上述6种活性成分配伍可以抑制VSMC异常增殖[15]。因此,推测这些有效成分可以抑制VAF合成ECM。本研究用血管紧张素Ⅱ(angiotensinⅡ, AngⅡ)诱导VAF增殖模型,采用目标成分“敲除/敲入”的方法[16],研究黄芪-当归6种活性成分配伍对ECM合成的影响。
1 材料与方法
1.1 细胞
大鼠VAF购自武汉普诺赛生命科技有限公司,批号:CP-R077。经鉴定,VAF标志物Vimentin表达阳性率>90%,符合VAF生物学特征。
1.2 试剂与药物
ASⅠ(纯度≥98%,批号:C10070259,上海麦克林生化科技有限公司);FA(纯度>99%,批号:SF8030)、FMN(纯度>98%,批号:SF8070)、AS Ⅳ(纯度>98%,批号:SA8640)、CAL(纯度>98%,批号:SC8040)、CG(纯度>98%,批号:SC8050)、AngⅡ(批号:A9290)、二甲基亚砜(dimethyl sulfoxide, DMSO)(批号:1129E033)均购自北京索莱宝科技有限公司;DMEM高糖培养基(批号:AE29163339,美国HyClone公司);兔抗大鼠基质金属蛋白酶抑制因子2(tissue inhibitor of metallo proteinase 2, TIMP2)多克隆抗体(武汉爱博泰克生物科技有限公司,批号:A1558);兔抗大鼠基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)单克隆抗体(批号:ab92536)、兔抗大鼠转化生长因子-β1(transforming growth factor-β1, TGF-β1)单克隆抗体(批号:ab179695)均购自英国abcam公司;兔抗大鼠β-肌动蛋白(β-actin)多克隆抗体(批号:20536-1-AP)、HRP标记山羊抗兔IgG二抗(批号:SA00001-2)均购自武汉三鹰生物技术有限公司。
1.3 主要仪器
Heracell型CO2培养箱(德国Heraeus公司);SW-CJ-1FD型超净工作台(中国苏州安泰公司);CYTATION5型ChemiDo C-XRS+化学发光成像分析仪、Synergy HT型多功能酶标成像系统仪(美国博腾仪器有限公司)。
1.4 方法
1.4.1 VAF培养 将VAF用含10%胎牛血清的DMEM制成细胞悬液,置于37 ℃无菌CO2培养箱中培养,每3天换液1次,每周传代2次,第4代开始用于实验。
1.4.2 各活性成分的制备 各活性成分以DMSO-DMEM溶解,制备成储存液,使用时以基础培养液稀释,含药培养基中DMSO终体积分数≤0.1%。
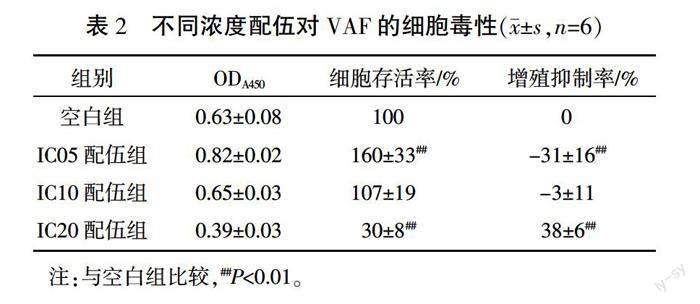
1.4.3 细胞毒性实验 选择各个成分,在对细胞有着相同抑制效应的5%、10%、20%抑制浓度(inhibiting concentration, IC)即IC05、IC10、IC20中进行配伍。取对数生长期VAF,以2500个/孔接种于96孔培养板。待细胞贴壁后,无血清培养基培养使细胞同步化于G0期。然后将细胞随机分为空白组:加入基础培养基;IC05配伍组:加入6种活性成分浓度均为IC05配伍的培养基;IC10配伍组:加入6种活性成分浓度均为IC10配伍的培养基;IC20配伍组:加入6种活性成分浓度均为IC20配伍的培养基。每组设6个复孔。药物干预48 h后,每孔加入CCK-8试剂10 μL,37 ℃温育1 h,应用酶标仪于450 nm波长处检测各孔吸光度(A)。按下式计算细胞存活率和细胞增殖抑制率:细胞存活率=(实验孔A-空白孔A)/(对照孔A-空白孔A)×100%;细胞增殖抑制率=(1-实验孔A/对照孔A)×100%。
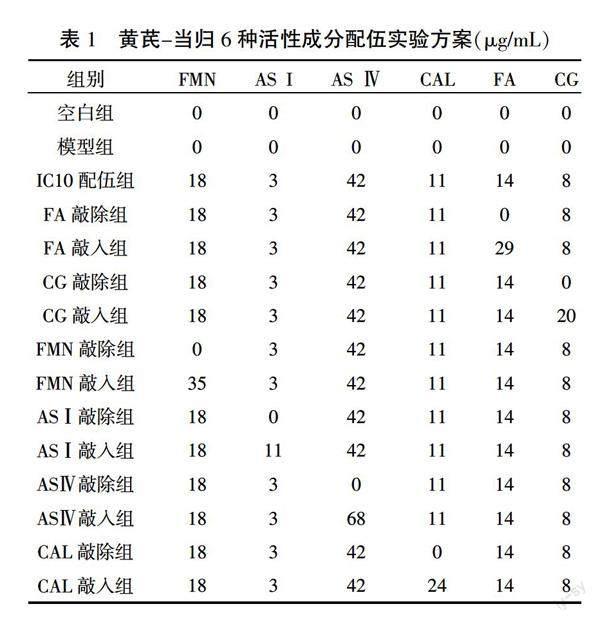
1.4.4 “敲除/敲入”法研究活性成分配伍对VAF合成ECM的影响 取对数生长期VAF,接种于6孔培养板。待细胞贴壁后,同步化于G0期。参考相关资料[16],将细胞随机分为空白组、模型组(AngⅡ 10-6 mol/L[17])、IC10配伍组、某一成分敲除组、某一成分敲入组。IC10配伍组6种活性成分浓度均为IC10配伍,“敲除”是在各成分IC10配伍基础上敲除某目标成分,“敲入”是在各成分IC10配伍基础上将目标成分的剂量增加至IC20(FA:IC10 14 μg/mL,IC20 29 μg/mL;CG:IC10 8 μg/mL,IC20 20 μg/mL;FMN:IC10 18 μg/mL,IC20 35 μg/mL;ASⅠ:IC10 3 μg/mL,IC20 11 μg/mL;ASⅣ:IC10 42 μg/mL,IC20 68 μg/mL;CAL:IC10 11 μg/mL,IC20 24 μg/mL)。详见表1。
1.4.5 ELISA法检测细胞总FN、LN、COLⅠ、COLⅢ含量 各组细胞干预48 h后,同时收集培养液及细胞,采用超聲破碎仪破碎细胞,离心后取提取液,采用ELISA法检测FN、LN、COLⅠ、COLⅢ含量,操作按说明书进行。
1.4.6 Western blot法检测细胞MMP2、TIMP2、TGF-β1表达 各组细胞干预48 h后,收集细胞提取总蛋白,BCA法测定蛋白浓度,每孔上样蛋白量20 μg,蛋白样品经电泳及转膜后,5%脱脂牛奶封闭1~2 h,分别加入抗TIMP2抗体(1∶2000)、抗TGF-β1抗体(1∶2000)、抗MMP2抗体(1∶3000)、抗β-actin抗体(1∶8000),4 ℃过夜,TBST清洗10 min×3次,加入HRP标记羊抗兔二抗(1∶8000),37 ℃孵育1 h,TBST清洗10 min×3次,显影。采用Image Lab图像分析软件分析结果,以目的蛋白与β-actin光密度值的比值作为目的蛋白的相对表达量。
1.5 统计学处理
实验数据以“x±s”表示,用SPSS 26.0统计软件进行分析。多组比较采用单因素方差分析,组间两两比较时,方差齐者采用LSD检验,方差不齐者采用Dunne't s T3检验。以P<0.05为差异有统计学意义。
2 结果
2.1 黄芪-当归6种活性成分配伍对VAF增殖的影响
与空白组比较,IC05配伍组细胞存活率显著增加、增殖抑制率降低(为负值)(P<0.01),表明IC05配伍可促进VAF增殖;IC10配伍组细胞存活率和增殖抑制率差异均无统计学意义(P>0.05),说明IC10配伍对细胞增殖无明显抑制作用;IC20配伍组细胞存活率显著降低、增殖抑制率显著增加(P<0.01),说明IC20配伍明显抑制VAF增殖。以增殖抑制率<20%作为细胞的无毒性浓度,IC10配伍剂量无细胞毒性,IC20配伍剂量有细胞毒性,故选用IC10配伍剂量作为中点剂量,在此基础上进行活性成分敲除/敲入实验。详见表2。
2.2 黄芪-当归6种活性成分配伍对FN、LN、COLⅠ、COLⅢ的影响
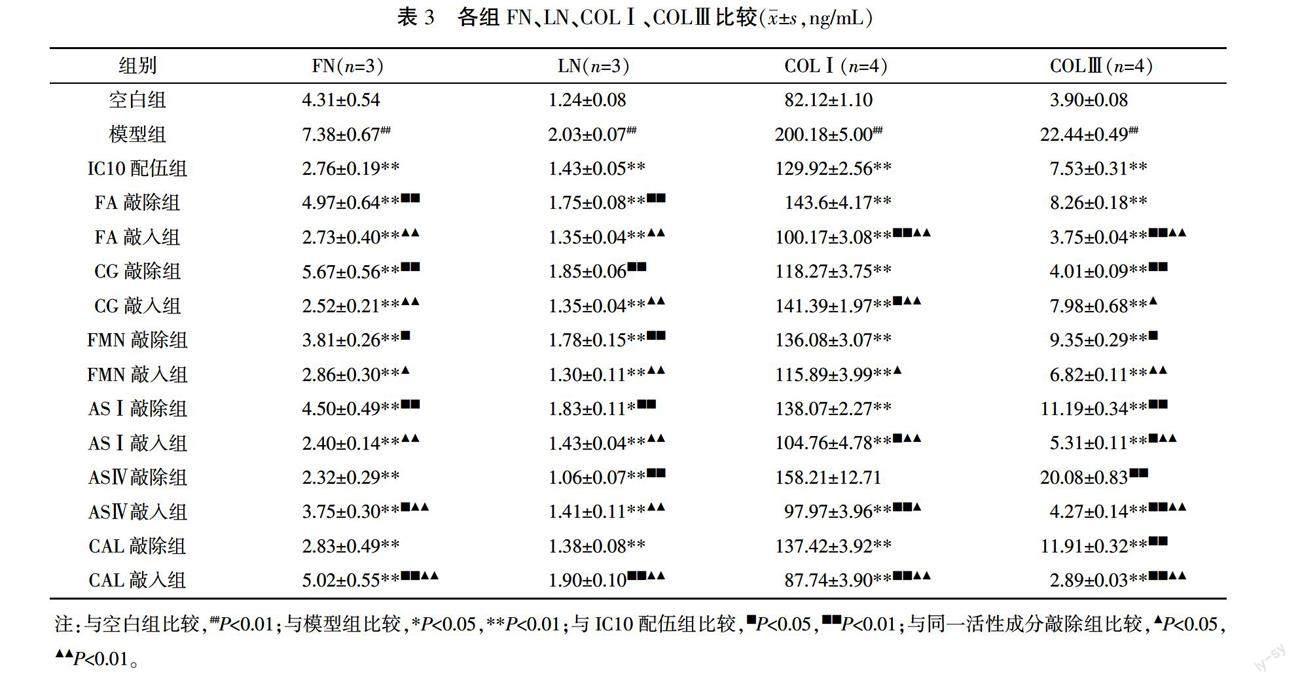
与空白组比较,模型组FN、LN、COLⅠ、COLⅢ含量显著增加(P<0.01)。与模型组比较,IC10配伍组FN、LN、COLⅠ、COLⅢ显著降低(P<0.01)。FA、CG、FMN、ASⅠ敲除组FN、LN含量显著高于对应敲入组及IC10配伍组(P<0.05或P<0.01),AS Ⅳ、CAL敲入组FN、LN含量显著高于对应敲除组(P<0.05或P<0.01)。FMN、FA、ASⅠ、AS Ⅳ、CAL敲入组COLⅠ、COLⅢ显著低于对应敲除组(P<0.05或P<0.01),CG敲入组COLⅠ、COLⅢ显著高于对应敲除组(P<0.05或P<0.01)。详见表3。
2.3 黄芪-当归6种活性成分配伍对MMP2、TIMP2、TGF-β的影响
与空白组比较,模型组MMP2表达显著降低(P<0.01),TGF-β1表达显著升高(P<0.01)。与模型组比较,IC10配伍组MMP2、TIMP2表达显著升高(P<0.01),TGF-β1表达降低(P<0.05)。FA、CG、FMN、AS Ⅳ、CAL敲入组MMP2表达显著高于对应敲除组及IC10配伍组(P<0.05或P<0.01),AS Ⅰ敲入组MMP2表达显著低于对应敲除组(P<0.01),FA、FMN、AS Ⅳ、CAL敲入组TIMP2表达高于对应敲除组(P<0.05或P<0.01),FA、CG、FMN敲入组TGF-β1表达低于对应敲除组(P<0.05或P<0.01),CAL敲入组TGF-β1表达高于对应敲除组(P<0.05)。详见图1、表4。
3 讨论
近年研究表明,血管损伤时,VAF最先被激活,激活后转化为肌成纤维细胞,并分泌大量细胞生长因子,导致大量胶原在血管壁沉积及ECM重构[2,18-19]。TGF-β1是一种多功能的蛋白肽,为生长因子家族的重要成员,可促进ECM合成,抑制MMP的生成并减少胶原蛋白降解[20]。MMP可以降解ECM,MMP2在血管重构中发挥重要作用。TIMP是MMP的特异性内源抑制因子,其中TIMP2主要抑制MMP2,在正常血管中MMP/TIMP处于动态平衡,两者的比例失衡是导致ECM降解减少的重要原因[5]。
气虚血瘀是血管重构的基本病机,益气活血是基本治则。黄芪和当归是临床常用的气血双补药对,黄芪和当归的配伍应用最有名的是黄芪与当归比为5∶1的当归补血汤,具有益气活血之功效[21]。课题组前期研究表明,黄芪-当归在一定比例范围配伍时具有抑制血管内膜增生的作用,其中以黄芪-当归1∶1配伍抗血管内膜增生的作用为佳[7]。其作用机制可能是两药配伍可抑制血管内皮受损后PI3K/Akt信号通路激活,进而抑制VSMC表型转化和细胞增殖,从而发挥抗VSMC增殖的作用[9]。黄芪-当归配伍可抑制血管内膜增生时血管壁ECM沉积[8]。黄芪-当归6种主要活性成分及其配伍可以通过抑制氧化损伤及细胞凋亡,抑制VEC损伤[11]。
为了验证黄芪-当归活性成分配伍能否通过调节ECM合成改善病理性血管重构,本研究以AngⅡ诱导VAF增殖模型,探讨了黄芪-当归活性成分配伍对VAF合成ECM的影响。结果显示,AngⅡ诱导VAF后,细胞合成FN、LN、COLⅠ、COLⅢ的能力增强,TGF-β1表达升高,MMP2、TIMP2表达降低。表明AngⅡ可使VAF合成ECM的能力增强。6种活性成分配伍可降低细胞FN、LN、COLⅠ、COLⅢ合成。在本研究使用的剂量范围内,FA、CG、FMN、ASⅠ可抑制FN、LN合成,FA、FMN、ASⅠ、AS Ⅳ、CAL可抑制COLⅠ、COLⅢ合成。
6种活性成分配伍可促进MMP2的表达,其中FA、CG、FMN、AS Ⅳ、CAL有促进MMP2表达的作用,ASⅠ有抑制MMP2表达的作用。6种活性成分配伍可促进TIMP2的表达,其中FA、FMN、AS Ⅳ、CAL可促进TIMP2表达,CG、ASⅠ对TIMP2表达的作用无明显影响。6种活性成分配伍可以抑制TGF-β1表达,其中FA、CG、FMN可抑制TGF-β1表达,AS Ⅳ、CAL可促进TGF-β1表达,而ASⅠ对TGF-β的表达无明显影响。提示黄芪和当归的活性成分及其配伍可能通过抑制TGF-β1促ECM合成,发挥抑制VAF合成ECM的作用。黄芪和当归的活性成分及其配伍可以促进MMP2、TIMP2表达,其机制可能是使MMP2、TIMP2在一个新的水平上达到平衡,从而有利于调节ECM合成与重构。
综上所述,黄芪-当归6种活性成分配伍可以抑制AngⅡ诱导的VAF合成ECM成分FN、LN、COLⅠ、COLⅢ。其机制可能与抑制TGF-β1信号通路,调节MMP2、TIMP2的表达有关。6种活性成分配伍对ECM合成的调节作用十分复杂,并不只是单个成分药效之间的叠加,而是存在相互作用关系。调整其中某一成分剂量都可能对药物效应产生影响,可能与多种成分对多途径、多靶点发挥作用有关。
参考文献
[1] 张 伟,邓常清.从气血理论探讨病理性血管重构的研究思路[J].中华中医药杂志,2019,34(10):4713-4717.
[2] TINAJERO M G, GOTLIEB A I. Recent developments in vascular adventitial pathobiology: The dynamic adventitia as a complex regulator of vascular disease[J]. The American Journal of Pathology, 2020, 190(3): 520-534.
[3] MA Z H, MAO C F, JIA Y T, et al. Extracellular matrix dynamics in vascular remodeling[J]. American Journal of Physiology Cell Physiology, 2020, 319(3): C481-C499.
[4] OLEJARZ W, ACHETA D, KUBIAK-TOMASZEWSKA G. Matrix metalloproteinases as biomarkers of atherosclerotic plaque instability[J]. International Journal of Molecular Sciences, 2020, 21(11): 3946.
[5] SIM ES G, PEREIRA T, CASEIRO A. Matrix metaloproteinases in vascular pathology[J]. Microvascular Research, 2022, 143: 104398.
[6] KARAMANOS N K, THEOCHARIS A D, PIPERIGKOU Z, et al. A guide to the composition and functions of the extracellular matrix[J]. The FEBS Journal, 2021, 288(24): 6850-6912.
[7] 彭熙炜,阎卉芳,黄 娟,等.黄芪-当归不同配伍比例对大鼠血管内膜增生的影响[J].中国中医药信息杂志,2017,24(6):56-59.
[8] 彭熙炜,阎卉芳,黄 娟,等.黄芪-当归配伍对大鼠血管内膜增生模型细胞外基质的影响[J].湖南中医药大学学报,2018,38(6):629-634.
[9] 阎卉芳,徐 昊,彭熙炜,等.黄芪和当归配伍对大鼠血管内膜增生血管平滑肌细胞增殖的影响[J].中国临床药理学与治疗学,2018,23(4):361-369.
[10] 彭熙炜,阎卉芳,黄 娟,等.黄芪-当归配伍对大鼠血管内膜增生模型炎性反应的影响[J].中华中医药杂志,2019,34(2):580-584.
[11] 谭媖子,刘彩霞,朱秋燕,等.黄芪当归主要活性成分配伍对人脐静脉内皮细胞氧化损伤的保护作用研究[J].中西医结合心腦血管病杂志,2020,18(24):4141-4148.
[12] WEN X D, QI L W, LI P, et al. Simultaneous determination of calycosin-7-O-beta-D-glucoside, ononin, astragaloside IV, astragaloside I and ferulic acid in rat plasma after oral administration of Danggui Buxue Tang extract for their pharmacokinetic studies by liquid chromatography-mass spectrometry[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2008, 865(1/2): 99-105.
[13] 唐 蓉,张依人,陈叶童,等.不同剂量配伍对黄芪-当归中5种化学成分的影响[J].中国实验方剂学杂志,2016,22(23):1-5.
[14] LIU C X, TAN Y Z, DENG C Q. Main active components and cell cycle regulation mechanism of astragali Radix and angelicae Sinensis radix in the treatment of ox-LDL-induced HUVECs injury and inhibition of their cell cycle[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 2021: 8087183.
[15] 陈凌波,任芮彬,阎卉芳,等.基于均匀试验设计的黄芪-当归主要化学成分剂量配伍对血管平滑肌细胞增殖的影响[J].中国实验方剂学杂志,2023,29(3):143-151.
[16] 崔文博,李爱平,崔 婷,等.基于目标成分敲除/敲入技术辨识中药药效物质基础研究进展[J].中国中药杂志,2020,45(6):1279-1286.
[17] GUO Y T, LU Y Y, LU X, et al. Krüppel-like factor 15/interleukin 11 axis-mediated adventitial remodeling depends on extracellular signal-regulated kinases 1 and 2 activation in angiotensin II-induced hypertension[J]. Journal of the American Heart Association, 2021, 10(16): e020554.
[18] LI X D, HONG M N, CHEN J, et al. Adventitial fibroblast-derived vascular endothelial growth factor promotes vasa vasorum-associated neointima formation and macrophage recruitment[J]. Cardiovascular Research, 2020, 116(3): 708-720.
[19] MACKAY C D A, JADLI A S, FEDAK P W M, et al. Adventitial fibroblasts in aortic aneurysm: Unraveling pathogenic contributions to vascular disease[J]. Diagnostics, 2022, 12(4): 871.
[20] TZAVLAKI K, MOUSTAKAS A. TGF-β signaling[J]. Biomolecules, 2020, 10(3): 487.
[21] 劉彩霞,邓常清.中药及复方改善血管内皮细胞氧化应激损伤的研究进展[J].湖南中医药大学学报,2021,41(1):151-158.
〔收稿日期〕2022-06-13
〔基金项目〕国家自然科学基金项目(81874406);湖南省教育厅科学研究项目(18B245)。
〔第一作者〕徐顺洲,男,硕士研究生,主治医师,研究方向:中医药防治心血管疾病。
〔通信作者〕*邓常清,男,博士,教授,博士研究生导师,E-mail:dchangq@sohu.com。

