补阳还五汤抗动脉粥样硬化氧化应激的生信分析及实验研究
龙清吟 傅馨莹 李菀榆 李俊熙 刘竞泽 李艳军 谭维 胡聪 张伟


〔摘要〕 目的 基于基因芯片数据库(GEO)、网络药理学,结合ox-LDL诱导的大鼠主动脉血管内皮细胞氧化损伤模型进行实验验证,探究补阳还五汤(Buyang Huanwu Decoction, BYHWD)干预动脉粥样硬化(atherosclerosis, AS)氧化应激的作用及相关机制。方法 通过TCMSP、Herb数据库收集BYHWD中7味中药有效成分及靶点;从GEO数据库下载GSE19286、GSE2372数据集,鉴定AS差异表达基因(differentially expressed genes, DEGs);通过GeneCards数据庫获取氧化应激靶点;取交集筛选出BYHWD、DEGs、氧化应激共同靶点,进行PPI、GO和KEGG通路富集分析;在GSE19286、GSE2372的表达矩阵中,采用独立样本t检验进行核心靶点验证。结合GEO数据库和网络药理学结果进行体外实验验证,检测药物对细胞活性氧表达及ALB、PLG、F2、GC、PLK1基因表达的影响。结果 筛选出972个中药靶点、9438个氧化应激靶点、173个DEGs,其中103个DEGs在AS组织样本中高表达、70个DEGs在AS组织样本中低表达;综合中药作用靶点、AS DEGs和氧化应激靶点,得到24个“AS潜在靶点”,进行GO和KEGG富集分析,结果提示“AS潜在靶点”主要通过调控细胞周期信号通路,卵母细胞成熟信号通路和细胞减数分裂信号通路等信号通路发挥作用。根据Degree算法对“AS潜在靶点”进行拓扑分析,鉴定出前5位“AS核心靶点”,据统计分析提示BYHWD可能可以通过上调ALB、PLG、F2、GC的表达、下调PLK1的表达起到干预AS氧化应激的作用。体外实验结果显示,BYHWD能抑制ox-LDL引起的活性氧(reactive oxygen species, ROS)增高;qPCR结果显示,ox-LDL刺激后的大鼠主动脉内皮细胞ALB、PLG、F2、GC基因表达均下降,PLK1基因表达上升,BYHWD含药血清干预后可以上调ALB、PLG、F2、GC基因的表达(P<0.01;P<0.05),下调PLK1的表达(P<0.05)。
结论 BYHWD干预AS氧化应激具有多成分、多靶点、多途径的作用特点,其机制可能与减少ROS表达,上调ALB、PLG、F2、GC基因、下调PLK1基因表达相关。
〔关键词〕 补阳还五汤;动脉粥样硬化;氧化应激;基因芯片;网络药理学;分子对接
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.016
Bioanalysis and experimental study of Buyang Huanwu Decoction against oxidative
stress in atherosclerosis
LONG Qingyin, FU Xinying, LI Wanyu, LI Junxi, LIU Jingze, LI Yanjun, TAN Wei, HU Cong, ZHANG Wei*
College of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To investigate the interventions of Buyang Huanwu Decoction (BYHWD) on atherosclerosis (AS) oxidative stress and its related mechanism using Gene Expression Omnibus (GEO) and network pharmacology, combined with the rat aortic vascular endothelial cell oxidative damage model induced by ox-LDL. Methods The active components and targets of 7 Chinese medicines in BYHWD were collected by TCMSP and Herb. GSE19286 and GSE2372 data sets were downloaded from GEO to identify AS differentially expressed genes (DEGs). The oxidative stress (OS) targets were obtained from GeneCards database. The common targets of BYHWD, DEGs and OS were selected by intersection to analyze the enrichment of PPI, GO and KEGG pathways. In the expression matrix of GSE19286 and GSE2372, the core target was verified by independent sample t-test. The effects of drugs on the expression of reactive oxygen species and the expression of ALB, PLG, F2, GC and PLK1 genes were tested in vitro combined with GEO and network pharmacological results. Results The total of 972 TCM targets, 9438 OS targets, and 173 DEGs were screened. Among them, 103 DEGs were highly expressed and 70 DEGs were lowly expressed in AS tissue samples. By combining the BYHWD targets, ASDEGS and OS targets, 24 "AS potential targets" were obtained for GO and KEGG enrichment analysis. The results suggested that "AS potential targets" mainly play a role by regulating cell cycle, oocyte maturation and cell meiosis signaling pathways. According to the topological analysis of "AS potential target" based on Degree algorithm, the five "AS core targets" were identified. According to statistical analysis, BYHWD may interfere with AS OS by up-regulating the expression of ALB, PLG, F2, GC and down-regulating the expression of PLK1. The results of vitro experiment showed that BYHWD could inhibit the increase of reactive oxygen species (ROS) induced by ox-LDL. The qPCR results showed that the expression of ALB, PLG, F2 and GC gene decreased and the expression of PLK1 gene increased in rat aortic endothelial cells stimulated by ox-LDL. BYHWD-containing serum could up-regulate the expression of ALB, PLG, F2 and GC (P<0.01, P<0.05) and down-regulate the expression of PLK1 (P<0.05). Conclusion BYHWD has the characteristics of multi-component, multi-target and multi-pathway in the intervention of atherosclerotic OS, and its mechanism may be related to the decrease of ROS expression, up-regulation of ALB, PLG, F2, GC gene and down-regulation of PLK1 gene expression.
〔Keywords〕 Buyang Huanwu Decoction; atherosclerosis; oxidative stress; gene chip; network pharmacology; molecular docking
《中国心血管健康与疾病报告》指出,2019年我国农村、城市心血管疾病分别占总死亡因素的46.74%和44.26%,每5例死亡中就有2例死于心血管疾病,在我国心血管疾病的发病率与致死率仍高居榜首[1]。动脉粥样硬化(atherosclerosis, AS)是最常见的心血管疾病之一,有着发病缓慢、病程长的特点,以血管内皮细胞(vascular endothelial cells, VECs)发生功能障碍为疾病起点,血管屏障功能受损使得炎性因子、血小板黏附因子、单核细胞及脂质等向VECs下迁移与沉积,同时引起胞内氧化-抗氧化系统失衡产生过多的活性氧(reactive oxygen species, ROS),随着沉积的低密度脂蛋白(low-density lipoprotein, LDL)被修饰成氧化型低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL),继而被巨噬细胞或平滑肌细胞吞噬,形成泡沫细胞,在综合交互作用下,最终导致动脉粥样斑块的形成[2-3]。由此可见,血管内皮细胞的炎症反应和氧化应激是AS的重要起始环节。
虽然AS疾病本身并不致命,但随着斑块不断形成,可能使动脉管腔内血流量减少50%以上[4],继而伴随着血栓形成,叠加在破裂或侵蚀的AS斑块上,就可能导致更严重的甚至危及生命的临床事件,如心绞痛、冠状动脉血栓、中风、心肌梗死等。《动脉粥样硬化中西医结合诊疗专家共识2021》指出[5],根据AS临床上出现的主要症状,中医学可将其归为“眩晕”“头痛”“痴呆”“中风”“胸痹”“真心痛”“脉痹”“脉积”范畴,可分为痰瘀互结、痰热互结、气阴两虚、气滞血瘀4个主要证型。补阳还五汤作为经典方剂用于心血管疾病的治疗。有研究表明,补阳还五汤具有调控AS氧化应激水平的作用[6-7],但中药复方化学成分复杂,补阳还五汤是如何协同多成分、多靶点、多途径干预AS氧化应激的,仍需进一步探讨。
因此,为进一步研究补阳还五汤干预AS氧化应激的作用机制,本研究结合GEO基因芯片数据库、网络药理学,筛选补阳还五汤治疗AS氧化应激的核心靶点,通过原代血管内皮细胞氧化应激损伤等实验进行核心靶点验证,以观察补阳还五汤对AS氧化应激损伤的改善作用。
1 材料与方法
1.1 生物信息学研究
1.1.1 补阳还五汤靶点的获取 通过TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php),以药物口服生物利用度(oral bioavailability, OB)≥30%,化合物类药性(drug likeness, DL)≥0.18为筛选条件,获取补阳还五汤中赤芍、川芎、当归、黄芪、桃仁、红花6味中药的活性成分。通过Herb(http://herb.ac.cn/)数据库,获取补阳还五汤中地龙的中药活性成分。综合TCMSP、Herb库中结果,将补阳还五汤中共7味中药的活性成分导入PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取其SMILES号或活性成分化学结构式[8]。将SMILES号或活性成分化学结构式导入Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)获取中药药物靶点。
1.1.2 AS差异基因的获取 通过GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),以Atherosclerosis为检索词,获取GSE19286、GSE2372芯片。以芯片中样本的表达矩阵作为验证集,将芯片中GSM44658、GSM44659、GSM478610、GSM478611样本设为正常组(Normal组),GSM44660、GSM44661、GSM478606、GSM478607样本设为AS模型组(Model组)。通过R语言limma包分析,并以|log2FC|>1且P.adj<0.05为筛选条件对样本表达矩阵进行差异分析,获取AS差异表达基因(differentially expressed genes, DEGs)。去除一個探针对应多个基因的探针,同时保留多个探针对应一个基因的最大探针。并通过R语言ggplot2包绘制DEGs火山图、R语言ComplexHeatmap包前30位DEGs热图[9]。
1.1.3 氧化应激靶点的获取 以“oxidative stress”作为检索词,在GeneCards[10]数据库(https://www.genecards.org/)中获取氧化应激靶点。
1.1.4 补阳还五汤抗AS氧化应激潜在靶点韦恩图的构建 将补阳还五汤靶点(drug)、AS差异表达基因(DEGs)、氧化应激靶点(oxidative stress)取交集,采用R语言ggplot2包绘制补阳还五汤抗AS氧化应激潜在靶点(AS潜在靶点)韦恩图。
1.1.5 GO功能富集分析和KEGG通路富集分析 通过DAVID数据库(https://david.ncifcrf.gov/),选择“Homo sapiens”物种,获取“AS潜在靶点”的GO、KEGG数据。采用R语言gglopt包根据-log P值绘制前5位GO、KEGG柱状图、前5位KEGG气泡图、前5位KEGG靶点通路图。
1.1.6 蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络图的构建及拓扑分析 通过STRING数据库(https://cn.string-db.org/),导入“AS潜在靶点”选择“Homo sapiens”物种,导出PPI网络图信息。采用Cytoscape 3.7.2对PPI蛋白网络图进行可视化。并利用CytoHubba工具根据Degree值算法鉴定出前5位“AS核心靶点”,对其进行拓扑分析。
1.1.7 “AS核心靶点”统计学分析 获取“AS核心靶点”在GSE19286、GSE2372芯片中Normal组样本与Model组样本的表达矩阵信息,采用R语言对表达矩阵进行独立样本t检验以验证其在AS中的差异表达情况并绘制差异分组比较图。
1.2 实验验证
1.2.1 药物 补阳还五汤由黄芪60 g、赤芍9 g、川芎6 g、当归9 g、地龙9 g、红花9 g、桃仁9 g 组成,购自湖南中医药大学第一附属医院中药房,经湖南中医药大学第一附属医院左亚杰教授鉴定。阿托伐他汀片(批号H20133127,10 mg/片)购自浙江乐普药业股份有限公司。
1.2.2 动物 SPF级雄性SD大鼠,体质量180~200 g,购自湖南斯莱克景达实验动物有限公司,动物合格证号:SCXK(湘)2019-0004。
1.2.3 主要试剂 DMEM/F12培养基、特级胎牛血清(批号:PM150210、164210-500)购自武汉普诺赛生命科技有限公司;CCK8试剂盒(批号:BS350B)购自上海白鲨生物科技有限公司;ox-LDL(批号:YB-002)购自广州奕源生物科技有限公司;RNA提取试剂盒(批号:DP419)购自北京天根生化科技有限公司;逆转录试剂盒(批号:E047)和SYBR qPCR SuperMix Plus(批号:E096-01A)购自上海近岸科技有限公司。
1.2.4 主要仪器 CO2培养箱(德国Heraeus公司);SW-CJ-1FD超净工作台(苏州苏净仪器自控设备有限公司);Cytation 3型多功能酶标仪(美国Bio-Tek公司);Heraeus Fresco 17 型超速冷冻离心机(美国 Thermo Fisher Scientific 公司)。
1.2.5 含药血清 采用随机数表法,将SD大鼠随机分为对照组、补阳还五汤组、阿托伐他汀组,每组5只。含药血清的提取方法及灌胃剂量参考课题组前期方法及研究[11]。药物组灌胃补阳还五汤10.8 g/(kg·d),阿托伐他汀0.9 mg/(kg·d),对照组灌胃等体积生理盐水1 mL/(100 g·d),2次/d,连续7次。于末次给药2 h后,10%戊巴比妥钠腹腔注射麻醉大鼠,麻醉后暴露腹主动脉取血,取血后脱颈处死。4 ℃静置2 h后,全血3000 r/min离心15 min,取上层血清,分别得到空白血清、补阳还五汤血清及阿托伐他汀血清,于水浴锅56 ℃灭活30 min,滤过分装,于-80 ℃保存。
1.2.6 大鼠主动脉内皮细胞提取 主动脉内皮细胞提取参照消化压片法[12]。快速打开大鼠胸腹腔,分离出主动脉,置于含有PBS(含1%青链双抗)的6 cm直径单孔培养皿中,轻轻去除血管外周脂肪、结缔组织。剪开血管,使得血管内膜暴露在外。漂洗3次去除残留的血细胞,吸弃多余PBS。加入2 g/LⅠ型胶原酶2 mL,37 ℃消化1 min后弃去,加入适量含血清培养基终止消化。将主动脉剪成1 mm左右长度的血管段(20~25段),转移至用10 g/L明胶预先包被好的6孔板中央,每孔4~5段。用灭菌的盖玻片盖在血管段上方,轻轻下压,每孔加入2 mL大鼠主动脉内皮细胞完全培养基培养。
1.2.7 大鼠主动脉内皮细胞鉴定 取第3代近融合VECs,细胞爬片后1% BSA封闭30 min,大鼠来源的vWF一抗4 ℃过夜后,用FITC标记的荧光二抗室温孵育1 h,于激光共聚焦下进行免疫荧光鉴定。
1.2.8 血管内皮细胞损伤模型的建立 取处于对数生长期的主动脉血管内皮细胞,以1×105/孔接种于96孔板,待细胞贴壁。设置对照组和ox-LDL(25、50、75、100 g/mL)组,各给药组加入相应溶液,对照组加入含10% FBS 的DMEM/F12培养基,分别培养6、12、24 h,加入CCK8试剂,于37 ℃、5% CO2恒温培养箱孵育40 min,采用酶标仪测定450 nm处的吸光度(A)值,计算细胞抑制率。
1.2.9 细胞活性氧(reactive oxygen species, ROS)检测药物抗损伤情况 细胞造膜和给药后,加入荧光探针H2DCF-DA(1∶1000)检测ROS浓度,培养40 min后,细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF,于荧光显微镜下拍照,采用Image J测定荧光值。
1.2.10 qPCR法检测相关mRNA表达 提取细胞总RNA,微量核酸蛋白检测仪检测RNA样品的浓度和纯度,再进行反转录得到cDNA,采用SYBR法進行实时PCR反应。反应体系(25 μL体系):SYBR
Green qPCR Mix 12.5 μL,10 μmol/L正反引物2.5 μL,cDNA 1 μL,nuclease-free water 6.5 μL。每个样品设3个孔,反应在实时定量PCR仪上进行。以GAPDH为内参基因,采用2-△△Ct法计算基因相对表达量。引物由武汉赛维尔生物科技有限公司合成,序列见表1。平行实验3次。
1.2.11 统计学分析 所有统计分析均使用SPSS 23.0软件进行,计量资料以“x±s”表示,组间比较若符合正态性且方差齐性时,采用单因素方差分析LSD法进行两两比较;方差不齐时,采用Tamhane's T2法进行两两比较。
2 结果
2.1 补阳还五汤靶点的获取
综合TCMSP、Herb数据库结果,获取黄芪活性成分31个,包括formononetin(芒柄花素)、hederagenin(蛇床子素)、isoflavanone(异黄酮)等;当归活性成分39个,包括beta-sitosterol(β谷甾醇)、stigmasterol(豆甾醇)、carvacrol(香芹酚)等;赤芍活性成分2个,包括baicalein(黄芩素)、ethyl oleate(油酸乙酯);川芎活性成分15个,包括myricanone(杨梅酮)、crysophanol(大黄酚)等;桃仁活性成分20个,包括beta-sitosterol(β谷甾醇)、campesterol(樟脑甾醇)、hederagenin(蛇床子素)等;红花活性成分14个,包括6-hydroxykaempferol(6-羟基山柰酚)、baicalein(黄芩素)、beta-carotene(β-胡萝卜素)等;地龙活性成分12个,包括palmitic acid(棕榈酸)、succinic acid(琥珀酸)、vanillin(香兰素)等。
综合PubChem、Swiss Target Prediction数据库结果,共获取赤芍153个靶点(剔除10个重复值)、川芎521个靶点(剔除804个重复值)、当归591个靶点(剔除1188个重复值)、黄芪504个靶点(剔除1196个重复值)、桃仁393个靶点(剔除539个重复值)、红花336个靶点(剔除664个重复值)、地龙281个靶点(剔除503个重复值),把这7味中药靶点进行综合匹对,去除重复靶点后得到972个作用靶点。
2.2 AS差异基因的获取
联合GSE19286、GSE2372芯片对其样本矩阵进行差异分析并以|log2FC|>1且P.adj<0.05为筛选条件绘制火山图(图1A),共筛选出173个DEGs,其中103个DEGs在AS组织样本中高表达(log2FC>1),70个DEGs在AS组织样本中低表达(log2FC>1)。根据|log2FC|排序绘制前40位差异基因热图以查看其在各样本中的表达情况(图1B,表2)。
2.3 氧化应激靶点的获取
GeneCards数据库共获取9438个氧化应激靶点,根据预测分数大小排序前10位氧化应激靶点依次为NOS3、NOS2、CPT2、NOS1、SOD1、CAT、AIFM1、TNF、TP53、NFE2L2。
2.4 补阳还五汤干预AS氧化应激潜在靶点韦恩图
取972个“中药靶点”、173个“AS差异基因”、9438个“氧化应激靶点”的交集绘制韦恩图,获取“AS潜在靶点”共24个,分别为CDK1、CCNB2、PGR、PLG、ALB、CHEK1、SELE、AMPD1、LGMN、PTGS2、MMP12、FABP1、LGALS4、CHRNA7、CCR9、DBF4、TTR、GRM5、TOP2A、GC、F2、PLK1、C3AR1、VCAM1(图2A)。
2.5 GO、KEGG富集化分析结果
“AS潜在靶点”共获取389条GO分析条目,包括328条生物过程(biological process, BP)条目、44条细胞组分(cellular component, CC)条目、17条分子功能(molecular function, MF)条目,KEGG分析共获取14条KEGG(通路)条目。结果显示,“AS潜在靶点”主要参与对β淀粉样蛋白的反应、核分裂核膜解体、膜解体等生物进程、富集于血液微粒、质膜筏、空泡腔等细胞组分,参与毒性物质结合、抗氧化活性、组蛋白激酶活性等分子功能(图2B)。KEGG结果显示,“AS潜在靶点”主要通过调控CDK1、CHEK1、PLK1、CCNB2、DBF4CDK1、CHEK1、PLK1、CCNB2、DBF4介导的细胞周期信号通路,CDK1、PGR、PLK1、CCNB2介导的卵母细胞成熟信号通路,CDK1、PGR、PLK1、CCNB2介导的卵母细胞减数分裂信号通路等信号通路发挥作用(图2C、图2D)。
2.6 PPI网络图的构建及拓扑分析
STRING数据库剔除2个无互作关系的靶点,分别为CCR9、AMPD1,保留22个AS潜在靶点的蛋白互作网络图(图3A)。
根据Degree算法对“AS潜在靶点”进行拓扑分析,鉴定出前5位“AS核心靶点”。根据Degree值排序前5位“AS核心靶点”依次为白蛋白(ALB)、纤溶酶原(PLG)、F2-异前列烷(F2)、Polo激酶1(PLK1)、糖皮质激素(GC)(图3B、表3),提示其可作为补阳还五汤干预AS氧化应激的核心靶点。
2.7 “AS核心靶点”统计学分析
差异分组比较图结果显示(图4),ALB、PLG、F2、GC在模型组中表达均低于正常组(P<0.01、P<0.001),PLK1在模型组中表达高于正常组(P<0.01),提示补阳还五汤可能可以通过上调ALB、PLG、F2、GC的表达、下调PLK1的表达起到干预AS氧化应激的作用。
2.8 大鼠主动脉内皮细胞鉴定
如图5所示,用免疫荧光法鉴定显示,细胞均表达内皮细胞特有的vWF蛋白。因此,证明所提取细胞为内皮细胞。
2.9 不同浓度ox-LDL对血管内皮细胞损伤的影响
与对照组比较,不同浓度ox-LDL(25、50、75、100 μg/mL)均可显著降低主动脉血管内皮细胞6、12、24 h 的活力(P<0.01),抑制细胞增殖,且以ox-LDL 50 μg/mL干预血管内皮细胞24 h作为细胞损伤的最佳条件。详见图6。
2.10 补阳还五汤对损伤细胞ROS表达的影响 与对照组比较,模型组荧光强度显著升高(P<0.01);与模型组比较,补阳还五汤组ROS降低(P<0.01)。详见图7。
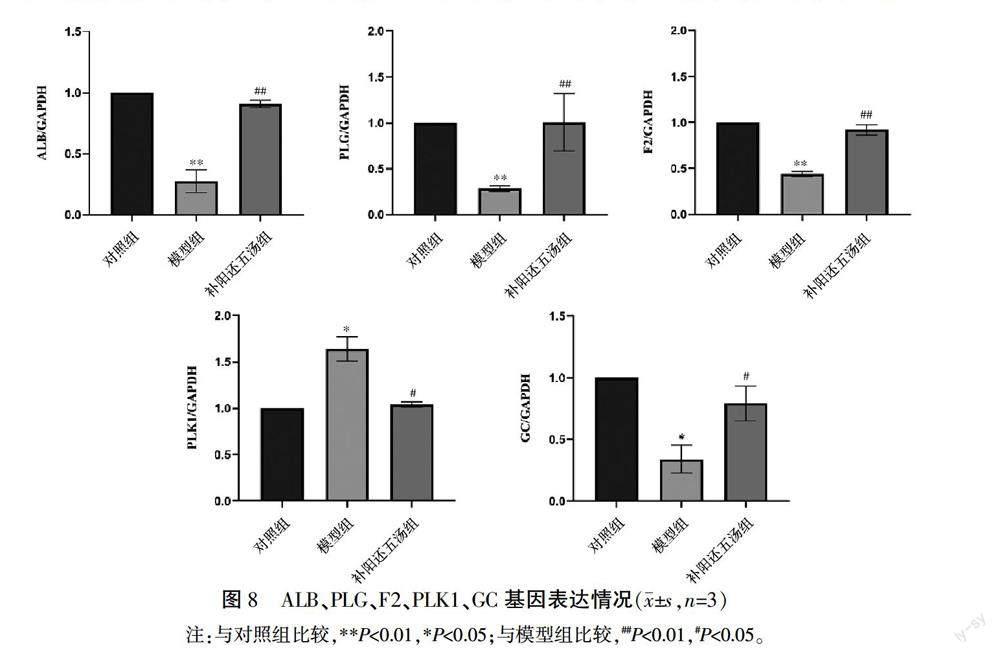
2.11 补阳还五汤对ALB、PLG、F2、PLK1、GC基因表达的影响
与对照组相比,模型组ALB、PLG、F2、GC mRNA表达明显降低(P<0.01,P<0.05),PLK1 mRNA表達明显升高(P<0.05)。与模型组比较,补阳还五汤组ALB、PLG、F2、GC mRNA表达水平增加,PLK1 mRNA表达水平降低(P<0.01,P<0.05)。详见图8。
3 讨论
在过去的几十年中,随着基因组学、转录组学、蛋白质组学等技术的发展,大量的芯片和测序数据为人类疾病研究提供了丰富的资源。我们利用GEO数据库下载GSE19286、GSE2372基因表达数据集,在AS样本和健康样本之间鉴别差异表达基因(DEGs)。共获得173个DEGs可能与AS的发生发展相关,其中上调基因103个、下调基因70个,可能成为AS的潜在治疗靶点。
根據《动脉粥样硬化中西医结合诊疗专家共识2021》,中医学认为AS的病机包括虚实两个方面:虚主要指气虚、血虚、阴虚、阳虚;实为瘀血、痰浊、毒邪、湿热。对于气虚血瘀证型,《素问·至真要大论》云:“疏其气血,令其调达,而致和平。”故当以益气活血法治之。补阳还五汤出自清代王清任《医林改错》,在大补其气的同时适量配伍活血之药,补气固本,活血治标,以达通开血道,气通血活。西医学认为AS的发病机制主要包括脂质浸润学说、内皮损伤-反应学说、血小板聚集和血栓形成假说、平滑肌细胞克隆学说等。而氧化应激是由自由基在体内产生的一种负面作用,与炎症紧密相连,参与疾病发展并加速AS病变。课题组前期研究发现,补阳还五汤具有抗AS炎症反应、抗脑缺血、抗血栓、抗血管内膜增生等作用[13-16]。体外实验结果显示,补阳还五汤可以减少ox-LDL损伤的血管内皮细胞中ROS的表达,可能通过干预血管内皮氧化损伤改善AS氧化应激,但BYHWD是如何协同多成分、多靶点、多途径干预AS氧化应激的,仍需进一步探讨。
通过将筛选出的972个中药活性成分靶点与AS疾病发生发展相关的173个DEGs和9438个氧化应激靶点取交集,共获得24个补阳还五汤干预AS氧化应激的潜在的共同靶点,即“AS核心靶点”。使用拓扑分析筛选出ALB、PLG、F2、PLK1、GC为前5位的“AS核心靶点”。其中,血浆中的ALB被证明是抵抗ROS的第一道防线,在抗氧化功能中起着关键作用[17];PLG属于纤溶系统成分之一,在病理状态下,PLG激活受阻,凝血-纤溶系统的平衡破坏,易导致血栓形成,在病理过程中随着炎性因子和ROS的产生,进而加重氧化应激损伤与炎症反应[18];同时有研究表明,F2的量化是评估体内氧化应激可靠的生物标志物之一[19];过氧化氢可能通过增加PLK1蛋白表达诱导PC12细胞氧化损伤[20];GC具有强大的免疫调节活性,可诱导T和B淋巴细胞凋亡的能力,通过线粒体途径诱导产生ROS介导氧化反应[21]。已有许多研究表明,ALB、PLG、F2、PLK1、GC均与氧化应激关系密切[22-26],而这5个靶点对于AS氧化应激的相关疾病发展的阐述与研究尚不足。补阳还五汤可能可以通过上调ALB、PLG、F2、GC基因表达,下调PLK1基因表达的作用机制干预血管内皮细胞氧化损伤,从而改善AS氧化应激,这也与本研究的网络预测结果相符,进一步提示补阳还五汤在AS氧化应激中的治疗潜力。
综上所述,本研究基于基因芯片数据库、网络药理学和实验验证,对补阳还五汤治疗AS氧化应激的作用机制进行预测,其机制可能与减少ROS表达,上调ALB、PLG、F2、GC基因、下调PLK1基因表达相关,为下一步深入开展机制研究提供了基础和方向。
参考文献
[1] 《中国心血管健康与疾病报告》编写组.《中国心血管健康与疾病报告2021》要点解读[J].中国心血管杂志,2022,27(4):305-318.
[2] 徐安莉,赵 敏,陈会敏,等. NF-κB/SREBPs信号通路在右归丸抗大鼠动脉粥样硬化中的调节作用[J].湖北中医药大学学报,2020,22(2):17-21.
[3] LIBBY P. The changing landscape of atherosclerosis[J]. Nature, 2021, 592(7855): 524-533.
[4] TEKTONIDOU M G. Cardiovascular disease risk in antiphospholipid syndrome: Thrombo-inflammation and atherothrombosis[J]. Journal of Autoimmunity, 2022, 128: 102813.
[5] 中国医师协会中西医结合分会心血管专业委员会,中华中医药学会心血管病分会.动脉粥样硬化中西医防治专家共识(2021年)[J]. 中国中西医结合杂志,2022,42(3):287-293.
[6] SHEN J, ZHU Y, HUANG K Y, et al. Buyang Huanwu Decoction attenuates H2O2-induced apoptosis by inhibiting reactive oxygen species-mediated mitochondrial dysfunction pathway in human umbilical vein endothelial cells[J]. BMC Complementary and Alternative Medicine, 2016, 16: 154.
[7] YANG K L, ZENG L T, GE A Q, et al. Exploring the oxidative stress mechanism of Buyang Huanwu Decoction in Intervention of Vascular Dementia Based on Systems Biology Strategy[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 8879060.
[8] KIM S, CHEN J, CHENG T J, et al. PubChem in 2021: New data content and improved web interfaces[J]. Nucleic Acids Research. 2021, 49(D1): D1388-D1395.
[9] GU Z G, EILS R, SCHLESNER M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data[J]. Bioinformatics, 2016, 32(18): 2847-2849.
[10] STELZER G, PLASCHKES I, OZ-LEVI D, et al. VarElect: The phenotype-based variation prioritizer of the GeneCards Suite[J]. BMC Genomics, 2016, 17(Suppl 2): 444.
[11] FU X Y, SUN Z J, LONG Q Y, et al. Glycosides from Buyang Huanwu Decoction inhibit atherosclerotic inflammation via JAK/STAT signaling pathway[J]. Phytomedicine, 2022, 105: 154385.
[12] 林翠红,刘光辉,杨田野,等.大鼠主动脉内皮细胞改良型分离培养方法[J].西安交通大学学报(医学版),2018,39(6):911-916.
[13] 傅馨莹,杨仁义,孙正骥,等.补阳还五汤苷类组分调控动脉粥样硬化炎性反应及脂质代谢的作用机制[J].中草药,2021,52(14):4221-4231.
[14] 欧明娥,唐利文,邓常清.补阳还五汤有效组分对血管内皮细胞抗血栓功能及蛋白激酶C的影响[J].中草药,2008,39(10):1514-1520.
[15] 唐映红,李 花,陈北阳,等.补阳还五汤有效部位对局灶性脑缺血再灌注后caspase表达的作用[J].中国中西医结合杂志,2006,(6):533-537.
[16] 张 伟,吴 露,陈北阳,等.补阳还五汤及有效组分对大鼠增生血管内膜细胞外基质蛋白表达的影响[J].中国病理生理杂志, 2010,26(1):169-173.
[17] CANDIANO G, PETRETTO A, BRUSCHI M, et al. The oxido-redox potential of albumin methodological approach and relevance to human diseases[J]. Journal of Proteomics, 2009,73(2):188-195.
[18] 张语澎,王 欢,薛文池,等.氧化应激-炎症-血栓之恶性交互网络研究新进展[J].沈阳药科大学学报,2021,38(9):983-994.
[19] LIU W, MORROW J D, YIN H. Quantification of F2-isoprostanes as a reliable index of oxidative stress in vivo using gas chromatography-mass spectrometry (GC-MS) method[J]. Free Radical Biology and Medicine, 2009, 47(8): 1101-1107.
[20] 薛淑燕,吴心兰,伍秋婵,等.过氧化氢对PC12细胞plk1基因表达的影响[J].广东药学院学报,2013,29(6):653-655.
[21] BJELAKOVI G, STOJANOVI I, JEVTOVI STOIMENOV T, et al. Metabolic correlations of glucocorticoids and polyamines in inflammation and apoptosis[J]. Amino Acids, 2010, 39(1): 29-43.
[22] TOYODA S, HARUYAMA A, INAMI S, et al. Effects of carvedilol vs bisoprolol on inflammation and oxidative stress in patients with chronic heart failure[J]. Journal of Cardiology, 2020, 75(2):140-147.
[23] INNICO G, GPBBI L, BERTOLDI G, et al. Oxidative stress, inflammation, and peritoneal dialysis: A molecular biology approach[J]. Artificial Organs, 2021, 45(10): 1202-1207.
[24] BLACK CN, BOT M, SCHEFFER PG, et al. Is depression associated with increased oxidative stress A systematic review and meta-analysis[J]. Psychoneuroendocrinology, 2015, 51: 164-175.
[25] ENWEASOR C, FLAYER CH, HACZKU A. Ozone-Induced oxidative stress, Neutrophilic airway Inflammation, and glucocorticoid resistance in asthma[J]. Frontiers in Immunology, 2021, 12: 631092.
[26] VOITURON Y, ROUSSEL D, LE GALLIARD J F, et al. Mitochondrial oxidative phosphorylation response overrides glucocorticoid-induced stress in a reptile[J]. Journal of Comparative Physiology. B, Biochemical, Systemic, and Environmental Physiology, 2022, 192(6): 765-774.
〔收稿日期〕2022-11-23
〔基金項目〕国家自然科学基金项目(82174218);湖南省自然科学杰出青年基金项目(2020JJ2024);湖南中医药大学中西结合一流学科开放基金项目(2020ZXYJH49)。
〔第一作者〕龙清吟,女,硕士研究生,研究方向:中西医防治心脑血管疾病。
〔通信作者〕*张 伟,男,博士,教授,博士研究生导师,E-mail:zhangwei1979@hnucm.edu.cn。

