Circ-CDYL通过miR-223-3p/PHF19轴调节多发性骨髓瘤对硼替佐米的敏感性*
周 燕,唐云龙△,刘佳琦,吴蕾蕾,孙乃同
1.南京医科大学盐城临床医学院/盐城市第三人民医院血液内科,江苏盐城 224000;2.南通大学医学院,江苏南通 226000
多发性骨髓瘤(MM)是临床上常见的血液系统恶性肿瘤[1]。硼替佐米(BTZ)是一种蛋白酶体抑制剂,作为常用的化疗药物之一,BTZ可以改善MM的预后和治疗,但由于机体内在和获得性化学抗性,其治疗效果受到很大影响[2-3]。因此,研究BTZ的耐药机制对耐药MM患者的治疗具有积极意义。环状RNA(CircRNA)是一类特殊的RNA分子,在人类癌症(包括MM)的发生和化学抗性中的重要作用,其通过调控肿瘤细胞对化疗药物的敏感性,从而影响化疗效果[4]。研究显示,Circ-CDYL是一种新发现的CircRNA,已被证实在MM组织和血浆标本中呈高表达,对MM具有良好的诊断和预后预测价值[5]。然而,目前尚不清楚Circ-CDYL是否与MM的耐药机制调节有关。研究显示,miR-223-3p在MM肿瘤细胞系中处于低表达状态,其参与MM细胞增殖和凋亡调控,并且与BTZ的敏感性相关[6-7]。此外,生物学信息学分析预测miR-223-3p很可能与CircRNA存在相互作用。有研究表明,PHD锌指蛋白19(PHF19)是miR-223-3p的下游靶基因之一,敲低PHF19可在体外和体内抑制肿瘤生长,其有望成为MM新型治疗靶点[8]。基于此,本研究主要探索Circ-CDYL的功能和Circ-CDYL/miR-223-3p/PHF19内源竞争性RNA网络在BTZ耐药中的调控作用,从而了解MM的耐药机制,为耐药MM患者新疗法的开发提供理论依据。
1 材料与方法
1.1血清标本收集 收集2018年10月至2021年10月于盐城市第三人民医院(以下简称本院)接受治疗的118例MM患者的血清标本。将未接受任何治疗的60例患者作为BTZ敏感组,接受BTZ治疗产生化疗耐药性的58例MM患者作为BTZ耐药组。排除接受其他类型治疗的MM患者。所有患者均签署知情同意书,本研究已获得本院伦理委员会批准(2021023)。
1.2细胞、主要试剂与仪器 亲本MM细胞系MM1.S细胞(货号:C1713)和耐BTZ细胞系MM1.R细胞(货号:C1811)均购自上海WHELAB。RPMI-1640购自武汉Procell(货号:PM150110);BTZ购自上海源叶(货号B34605),高效液相色谱法(HPLC)≥98%;LipofectamineTM3000转染试剂购自美国Invitrogen(货号:L3000015)。Beyozol总RNA抽提试剂购自上海Beyotime(货号:R0011);QuantiTect Reverse Transcription试剂盒(货号:DXT-205314)、QuantiTect SYBR®Green PCR Kit(货号:204145)购自美国Qiagen;CCK-8试剂盒(货号:CK04)和Annexin V-FITC/PI试剂盒(货号:AD10-2)均购自日本同仁化学;LucPairTMDuo-Luciferase HS Assay试剂盒购自美国GeneCopoeia(货号:LF005);PHF19、增殖细胞核抗原(PCNA)、Ki67、剪切化半胱氨酸天冬氨酸蛋白酶3(C-caspase 3)、GAPDH一抗及二抗均购自美国Cell Signaling Technology。构建稳定细胞系所用Circ-CDYL短发夹RNA(shRNA)的慢病毒载体(sh-Circ-CDYL)和含有阴性对照shRNA的慢病毒载体(sh-Circ-NC),以及miR-223-3p抑制剂(anti-miR-223-3p)、miR-223-3p模拟物(miR-223-3p mimics)、阴性对照(miR-NC)均购自GenePharma;pcDNA-PHF19重组慢病毒载体购自美国Invitrogen。
1.3方法
1.3.1细胞培养与转染 将MM1.S和MM1.R细胞接种于RPMI-1640培养基(含10%胎牛血清,100 U/L青霉素及100 mg/L链霉素),于饱和湿度培养箱(37 ℃,5% CO2)中培养。MM1.R细胞在转染前使用10 nmol/L BTZ处理24 h。根据转染情况将MM1.R细胞分为C组、sh-Circ-C组、sh-Circ-CDYL组、sh-Circ-CDYL+anti-miR-223-3p组和sh-Circ-CDYL+pcDNA-PHF19组。其中,C组未转染,sh-Circ-C组转染sh-Circ-NC慢病毒载体,sh-Circ-CDYL组转染sh-Circ-CDYL慢病毒载体,sh-Circ-CDYL+anti-miR-223-3p组转染sh-Circ-CDYL慢病毒载体及anti-miR-223-3p慢病毒载体,sh-Circ-CDYL+pcDNA-PHF19组转染sh-Circ-CDYL慢病毒载体及pcDNA-PHF19重组慢病毒载体。细胞培养48 h后用于后续研究,使用荧光定量PCR(RT-qPCR)和免疫印迹法(Western blotting)检测转染效率。
1.3.2RT-qPCR检测 根据试剂盒说明书要求提取总RNA,并进行纯化,然后通过QuantiTect Reverse Transcription试剂盒合成cDNA。以GAPDH为内参,使用QuantiTect SYBR®Green PCR试剂盒通过特异性引物和cDNA进行PCR扩增,引物序列见表1。反应条件:90 ℃预变性2 min,94 ℃变性15 s,65 ℃退火30 s,70 ℃延伸30 s,连续循环40次。然后,通过2-ΔΔCt法进行相对表达水平计算。

表1 引物序列
1.3.3蛋白质检测 5组细胞经磷酸盐缓冲液(PBS)冲洗3次,加入细胞裂解液(含蛋白酶抑制剂)提取总蛋白,将待测蛋白上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE,10%)电泳,电泳分离后转移至PVDF膜,以5%脱脂牛奶封闭,取膜,清洗,加入PHF19、PCNA、Ki67、C-caspase 3一抗(稀释倍数1∶400)4 ℃孵育过夜,加入辣根过氧化物酶标记的二抗室温孵育1 h后,TBST洗涤3次,最后滴加ECL发光液曝光显影,检测蛋白质条带。以GAPDH为内参,采用Image J软件分析各条带灰度值,计算蛋白相对表达量。
1.3.4细胞活力测定 采用不同浓度的BTZ(0、1、5、10、20、40、80、160 nmol/L)对5组细胞处理24 h,添加10 mL的CCK-8试剂处理120 min,于490 nm波长下检测上清吸光度(A)值。当细胞活力降低为50%时的BTZ浓度即为BTZ的半数抑制浓度(IC50)。
1.3.5克隆形成实验 将不同处理的MM1.R细胞以500个/孔的密度接种于六孔板,饱和湿度培养箱(37 ℃,5% CO2)中培养2周。使用结晶紫对细胞进行染色后对细胞克隆进行计数。
1.3.6细胞凋亡测定 采用Annexin V-FITC染色观察细胞凋亡情况。收集5组细胞,PBS洗涤3次,采用1×Binding buffer将待测细胞制成1×106/mL的细胞悬液,接着加入Annexin V-FITC,避光、室温孵育10 min,加入PI染色液(10 μL)进行染色,大约15 min后采用流式细胞仪检测细胞凋亡情况。
1.3.7双荧光素酶报告基因实验 通过生物信息学网站StarBase(https://starbase.sysu.edu.cn)和TargetScan(https://www.targetscan.org/vert_80/)预测miR-223-3p、circ-CDYL或PHF19的结合。按照转染试剂TurboFect Transfection Regent说明书将anti-miR-223-3p野生型(WT)或突变型(MUT)荧光素酶报告基因质粒载体单独转入细胞中,或同时添加circ-CDYL、PHF 19 mimic转入MM1.R细胞,获得circ-CDYL-野生型/突变型(WT/MUT)细胞及PHF 19-WT/MUT细胞,培养48 h后移去培养液。采用PBS洗涤细胞,弃去洗涤液后,每孔中加入1×细胞裂解液,振荡10 min,3 000 r/min离心5 min,按照双荧光素酶报告基因检测试剂盒说明书检测上清荧光素酶活性。
2 结 果
2.1Circ-CDYL、miR-223-3p和PHF19在不同血清标本和细胞中的表达情况 与BTZ敏感组比较,BTZ耐药组Circ-CDYL和PHF19 mRNA表达明显升高,miR-223-3p表达明显降低,差异均有统计学意义(P<0.05),见表2。与MM1.S细胞比较,MM1.R细胞Circ-CDYL和PHF19 mRNA表达明显升高,miR-223-3p表达明显降低,差异均有统计学意义(P<0.05),见表3。
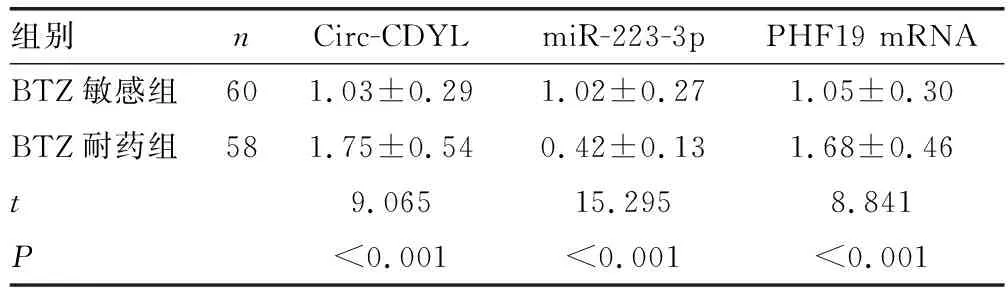
表2 Circ-CDYL、miR-223-3p和PHF19 mRNA在不同血清标本中的表达

表3 Circ-CDYL、miR-223-3p和PHF19 mRNA在不同细胞中的表达情况
2.2各组MM1.R细胞转染效率 与转染sh-Circ-C的细胞相比,转染sh-Circ-CDYL的MM1.R细胞Circ-CDYL和PHF19 mRNA表达水平明显降低,miR-223-3p表达明显升高,差异均有统计学意义(P<0.05);与sh-Circ-CDYL组比较,sh-Circ-CDYL+anti-miR-223-3p组、sh-Circ-CDYL+pcDNA-PHF19组PHF19 mRNA表达水平均明显降低(P<0.05),sh-Circ-CDYL+anti-miR-223-3p组miR-223-3p表达明显下调(P<0.05)。见表4。

表4 各组MM1.R细胞Circ-CDYL、miR-223-3p和PHF19表达
2.3MM1.R细胞的增殖、凋亡及蛋白表达情况 与sh-Circ-NC组比较,sh-Circ-CDYL组中MM1.R细胞对BTZ的IC50、集落形成数量均明显降低,细胞凋亡率明显升高,差异均有统计学意义(P<0.05);细胞凋亡蛋白PCNA、Ki67的蛋白表达水平均下调,C-caspase 3蛋白表达水平上调,差异均有统计学意义(P<0.05)。与sh-Circ-CDYL组比较,sh-Circ-CDYL+anti-miR-223-3p组或sh-Circ-CDYL+pcDNA-PHF19组中MM1.R细胞对BTZ的IC50、集落形成数量均明显增加,细胞凋亡率降低,差异均有统计学意义(P<0.05);细胞PCNA、Ki67蛋白水平均上调,C-caspase 3蛋白水平下调,差异均有统计学意义(P<0.05),见图1、2和表5。结果表明敲低Circ-CDYL可提高MM1.R细胞对BTZ的敏感性。

图1 克隆形成实验检测各组MM1.R细胞增殖情况
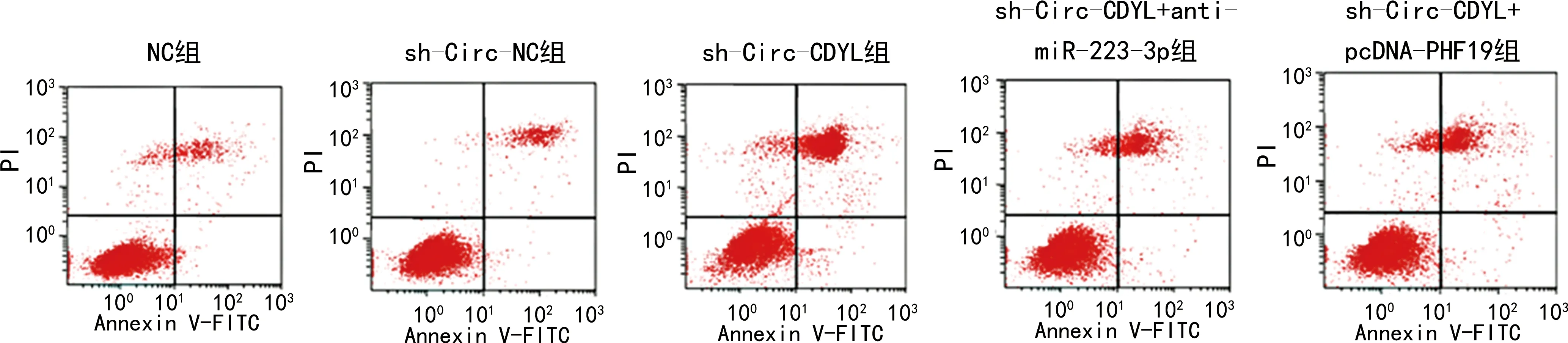
图2 流式细胞术检测各组MM1.R细胞凋亡
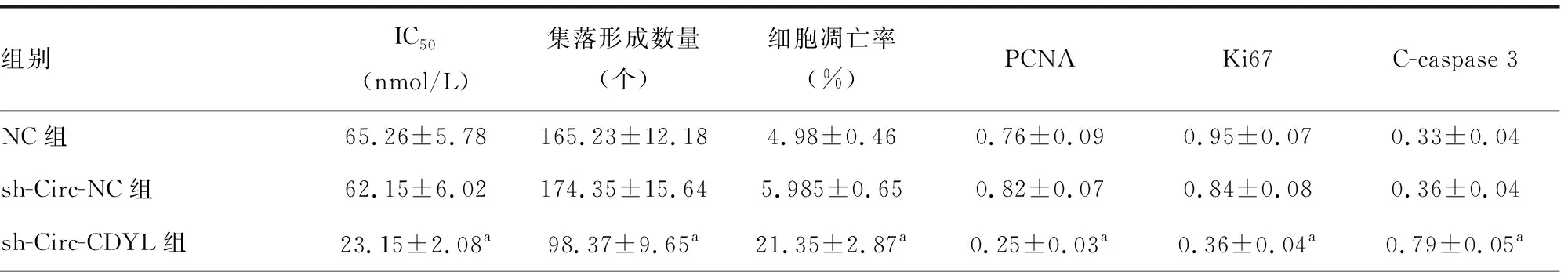
表5 各组MM1.R细胞IC50、细胞增殖和凋亡能力检测
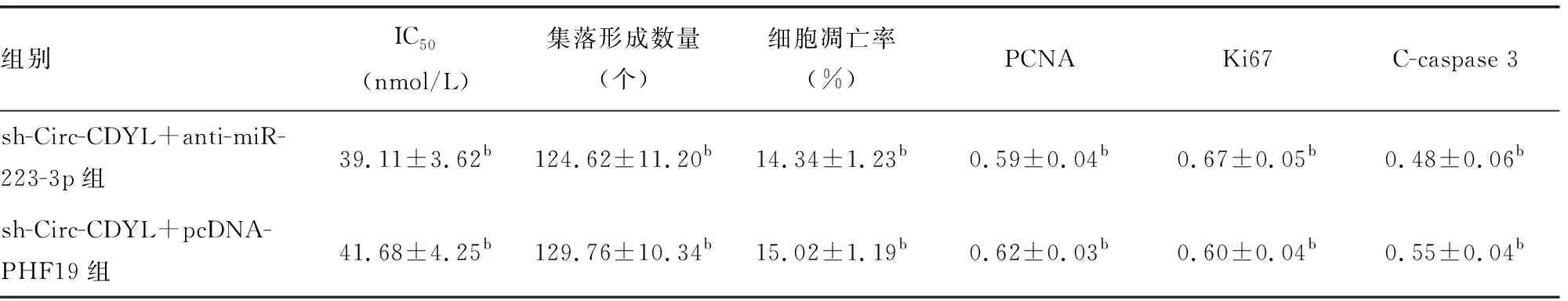
续表5 各组MM1.R细胞IC50、细胞增殖和凋亡能力检测
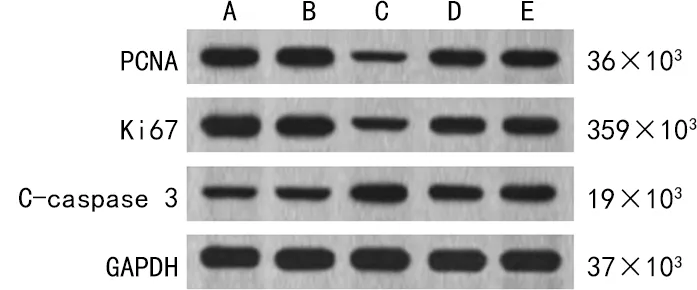
注:A-E依次代表NC组、sh-Circ-NC组、sh-Circ-CDYL组、sh-Circ-CDYL+anti-miR-223-3p组和sh-Circ-CDYL+pcDNA-PHF19组。
2.4miR-223-3p与Circ-CDYL或PHF19相互作用分析 生物信息学分析网站预测结果显示:在Circ-CDYL或PHF19中存在miR-223-3p的互补作用位点(图4)。MM1.R细胞的双荧光素酶报告基因实验结果显示,相对于miR-NC的转染,miR-223-3p mimics转染明显抑制Circ-CDYL-WT或PHF19-WT质粒中的荧光素酶活性(P<0.05),但对Circ-CDYL-MUT或PHF19-MUT质粒中的荧光素酶活性变化无影响(P>0.05),见表6。结果表明miR-223-3p可抑制Circ-CDYL、PHF19的表达。
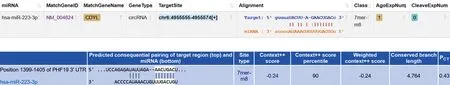
图4 生物信息学分析网站预测miR-223-3p可与Circ-CDYL或PHF19结合

表6 双荧光素酶报告基因实验结果
3 讨 论
肿瘤复发、转移和化疗耐药性是导致MM预后差的重要因素[10]。BTZ是MM的一线化疗药物,BTZ耐药是导致MM化疗失败的常见原因[11]。因此,寻找新的靶点和了解BTZ耐药的分子机制对于MM的治疗极为重要。
CircRNA因其闭环结构而具有RNA酶消化抗性,在真核细胞中呈高表达,具有良好的稳定性,可作为癌症生物标志物[4-5]。研究发现,多种CircRNA可作为MM耐药性的调节因子,例如,circPSAP可调控海绵调节组蛋白乙酰化酶4的表达,进而影响MM细胞增殖、凋亡和BTZ敏感性[7]。
Circ-CDYL又称circ0075517,在肿瘤发生和恶性发展中具有多种功能。研究显示,Circ-CDYL在肝细胞癌组织中表达上调,与肝癌患者的预后不良显著相关[12-13]。Circ-CDYL已被证明可通过抑制miR-1180,削弱其对yes相关蛋白的抑制,最终导致MM不受控制[5]。然而,关于Circ-CDYL与MM耐药的相关性尚鲜见报道。本研究结果证实,Circ-CDYL在耐BTZ MM患者血清和MM1.R细胞(耐BTZ细胞系)中高表达,提示Circ-CDYL的高表达可能与MM对BTZ的敏感性有关,进一步研究显示,敲低Circ-CDYL可明显下调MM1.R细胞对BTZ的IC50,同时抑制细胞增殖,诱导细胞凋亡。本研究结果表明,敲低Circ-CDYL可显著提高MM1.R细胞对BTZ的敏感性。
本研究通过生物信息学分析网站预测了miR-223-3p在Circ-CDYL序列中的结合位点,并验证了Circ-CDYL与miR-223-3p之间的分子结合。此外,本研究发现,抑制miR-223-3p可部分逆转敲低Circ-CDYL的MM1.R细胞对BTZ敏感性(P<0.05)。CircRNA可作为miRNA的海绵参与调节各种生物行为,例如,circ-ATP10A作为miR-6758-3p、miR-3977等多个miRNA的海绵,调控其下游mRNA,进而促进MM的血管生成[4]。此外,circRNA-102231通过靶向结肠癌HT-29细胞miR-145,上调ABCB1,进而降低顺铂敏感性[14]。以上研究提示,Circ-CDYL可能作为miR-223-3p的海绵,进而调节MM细胞的BTZ抗性。PHF19已被证明是miR-223-3p的下游靶标,据报道,PHF19是一种表观遗传调控因子,PHF19过表达与晚期和侵袭性MM疾病阶段显著相关[15]。PHF19过表达与MM患者较差的生存率显著相关[8]。本研究结果表明,PHF19在耐BTZ MM患者血清和MM1.R细胞中呈高表达,Circ-CDYL可通过海绵化miR-152-3p来调控PHF19的表达水平,并且PHF19过表达可部分抵消Circ-CDYL敲低引起的MM1.R细胞BTZ敏感性降低趋势。多种CircRNA/miRNA/mRNA轴均参与了MM的BTZ抗性调控,如CircRERE通过海绵吸收miR-152-3p以调节CD47的表达,进而诱导癌变和激发BTZ抗性[16]。因此,推测miR-223-3p/PHF19轴可能是Circ-CDYL调节MM的BTZ敏感性的原因之一。
本研究结果显示,Circ-CDYL通过靶向miR-223-3p/PHF19轴进而调节MM的BTZ敏感性,提示下调Circ-CDYL可能是克服MM患者BTZ耐药的治疗策略。但本研究结果为临床及体外细胞水平的探索,随后将构建Circ-CDYL敲除动物模型,探索Circ-CDYL在体内是否具有同等的作用机制,以便进一步明确Circ-CDYL在MM化疗耐药中的作用机制。

