鹰嘴豆芽素A对LPS诱导的肺泡上皮细胞氧化应激损伤的影响*
唐敏强,黄 婕,陈佳娣
南通市海门区人民医院/南通大学附属海门医院呼吸与危重医学科,江苏南通 226100
急性肺损伤(ALI)是肺部炎症性综合反应,其病理特征为严重的动脉低氧血症、肺水肿和肺内中性粒细胞聚集,严重的ALI患者可转为急性呼吸窘迫综合征(ARDS),ALI/ARDS是导致急性呼吸衰竭的主要原因[1]。ALI的病理生理基础包括免疫细胞过度激活、氧化应激、炎症等,其发病率和死亡率均较高,严重威胁着人们的生命健康安全[2]。尽管目前对于ALI/ARDS的发生发展机制及治疗方法研究有明显的进展,但治疗带来的不良反应严重降低了患者的生存质量[3]。因此,积极深入探索ALI/ARDS的发病机制至关重要。鹰嘴豆芽素A(BCA)是从鹰嘴豆中提取出的异黄酮的主要成分,具有抗肿瘤、抗炎、抗氧化、抗菌和神经保护等多种生物学活性[4],其可通过抑制TLR4/NF-κB信号通路进而抑制炎症反应,缓解脂多糖(LPS)诱导的小鼠ALI[5]。核因子E2相关因子2(Nrf2)/血红素加氧酶1(HO-1)是调节氧化应激的重要通路,山姜素可通过激活PI3K/Nrf2/HO-1信号通路,减少炎症和氧化应激反应来改善穿刺诱导的脓毒症大鼠的ALI[6]。但BCA通过调节Nrf2/HO-1信号通路对LPS诱导肺泡上皮细胞氧化应激损伤的影响尚不清楚。本研究旨在探讨BCA对LPS诱导肺泡上皮细胞氧化应激损伤的影响及其可能的作用机制。
1 材料与方法
1.1材料 人肺泡上皮细胞BEAS-2B购自上海碧云天生物技术有限公司。BCA(纯度:HPLC≥98%,货号:PB3024)购自北京普非生物科技有限公司;LPS(货号:YT1319)购自北京伊塔生物科技有限公司;Nrf2的抑制剂ML385(货号:S86700)购自上海源叶生物科技有限公司;DCFH-DA活性氧ROS荧光探针(货号:D6470)、SOD活性检测试剂盒(货号:BC0170)、MDA水平检测试剂盒(货号:BC0020)、IL-6的ELISA试剂盒(货号:SEKR-0013)、TNF-α的ELISA试剂盒(货号:SEKR-0047)均购自北京索莱宝科技有限公司;兔源一抗Nrf2(货号:ab137500)、HO-1(货号:ab13248)、PCNA(货号:ab265585)、Bcl-2相关X蛋白(Bax)(货号:ab53154)、caspase-3(货号:ab4051)、cleaved caspase-3(货号:ab2302)以及辣根过氧化物酶(HRP)标记的羊抗兔二抗(货号:ab288151)均购自美国Abcam公司。
1.2细胞培养 将BEAS-2B细胞置于含10%胎牛血清、100 U/mL青-链霉素的RPMI 1640培养基中,在37 °C、5% CO2的稳定环境下常规培养,定期观察,每1~2天更换一次培养基,当细胞融合度达到85%以上时,消化、传代培养,收集对数期的细胞进行实验。
1.3LPS诱导与分组 将对数生长期的BEAS-2B细胞分为ctrl组、LPS组、BCA低剂量组、BCA中剂量组、BCA高剂量组、抑制剂组,除ctrl组外,其余各组细胞给予10 μg/mL[7]的LPS刺激24 h,BCA低、中、高剂量组分别采用5、10、20 μmol/L[8]的BCA处理,抑制剂组[9]采用20 μmol/L BCA和5 μmol/L的Nrf2的抑制剂ML385共同处理。
1.4CCK-8法检测细胞增殖 各组细胞以1×104个/孔接种到96孔板中。分别将细胞培养24、48、72 h,弃去细胞上清液,在指定的时间点向每个孔中加入含有10 μL CCK-8溶液的100 μL完全培养基。孵育2 h后,使用酶标仪检测其在450 nm处的吸光度(A450)。
1.5流式细胞仪检测细胞凋亡 收集处理48 h的各组BEAS-2B细胞,以预冷的PBS洗涤2次,添加100 μL结合缓冲液悬浮各组BEAS-2B细胞,再分别添加Annexin V-FITC和碘化丙啶(PI)染液5 μL,充分混匀,与室温下避光染色15 min,使用流式细胞仪检测细胞凋亡情况。
1.6荧光探针法检测细胞内ROS水平 收集各组细胞,按照说明书以活性氧荧光探针(DCFH-DA)重悬细胞,37 ℃下孵育25 min后,以对照组的荧光强度为阈值,在流式细胞仪上检测各组荧光强度。
1.7试剂盒检测细胞上清液中SOD活性、MDA及TNF-α、IL-6水平 收集各组细胞上清液,按照SOD、MDA、TNF-α、IL-6试剂盒说明书检测SOD活性、MDA及TNF-α、IL-6水平。
1.8免疫印迹法(Western blotting)检测蛋白表达 利用RIPA裂解缓冲液提取BEAS-2B细胞总蛋白。采用电泳分离蛋白,100 V恒压转移蛋白至PVDF膜上,用5%的脱脂牛奶封闭2 h,将膜与一抗Nrf2、HO-1、PCNA、Bax、caspase-3、cleaved caspase-3、GAPDH在4 ℃孵育过夜,再将膜与HRP偶联的羊抗兔二抗在室温下孵育2 h,弃去液体,洗涤3次,加入ECL试剂显影,采用Image J软件评估蛋白的灰度值。
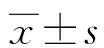
2 结 果
2.1各组BEAS-2B细胞增殖能力比较 与ctrl组比较,LPS组BEAS-2B细胞的A450降低(P<0.05);与LPS组比较,BCA低、中、高剂量组BEAS-2B细胞的A450升高(P<0.05);与BCA高剂量组比较,抑制剂组BEAS-2B细胞的A450降低(P<0.05)。见表1。
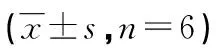
表1 各组BEAS-2B细胞A450比较
2.2各组细胞凋亡情况比较 各组细胞凋亡率如下:ctrl组(5.64±2.13)%、LPS组(38.47±3.24)%、BCA低剂量组(31.72±3.12)%、BCA中剂量组(24.53±2.21)%、BCA高剂量组(11.86±2.15)%、抑制剂组(27.35±2.23)%。与ctrl组比较,LPS组BEAS-2B细胞的凋亡率升高(P<0.05);与LPS组比较,BCA低、中、高剂量组BEAS-2B细胞的凋亡率降低(P<0.05);与BCA高剂量组比较,抑制剂组BEAS-2B细胞的凋亡率升高(P<0.05)。
2.3各组细胞氧化损伤情况比较 与ctrl组比较,LPS组BEAS-2B细胞ROS、MDA水平升高,SOD活性减弱(P<0.05);与LPS组比较,BCA低、中、高剂量组BEAS-2B细胞ROS、MDA水平明显降低,SOD活性显著增强(P<0.05);与BCA高剂量组比较,抑制剂组细胞ROS、MDA水平升高,SOD活性减弱(P<0.05)。见表3。
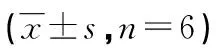
表3 各组BEAS-2B细胞ROS、SOD活性及MDA水平情况比较
2.4各组BEAS-2B细胞上清液TNF-α、IL-6水平比较 与ctrl组比较,LPS组BEAS-2B细胞的TNF-α、IL-6表达水平明显升高(P<0.05);与LPS组比较,BCA低、中、高剂量组BEAS-2B细胞的TNF-α、IL-6表达显著降低(P<0.05);与BCA高剂量组比较,抑制剂组BEAS-2B细胞的TNF-α、IL-6表达水平升高(P<0.05)。见表4。
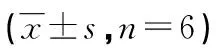
表4 各组BEAS-2B细胞上清液TNF-α、IL-6比较
2.5各组细胞蛋白表达水平比较 与ctrl组比较,LPS组BEAS-2B细胞的Nrf2、HO-1、PCNA表达水平明显降低(P<0.05),Bax、cleaved caspase-3/caspase-3表达明显升高(P<0.05);与LPS组比较,BCA低、中、高剂量组BEAS-2B细胞的Nrf2、HO-1、PCNA表达水平显著升高(P<0.05),Bax、cleaved caspase-3/caspase-3表达水平明显降低(P<0.05);与BCA高剂量组比较,抑制剂组BEAS-2B细胞的Nrf2、HO-1、PCNA表达水平降低(P<0.05),Bax、cleaved caspase-3/caspase-3表达水平升高(P<0.05)。见图1和表5。
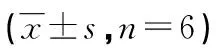
表5 各组BEAS-2B细胞蛋白表达水平比较
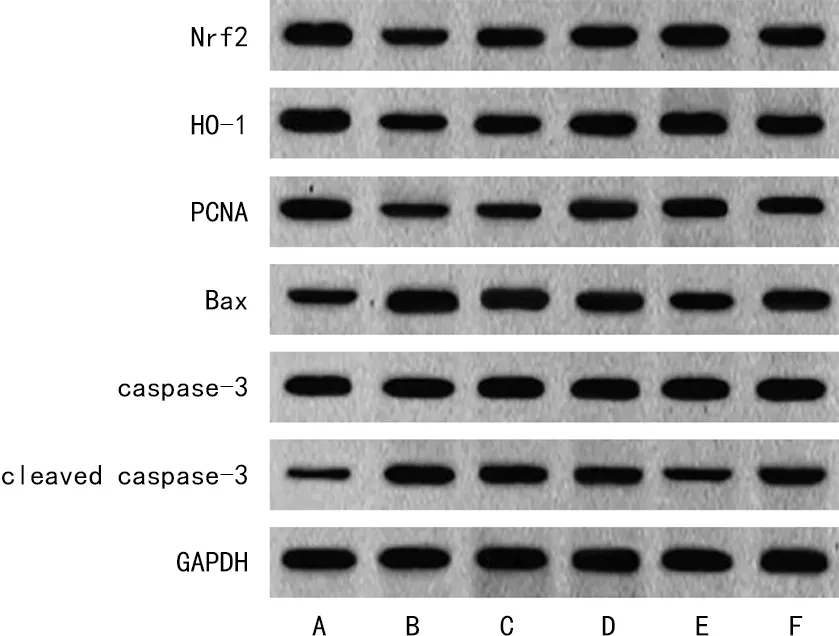
注:A为ctrl组;B为LPS组;C为BCA低剂量组;D为BCA中剂量组;E为BCA高剂量组;F为抑制剂组。
3 讨 论
ALI/ARDS是由非心源性的因素引起的弥漫性的肺损伤,其是导致重症监护室中急性呼吸衰竭的主要原因[10]。虽然近年来在呼吸生理学方面的研究进展较快,但治疗带来的过敏反应、呼吸机相关性肺损伤等不良反应和局限性,使患者的生存率和生活质量仍得不到显著提高[11]。因此,探寻新方法治疗ALI/ARDS具有重要的临床意义。肺泡上皮细胞在发生肺组织损伤时,能够参与到肺组织修复过程中,具有屏障保护作用[12],LPS是革兰阴性细菌细胞外壁的成分之一,内毒素所引起的ALI较难以控制,其所导致的ARDS是常见的肺部炎症综合征[13]。本研究通过10 μg/mL的LPS刺激BEAS-2B细胞,结果发现,与ctrl组比较,LPS组BEAS-2B细胞的A450、PCNA表达明显降低,细胞凋亡率、TNF-α、IL-6、Bax、cleaved caspase-3/caspase-3表达明显上升,提示LPS诱导可抑制肺泡上皮细胞增殖,促进其凋亡和炎症反应。氧化应激是在机体受到有害刺激时,体内高活性分子如ROS等产生过多,引起脂质过氧化,氧化系统和抗氧化系统失衡,从而导致细胞损伤,引起呼吸系统疾病[14]。SOD是细胞内的抗氧化酶,可反映机体抗氧化损伤能力,而MDA是脂质过氧化产物,反映了ROS引起的破坏[15]。本研究发现,与ctrl组比较,LPS组BEAS-2B细胞的SOD活性明显降低,ROS和MDA水平显著上升,提示LPS诱导可引起肺泡上皮细胞的氧化应激损伤。
BCA别名鸡豆黄素A,主要是从鹰嘴豆中提取出来的一种植物雌激素,属黄酮类化合物,其具有抗炎、抗肿瘤、抗病毒等活性,还是天然的抗氧化剂[16]。有研究表明,BCA可逆转异氟醚诱导的人神经母细胞瘤细胞SOD活性降低和MDA水平升高,增强细胞活力,抑制细胞凋亡,保护细胞免受异氟醚诱导的神经毒性[17]。本研究发现,与LPS组比较,BCA低、中、高剂量组BEAS-2B细胞的A450、SOD活性、PCNA表达明显升高,细胞凋亡率、ROS和MDA水平、TNF-α、IL-6、Bax、cleaved caspase-3/caspase-3表达明显降低,提示BCA可增强LPS诱导的BEAS-2B细胞增殖能力,抑制其凋亡能力、炎症反应和氧化应激。
Nrf2/HO-1信号通路存在于哺乳动物细胞中,并参与调节细胞增殖、凋亡等,其还能调控炎症反应和氧化应激[18-19]。相关研究表明,丙内酯可通过激活Nrf2/HO-1信号通路抑制人支气管上皮细胞炎症因子TNF-α、IL-6、IL-1β表达,抑制细胞凋亡和氧化应激[20]。本研究发现,与ctrl组比较,LPS组Nrf2、HO-1表达明显降低,提示Nrf2/HO-1信号通路可能参与了LPS诱导的肺泡上皮细胞的氧化应激损伤。与LPS组比较,BCA低、中、高剂量组Nrf2、HO-1表达升高,推测BCA可能通过激活Nrf2/HO-1途径抑制氧化应激损伤。为了验证该推测,本研究利用Nrf2的抑制剂ML385进行干预,结果发现,与BCA高剂量组比较,抑制剂组BEAS-2B细胞A450、SOD活性、Nrf2、HO-1、PCNA表达明显降低,细胞凋亡率、ROS和MDA水平、TNF-α、IL-6、Bax、cleaved caspase-3/caspase-3表达明显上升,表明Nrf2的抑制剂ML385减弱了BCA对BEAS-2B细胞增殖的促进作用,增强了细胞凋亡能力、炎症反应和氧化应激,提示BCA可以通过激活Nrf2/HO-1信号通路抑制BEAS-2B细胞氧化应激损伤。
综上所述,BCA可通过激活Nrf2/HO-1信号通路抑制LPS诱导的肺泡上皮细胞的氧化应激损伤。该研究为开发新的治疗ALI的药物提供了理论基础。然而,本研究尚存在一定不足之处,仅仅在细胞水平上验证了BCA调控Nrf2/HO-1途径对BEAS-2B细胞增殖、凋亡、炎症和氧化应激反应的影响,后续将考虑在体内水平上进行进一步探索。

