缺血性脑卒中患者外周血抗磷脂抗体、miR-125a-3p的检测及临床意义*
崔 佳,赵海利,仇 鹏,贾 敏,默海霞
河北省人民医院检验科,河北石家庄 050051
急性缺血性卒中(CIS)是由脑供血不足使脑组织局部缺血缺氧引发的一系列神经功能障碍症状,为神经内科常见病,致残、致死率较高,近年来随人口老龄化加剧其发生率逐渐增加,已成为中老年人群残疾的主要原因,给家庭及社会带来沉重负担[1-2]。早期及时准确评估CIS病情,予以针对性治疗措施减轻脑损伤,对提高疗效、改善预后至关重要。近年研究指出,血生化指标在诊断、评估病情、预测预后中具有重要作用,通过检测相关血清指标变化不仅能评估病情,还可对预后进行预测[3]。微小RNA(miRNA)为一类非编码小分子核糖核酸,可通过调控基因表达参与CIS的发生发展,miR-125a-3p被指出可参与颈动脉粥样硬化斑块形成,并与斑块性质有关,可作为心脑血管疾病的预警指标[4]。抗磷脂抗体(aPLs)属于异质性抗体,近年来发现其与CIS有一定关系,有望作为CIS不良预后的预测因子[5]。但临床关于miR-125a-3p、aPLs与CIS神经功能缺损程度及预后的相关性研究较少。基于此,本课题组研究了miR-125a-3p、aPLs与CIS神经功能缺损程度的相关性,并分析各指标评估患者预后的临床意义,现报道如下。
1 资料与方法
1.1一般资料 本研究经本院医学伦理委员会审核通过。选取2018年1月至2021年12月本院收治的297例CIS患者为观察组,同期200例体检健康者为对照组。观察组男187例,女110例;年龄48~77岁,平均(62.41±5.98)岁;体重指数18.4~27.9 kg/m2,平均(23.54±1.52)kg/m2。对照组男119例,女81例;年龄45~73岁,平均(60.29±5.27)岁;体重指数18.4~27.9 kg/m2,平均(23.54±1.52)kg/m2。两组性别、年龄、体重指数比较,差异均无统计学意义(P>0.05)。纳入标准:观察组均符合CIS诊断标准[6];均为首次患病。排除标准:既往脑部创伤史、手术史;合并代谢性疾病、自身免疫性疾病;存在精神异常、认知障碍;存在重要脏器功能障碍;存在血液系统疾病;严重感染性疾病;伴恶性肿瘤。所有受试者及家属知晓本研究,已签署同意书。
1.2方法
1.2.1资料收集 收集患者入院时一般资料,包括年龄、性别、吸烟史、体重指数、饮酒史、基础疾病(糖尿病、高血压、冠心病)、美国国立卫生研究院卒中量表(NIHSS)评分、收缩压(SBP)、舒张压(DBP)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。SBP、DBP采用标准水银柱血压测量仪测定,TC、TG、LDL-C、HDL-C采用全自动生化分析仪(贝克曼库尔特,IMMAGE800)测定。
1.2.2外周血aPLs、miR-125a-3p检测 观察组在入院时(治疗前)、对照组在体检时收集外周静脉血约6 mL,离心(转速3 000 r/min、时间10 min、离心半径10 cm),分离血清,均分为2份,其中一份血清采用酶联免疫吸附试验测定抗心磷脂抗体(IgG-aCL)、抗磷脂酰丝氨酸抗体(IgG-aPS)、抗β2糖蛋白-1抗体(IgG-β)水平,试剂盒购自上海酶联生物公司,若IgG-aCL≥11 GPS或IgG-aCL>20 GPL或IgG-β>20 SGU则判定aPLs为阳性;另一份血清采用RNA提取试剂盒(北京索莱宝公司)提取总RNA,以逆转录试剂盒(美国Promega公司)实施逆转录,以实时荧光定量PCR(RT-qPCR)测定血清miR-125a-3p水平,PCR试剂盒购自德国Qiagen公司。采用2-ΔΔCt计算miR-125a-3p的相对表达水平。miR-125a-3p的正向引物为5′-ATCTGACACAGGTGAGGTTCTTG-3′,反向引物为5′-TATGGTTTGACGACTGTGTGAT-3′,内参U6的正向引物为5′-ATTGGAACGATACAGAGAAGATT-3′,反向引物为5′-TATGGTTTGACGACTGTGTGTGAT-3′。
1.2.3观察组病情评估、治疗及预后评估 神经功能缺损程度以NIHSS评分[7]评估,总分0~42分,轻度为<4分,中度为4~15分,重度为>15分;治疗参照《中国急性缺血性脑卒中诊治指南2018》[6]予以静脉溶栓、吸氧、营养神经、维持水电解质平衡等对症治疗。观察组治疗后随访3个月,以Rankin修订量表评分(mRS)[8]评估预后情况,mRS≤2分为预后良好,>2分为预后不良。
1.3观察指标 (1)比较两组miR-125a-3p水平及aPLs阳性率。(2)比较不同神经功能缺损程度患者miR-125a-3p水平及aPLs阳性率。(3)比较不同预后患者一般资料、miR-125a-3p水平、aPLs阳性率。
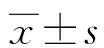
2 结 果
2.1两组miR-125a-3p水平及aPLs阳性率 观察组血清miR-125a-3p水平、aPLs阳性率较对照组高(P<0.05),见表1。
2.2不同神经功能缺损程度患者miR-125a-3p水平及aPLs阳性率 结果显示,随着神经功能缺损程度增加,miR-125a-3p水平、aPLs阳性率逐渐增加(P<0.05),见表2。

表1 两组miR-125a-3p水平及aPLs阳性率比较或n(%)]
2.3不同预后患者一般资料及miR-125a-3p水平、aPLs阳性率 不同预后患者年龄、性别、体重指数、吸烟史、饮酒史、基础疾病、LDL-C、HDL-C、SBP、DBP比较,差异无统计学意义(P>0.05),预后不良患者TC、TG、NIHSS评分、miR-125a-3p、aPLs阳性率较预后良好患者高(P<0.05),见表3。
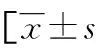
表2 不同神经功能缺损程度患者miR-125a-3p水平及aPLs阳性率或n(%)]
2.4CIS患者预后不良危险因素的Logistic回归分析 以单因素分析中有差异的变量作为自变量进行多因素Logistic回归分析,将TC、TG、NIHSS评分控制后,miR-125a-3p水平高、aPLs阳性为预后不良的危险因素(P<0.05),见表4。
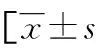
表3 不同预后患者一般资料及miR-125a-3p水平、aPLs阳性率或n/n或n(%)]

表4 CIS患者预后不良危险因素的Logistic回归分析
2.5miR-125a-3p、aPLs对CIS患者不良预后的预测价值 绘制miR-125a-3p、aPLs预测CIS患者不良预后的ROC曲线,结果显示,miR-125a-3p、aPLs预测不良预后的AUC分别为0.781、0.736,应用SPSS软件的联合应用ROC曲线理论模式,构建各指标联合预测的ROC曲线模型,结果显示,联合预测AUC最大,为0.859。见表5、图1。
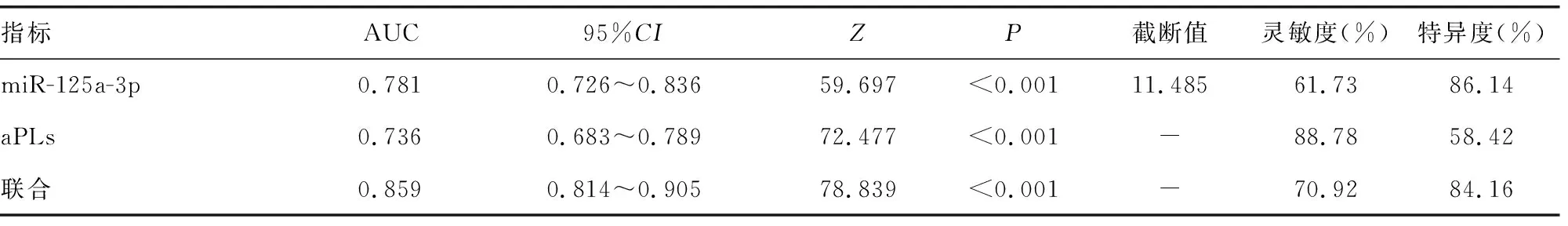
表5 miR-125a-3p、aPLs单独及联合对CIS患者不良预后的预测价值
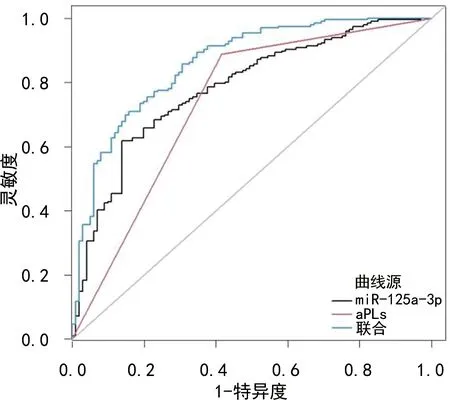
图1 miR-125a-3p、aPLs单独及联合预测CIS患者预后不良的ROC曲线
3 讨 论
CIS为我国致死、致残的主要原因,其发生呈逐年递增趋势,调查指出我国每年新发患者超过两百万,给社会及家庭带来严重疾病负担[9]。因此,如何预防CIS发生、提高治疗效果、改善预后为当前医学面临的重大挑战。
研究指出,CIS发病机制较为复杂,内皮功能紊乱、炎症反应、动脉粥样硬化在其病理生理过程中具有重要作用[10]。miRNA为由核苷酸组成的一类内源性单链非编码RNA分子,可影响靶基因表达,参与CIS复杂病理生理过程启动,并参与CIS的发展[11]。GORUR等[12]学者指出,miRNA可参与斑块内细胞凋亡、影响动脉粥样硬化斑块形成及破裂,并在神经元破坏、局部炎症等方面具有重要作用。XU等[13]同样指出,miRNA可能参与内皮细胞功能紊乱、炎性介质释放,促使动脉粥样硬化斑块形成、破裂,参与脑卒中的发展。以上研究均表明miRNA在脑卒中的发生发展中具有重要作用。此外,WU等[14]学者指出,miRNA表达与脑卒中患者神经功能具有一定关系,能作为评估其神经缺陷程度生物学指标。miR-125a-3p定位在染色体19q13,戴海龙等[15]学者指出,miR-125a-3p在冠心病患者中高表达,可能参与了动脉粥样硬化过程。为此,推测其在脑卒中的发病中同样有一定作用。基于此,本研究通过测定CIS患者及健康体检者miR-125a-3p水平发现,CIS患者miR-125a-3p水平明显升高,可见miR-125a-3p表达提高可能加重动脉粥样硬化,促进病情进展,参与CIS的发生。究其原因在于CIS属于一种慢性炎症,巨噬细胞在动脉粥样硬化的形成、发展中具有重要作用,其通过在斑块部位聚集,释放相关细胞因子溶解粥样斑块纤维帽,从而使斑块破裂,从而参与CIS的发生,而miR-125a-3p在M1型巨噬细胞中呈高表达状态,有学者指出miR-125a-3p可能作用于M1型巨噬细胞,使其在斑块中发挥作用,从而加剧斑块不稳定性[16-17]。可见miR-125a-3p与CIS病情进展密切相关,检测其水平有助于临床评估患者在治疗过程中的病情,临床应密切关注miR-125a-3p水平的变化。
近年来,aPLs与CIS的关系逐渐受到人们广泛关注,有研究发现aPLs与CIS密切相关[18]。研究指出,调整其他传统危险因素后aPLs阳性者发生CIS风险较aPLs阴性者明显上升[19]。一项基础研究指出,aPLs可损伤血脑屏障进入大脑,产生神经元毒性,加重神经功能损伤,aPLs的情况可反映临床治疗过程中患者病情的变化,aPLs阳性者可能预后效果更差[20]。本研究发现,CIS患者aPLs阳性率明显升高,表明aPLs可能与CIS的发生有关,且神经损伤越重,阳性表达率越高。结合既往研究分析原因如下:(1)aPLs可加重血管内皮细胞损伤,导致前列环素与血栓素间平衡被破坏,导致血管收缩及水栓形成,同时aPLs还可激活肾素-血管紧张素-醛固酮系统,促使小动脉收缩,血管外周阻力增加,导致脑血流量降低,从而引发CIS;(2)aPLs可引起脂代谢紊乱,导致动脉粥样硬化,诱发血栓形成;(3)aPLs还可通过影响抗凝-纤溶系统促使血栓形成,参与CIS的发生[21-22]。可见aPLs可从多方面参与CIS的发生及进展,临床应密切关注aPLs阳性的患者。
CIS患者在经规范治疗后仍可能遗留不同程度的神经缺损症状,影响患者生活质量,因此,找寻能预测CIS患者预后情况的相关指标,及时对其情况进行评估并采取针对性干预措施,对CIS患者预后改善有一定帮助。本研究经多因素Logistic回归分析发现,miR-125a-3p水平高、aPLs阳性为预后不良的危险因素,可见miR-125a-3p、aPLs对CIS患者预后不良具有一定预测价值。为此,本研究采用ROC曲线评价miR-125a-3p、aPLs对CIS患者预后不良的预测价值,结果显示,miR-125a-3p、aPLs单独预测的AUC分别为0.781、0.736,表明上述指标均具有一定预测价值,将二者联合预测AUC达0.859,可有效提高预测价值,为临床预后评估提供参考。因此,对于aPLs为阳性且miR-125a-3p呈高表达CIS患者,临床需高度重视,密切关注病情变化情况,从而降低不良预后风险。
综上所述,CIS患者miR-125a-3p水平、aPLs阳性率明显升高,且与神经功能缺损程度密切相关,miR-125a-3p、aPLs在CIS患者预后评估方面具有较好价值,可为临床预后评估提供参考。

