肺炎克雷伯菌荚膜血清型和耐药基因型检测及其耐药机制研究
兰 俊,侯 轩,王 辉,张清雯
三二〇一医院:1.医学检验科;2.医学微生物免疫科,陕西汉中 723000
有研究报道显示,肺炎克雷伯菌感染已经成为医院内感染的常见菌之一[1]。目前,临床对于肺炎克雷伯菌感染患者的治疗中,多选用头孢类及碳青霉烯类抗菌药物。但是,临床研究发现,由于抗菌药物的广泛使用,病原菌对抗菌药物的耐药率呈逐年上升的趋势[2]。高黏液表型肺炎克雷伯菌(HMKP)是高毒力型病原菌的重要代表,随着耐碳青霉烯类-HMKP(CR-HMKP)的分离,其在临床的迁徙性扩散已经成为全球性的公共卫生问题[3]。正常生理状态下,肺炎克雷伯菌存在于人体的上呼吸道、肠道中,当机体的免疫力显著下降时,肺炎克雷伯菌可经呼吸道进入肺内,最终造成肺大叶或者肺小叶的融合性病变[4]。研究证实,HMKP在医院内已经形成若干暴发流行[5]。但是,对于HMKP荚膜的血清学分析的研究较少[6]。本研究主要对肺炎克雷伯菌的血清型鉴定、耐药基因型检测及其耐药机制进行分析,以期为临床诊断及治疗提供科学依据。
1 资料与方法
1.1一般资料 选择2018年5月至2021年5月本院收治的240例HMKP感染者作为研究对象,其中CR-HMKP感染者49例(CR-HMKP组),非CR-HMKP类感染者191例(非CR-HMKP组)。
1.2仪器与试剂 ExTaq酶及DNA Marker均购自TaKaRa公司,基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)仪由美国布鲁克(Bruker)公司提供,全自动细菌药敏分析仪由美国BD公司提供,PCR仪由上海宏石医疗科技有限公司提供。
1.3方法
1.3.1标本采集及HMKP分离 采集所有患者的痰液标本,采用MALDI-TOF MS仪进行细菌鉴定,采用BD Phoenix M50 全自动微生物鉴定及药敏分析系统进行药敏试验及超广谱β-内酰胺酶(ESBL)检测。检测过程中,将标本在生物安全柜中接种于血平板,使用接种环轻触菌落表面,能拉起黏液丝长度≥5 mm则为拉丝实验阳性,可判定为HMKP。通过药敏试验分析,对碳青霉烯类耐药的HMKP则为CR-HMKP[7]。
1.3.2耐药及毒力基因检测 分别对患者痰液的DNA进行扩增后,采用PCR及电泳方法对毒力基因(aerobactin、alls、mrkD、iroN、rmpA、magA、rmpB)、碳青霉烯酶基因(blaKPC、blaNDM、blaIMP、blaVIM、blaOXA-48)、质粒介导的喹诺酮耐药基因[qnrA、qnrB、qnrC、qnrS、acc(6-IB-CR)]、ESBL基因(blaTEM、blaCTX-M、blaSHV),以及16S核糖体RNA(rRNA)甲基化酶基因(rmtC、rmtB、armB、armA)进行检测。基因测序均由深圳华大基因科技股份有限公司完成。
1.3.3质粒接合实验 以临床分离的CR-HMKP作为供体菌,使用大肠埃希菌J53作为受体菌,对于以上菌株进行接种中国蓝平皿后,在35 ℃下进行孵育过夜,将活化后的菌株分别用生理盐水调至0.5 MCF(麦氏浊度单位),取5 μL菌液在1 mL的营养肉汤中进行接种,在35 ℃下进行孵育4 h,使用供体菌20 μL及受体菌40 μL按照1∶2进行混合,接种于2 mL的营养肉汤,在35 ℃下进行孵育18 h,使用上述的混合液在筛选平皿中涂抹,在35 ℃下孵育过夜,再次挑选菌落转移到另外一个筛选平皿中,在35 ℃下孵育过夜。使用质谱仪进行鉴定,采用全自动微生物鉴定及药敏分析仪进行药敏试验。
1.3.4荚膜血清学分析 采用PCR仪检测HMKP的K1、K2、K5、K20、K54、K57血清学分布。同时,对肺炎克雷伯菌的7个管家基因(rpoB、pgi、infB、gapA、phoE、mdh、tonB)进行测序。
1.4观察指标 (1)分析药敏试验结果,并比较CR-HMKP组及非CR-HMKP组HMKP对头孢噻肟、头孢曲松、头孢唑林、哌拉西林、亚胺培南、美罗培南、厄他培南、头孢吡肟及阿米卡星的耐药情况。(2)分析毒力基因分布结果,分别对CR-HMKP组及非CR-HMKP组HMKP毒力基因aerobactin、alls、mrkD、iroN、rmpA、magA、rmpB的表达情况进行比较。(3)分析耐药基因分布情况,分别对CR-HMKP组及非CR-HMKP组HMKP的blaKPC、blaNDM、blaCTX-M、blaSHV、qnrC、rmtB基因表达情况进行比较。(4)分析荚膜血清学分布情况,分别对CR-HMKP组及非CR-HMKP组HMKP的荚膜血清型K1、K2、K57分布情况进行比较。(5)分析质粒接合实验结果。
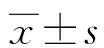
2 结 果
2.1两组HMKP的药敏试验结果分析 CR-HMKP组及非CR-HMKP组HMKP对头孢噻肟、头孢曲松、头孢唑林、哌拉西林、亚胺培南、美罗培南、厄他培南、头孢吡肟及阿米卡星的耐药情况比较,差异均有统计学意义(P<0.05),见表1。
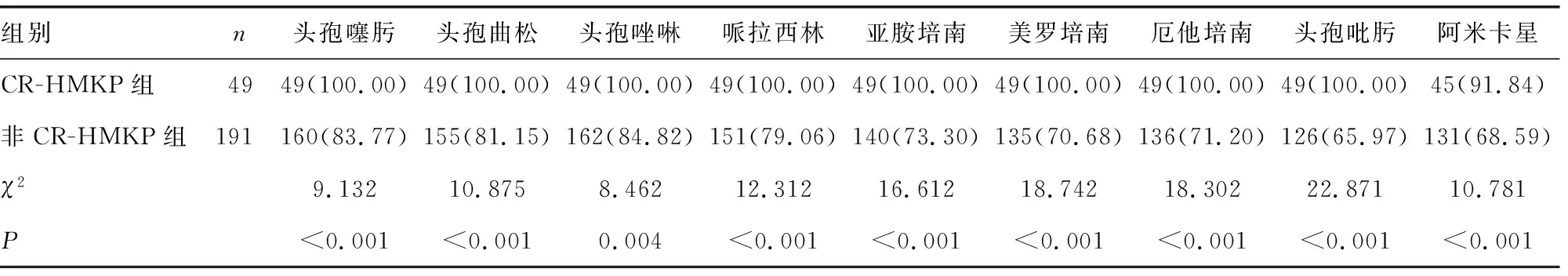
表1 两组HMKP的药敏试验结果[n(%)]
2.2两组毒力基因分布情况分析 CR-HMKP及非CR-HMKP组HMKP的aerobactin、alls、mrkD、iroN、rmpA、magA、rmpB 7个管家基因表达情况比较,差异有统计学意义(P<0.05),见表2。
2.3两组耐药基因分布情况分析 CR-HMKP及非CR-HMKP组HMKP的blaKPC、blaNDM、blaCTX-M、blaSHV、qnrC、rmtB基因表达之间的差异均有统计学意义(P<0.05),见表3。
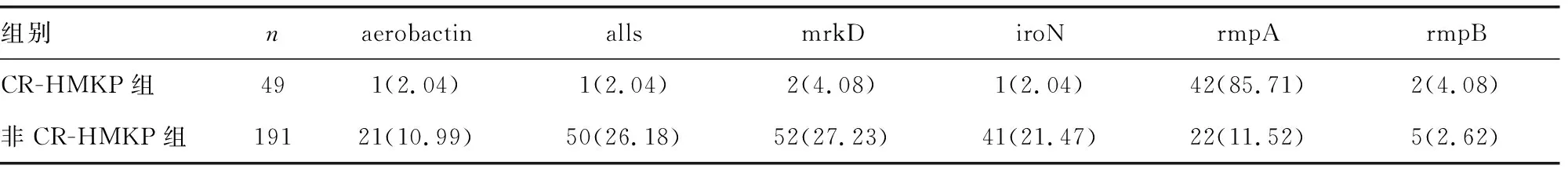
表2 两组毒力基因分布情况分析[n(%)]
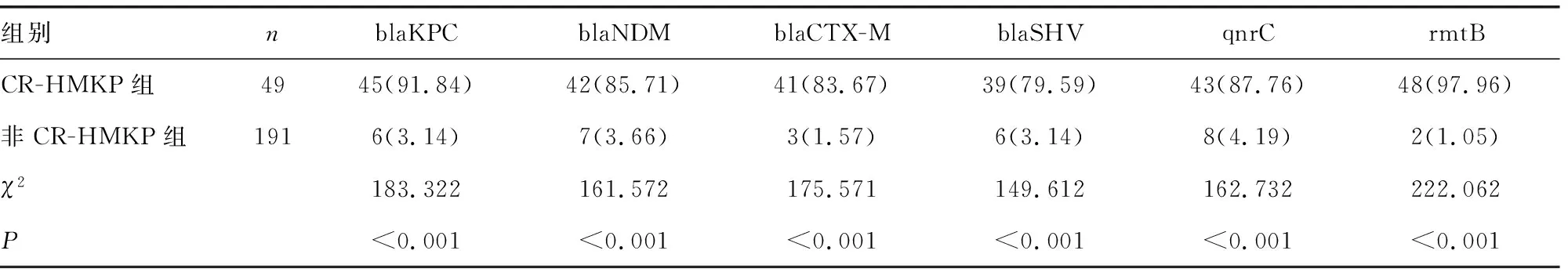
表3 两组耐药基因分布情况分析[n(%)]
2.4两组荚膜血清学分布情况 CR-HMKP组及非CR-HMKP组HMKP的K1、K2、K57血清学分布情况比较,差异有在统计学意义(P<0.05),见表4。
2.5质粒接合实验分析 质粒接合实验分析显示,两组HMKP对头孢噻肟、头孢曲松、头孢唑林、哌拉西林、亚胺培南、美罗培南、厄他培南、头孢吡肟及阿米卡星的最小抑菌浓度(MIC)比较,差异均有统计学意义(P<0.001),见表5。

表4 两组荚膜血清学分布情况[n(%)]
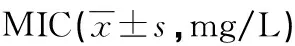
表5 质粒接合实验抗菌药物的
3 讨 论
流行病学调查显示,肺炎克雷伯菌造成的呼吸道感染的发病率呈现显著的上升趋势[8]。从本院的研究资料来看,由CR-HMKP造成的呼吸机相关性肺炎的比例较高,所以及时通过对本医疗机构的肺炎克雷伯菌感染及耐药情况的分析,对于医院内感染控制工作的提升具有重要的意义。目前研究认为,在肺炎克雷伯菌的感染过程中,频繁使用抗菌药物,大量生成的灭活酶可进一步造成药物抗菌活性的下降[9]。同时,不当使用抗菌药物还会造成相关耐药基因的激活,抗菌药物的作用位点发生改变,进而影响抗菌药物发挥抗菌作用[10]。在患者治疗过程中,耐药菌株抗菌药物外排泵的过度表达,造成呼吸道感染患者靶点的药物剂量降低,从而导致耐药,影响患者的治疗效果[11]。通过药敏试验指导临床及时调整抗菌药物治疗方案,不仅对优化医疗治疗方案具有积极的意义,同时有利于患者治疗效果的提升[12]。
在肺炎克雷伯菌感染过程中,荚膜是肺炎克雷伯菌感染的重要毒力因子,根据荚膜多糖建立的分型方法[13],可以将其分为不同的血清型,目前已知的血清型主要包括78个,而纳入本研究的K1、K2、K5、K20、K54、K57被认为是高毒力肺炎克雷伯菌的主要血清型。既往研究中,K20被广泛报道[14],同时K2血清型也在以往CR-HMKP感染中被发现,而本研究中发现的荚膜血清型主要为K1、K2、K57,与以往的研究存在一定差异。分析认为,造成此种差异的原因是不同地区人群的基因多态性[15]。对毒力基因分布结果分析显示,发生CR-HMKP感染的患者主要表现为rmpA基因表达异常,提示在日后的临床研究中,rmpA基因可作为本地区肺炎克雷伯菌感染药物治疗的重要靶向。本研究对耐药情况的分析发现,CR-HMKP对头孢噻肟、头孢曲松、头孢唑林、哌拉西林、亚胺培南、美罗培南、厄他培南、头孢吡肟的耐药情况均为100%,对阿米卡星的耐药情况则较低。建议在临床对此类患者的治疗中降低头孢噻肟、头孢曲松、头孢唑林、哌拉西林、亚胺培南、美罗培南、厄他培南、头孢吡肟等药物的使用量,同时联合使用多种抗菌药物,降低耐药性。
流行病学调查显示,HMKP造成的感染可达到2%~18%[16],而目前国内对于CR-HMKP造成呼吸道感染的区分的研究还较少,也缺乏对诊疗过程中呼吸道感染患者CR-HMKP的认识[17]。但近年来的研究指出,CR-HMKP的耐药率呈现显著升高趋势[18]。随着CR-HMKP感染风险的显著升高,其较高的侵袭性及病死率使其已成为呼吸道感染的“超级细菌”[19]。因此,对患者耐药情况进行分析,及时调整治疗方案,对于患者的治疗具有积极意义[20]。
但是本研究还存在一定的局限性,纳入研究的样本量较小,同时CR-HMKP感染存在显著的地域性差异,所以在对患者的治疗中,对于不同地区的指导意义还有待在日后的研究中进行验证。
综上所述,肺炎克雷伯菌的荚膜血清型主要表现为K2,耐药基因主要为rmtB,二者均可作为肺炎克雷伯菌感染者治疗的重要靶点。

