短链脂肪酸改善脊髓损伤引起的肝脏功能异常*
荆瀛黎,王秋颖,白 帆,李 彦,杨德刚,于 艳
中国康复科学所/中国康复研究中心/神经损伤与康复北京市重点实验室/北京脑重大疾病研究院神经损伤与修复研究所,北京 100068
脊髓损伤(SCI)是一种严重致残性疾病,1990-2016年间全球神经系统疾病的负担研究显示,2016年全球约有93万例新发SCI患者,中国有9.8万例新发患者,中国累计有373万例SCI患者[1],给家庭和整个社会造成巨大的负担。SCI后循环系统、肺、肾和肝脏中趋化因子和白细胞迅速升高,引发全身炎症反应,这种全身反应可能导致SCI后的急性期和慢性期的器官/系统功能障碍[2-4]。有研究发现,SCI后肝脏异常最先发生,随后加剧脊髓组织的病理损伤[5],这些数据表明肝脏在SCI后引发和延长全身炎症方面起着关键作用。
短链脂肪酸(SCFAs)为碳原子数小于6的饱和脂肪酸,主要由肠内厌氧菌发酵膳食纤维等不可消化碳水化合物产生的终产物,其中乙酸、丙酸和丁酸占SCFAs体内含量的95%以上,三者摩尔比约为60∶20∶20[6]。SCFAs是结肠的重要能量来源[7],也作为关键信号分子参与宿主健康和疾病的调节,如影响免疫功能、维护肠道屏障功能、调节代谢功能等[8]。研究表明,SCFAs通过调节天然免疫细胞如巨噬细胞、中性粒细胞及树突细胞的募集和迁移,调节T细胞和B细胞的分化,影响免疫应答和炎症反应[9]。在急性炎症中,SCFAs通过菌群代谢-肝脏-免疫的相互作用影响肠道屏障和肝脏损伤[10]。鉴于SCFAs在改善肠道黏膜屏障功能和调节免疫方面的特殊作用,本研究通过观察SCFAs对SCI小鼠肝脏炎症细胞浸润、细胞因子表达及脂质代谢的影响,阐述SCFAs对SCI小鼠模型肝脏损伤的调节作用。
1 材料与方法
1.1材料
1.1.1实验动物 雌性C57BL/6小鼠30只(北京维通利华公司),体重18~22 g,将其按照随机数字表法分为假手术(Sham)组、SCI组及SCFAs干预(SCI+SCFAs) 组,每组10只。动物饲养于室温(23±3)℃,相对湿度(55±10)%的环境中,12 h∶12 h明暗交替,动物自由饮水、进食。实验设计和实验操作均符合首都医科大学动物伦理和福利委员会的要求,并审查批准(伦理号:AEEI-2022-111)。
1.1.2主要试剂与仪器 RNA提取液(Servicebio公司);HyPureTMMolecular Biology Grade Water(HyClone公司);Servicebio®RT First Strand cDNA Synthesis Kit(Servicebio公司);2×SYBR Green qPCR Master Mix (None ROX)(Servicebio公司);引物(Servicebio公司);丙氨酸氨基转移酶(ALT)、甘油三酯(TG)、胆固醇(CHO)检测试剂盒(深圳雷杜生命科技公司);三氯甲烷、异丙醇和无水乙醇(国药集团化学试剂有限公司);荧光定量PCR(RT-qPCR)仪(Bio-Rad公司);Chemray420全自动生化分析仪(深圳雷杜生命科技公司);PSI脊髓损伤打击器(Precision Systems and Instrumentation公司)。
1.2方法
1.2.1小鼠SCI模型建立 2%异氟烷麻醉小鼠,进行手术固定并备皮,以T10为中心纵向切口,暴露T9~T11棘突及椎板,行T10椎板切除术,暴露脊髓。利用IH-0400打击器制作SCI模型,打击后,生理盐水冲洗,加入明胶海绵,逐层缝合。将小鼠放入保温箱内直至苏醒,术后皮下注射林格液0.5 mL,连续5 d,每天给予下腹部按摩挤压膀胱2~4次帮助排尿和排便,直至排尿反射恢复。
1.2.2实验分组 Sham组仅行椎板切除术,不进行脊髓打击;SCI组接受椎板切除术和脊髓打击造模;SCI+SCFAs组进行脊髓打击后给予SCFAs干预,即在小鼠饮水中添加SCFAs(25.9 mmol/L丙酸钠,40 mmol/L丁酸钠和67.5 mmol/L乙酸钠),持续4周。
1.2.3RT-qPCR检测 损伤后4周,取出肝脏组织,提取肝脏组织中总RNA,利用Nanodrop测量总RNA的浓度与纯度。按照试剂盒说明书指导进行逆转录,以得到的cDNA样品为模板,配制20 μL PCR反应体系。PCR扩增程序为:95 ℃预变性30 s,循环1次;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次。采用2-ΔΔCt定量分析目的基因表达,ΔCt=Ct(目的基因)-Ct(内参),ΔΔCt=ΔCt(处理组)-ΔCt(对照组)。肝组织中CD68、白细胞介素(IL)-1α、IL-1β、肿瘤坏死因子α(TNFα)、固醇调节元件结合蛋白1(SREBP-1)、乙酰辅酶A羧酸化酶(ACC)、肝X受体α(LXRα)和过氧化物酶体增殖激活物受体α(PPARα)的mRNA水平采用RT-qPCR法进行检测,具体引物信息见表1。

表1 引物序列(5′-3′)
1.2.4血液生化指标检测 损伤后4周,每只动物通过心脏采集0.5 mL小鼠血液标本,3 000 r/min低温离心10 min,取上清液,采用Chemray420全自动生化分析仪检测血清TG、CHO和ALT水平。实验操作严格按照说明书执行。
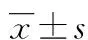
2 结 果
2.1SCFAs对SCI小鼠肝脏免疫炎症的调节作用 与Sham组相比,SCI组肝脏CD68 mRNA表达显著上调(P<0.05);与SCI组相比,SCI+SCFAs组肝脏CD68 mRNA表达显著下调(P<0.05),见图1A。肝脏组织中炎症因子检测结果显示,3组IL-1α和IL-1β 水平比较差异无统计学意义(P>0.05),见图1B、C;SCI组TNFα mRNA表达较Sham组显著上调(P<0.05),SCI+SCFAs组TNFα mRNA表达较SCI组显著下调(P<0.05),见图1D。
2.2SCFAs对SCI小鼠脂肪代谢的影响 SCI后3 d小鼠体重显著下降(P<0.05),之后体重呈上升趋势。与Sham组相比,SCI组损伤后的1个月内体重显著降低(P<0.05);SCFAs干预后21 d和28 d,SCI+SCFAs组体重与SCI组相比显著升高(P<0.05),见图2A。肝脏比重、血清TG和CHO水平检测结果显示,与Sham组相比,SCI组小鼠肝脏比重、血清TG水平显著降低(P<0.05);但SCI组与SCI+SCFAs组血清TG水平和肝脏比重差异无统计学意义(P>0.05),见图2B、C;3组血清CHO水平比较差异均无统计学意义(P>0.05),见图2D。
2.3SCFAs对SCI小鼠脂肪代谢基因的影响 为检测SCFAs影响肝脏脂代谢的分子机制,本研究检测肝脏中参与脂代谢的多种基因,如固醇调节元件结合蛋白1(SREBP-1)、乙酰辅酶A羧酸化酶(ACC)、肝X受体α(LXRα)、过氧化物酶体增殖物激活受体α(PPARα)的mRNA表达情况。SCI后,SREBP1和ACC mRNA水平显著降低(P<0.05);与SCI组相比,SCI+SCFAs组SREBP1和ACC mRNA水平显著上调,差异有统计学意义(P<0.05),见图3A、B;但3组LXRα 和PPARα mRNA水平差异均无统计学意义(P>0.05),见图3C、D。
2.4SCFAs对SCI小鼠血清ALT的调节作用 对小鼠血清ALT水平检测结果显示,与Sham组比较,SCI组血清ALT显著上调(P<0.05),与SCI组相比,SCI+SCFAs组 ALT水平显著下调,差异均有统计学意义(P<0.05)。见图4。

注:A为体重;B为肝脏比重;C为TG;D为CHO;**P<0.01,#P<0.05,##P<0.01,ns表示差异无统计学意义。
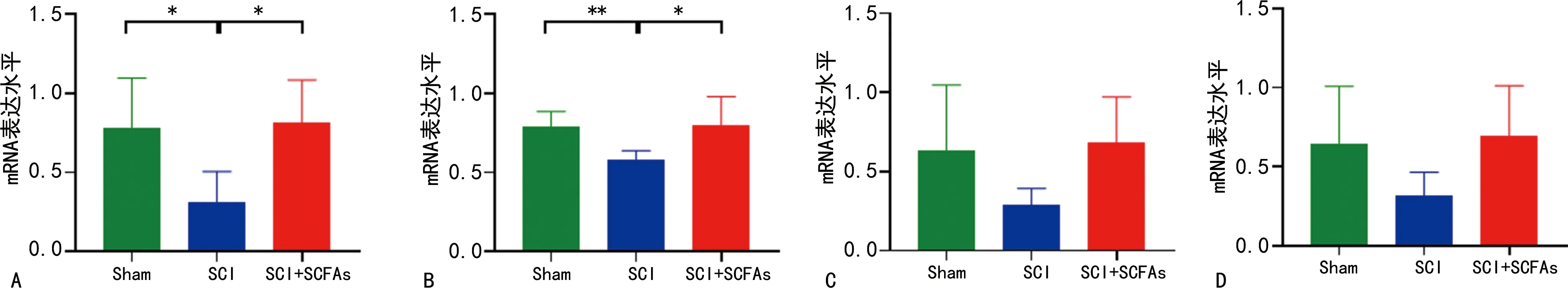
注:A为SREBP-1;B为ACC;C为LXRα;D为PPARα;*P<0.05,**P<0.01。

注:*P<0.05,**P<0.01。
3 讨 论
脊髓损伤可触发全身炎症反应,并引起伤后继发性脏器损害。肝脏功能受到发自脑干的副交感神经和中下胸段脊髓发出的交感神经调节,T10以上节段SCI会损伤肝脏的自主神经支配,进而影响肝脏的正常功能。因此,肝脏病理性损伤是SCI常见的临床特征。研究发现,SCI后,肝脏内白细胞数目和细胞因子水平显著升高[11]。一项临床研究数据显示,超过70%的SCI患者出现肝脏的异常改变[12]。有研究显示,SCI患者肝炎或肝硬化的患病率是普通人的7倍[13]。本研究结果表明,SCI能够诱导肝脏炎症和病理损伤至少持续至损伤后4周。SCI诱导的肝脏病理变化包括巨噬细胞的激活、炎症细胞因子的表达升高,以及脂质代谢异常;而SCFAs能够部分逆转SCI后诱导的肝功能异常。肝脏组织中的特殊巨噬细胞——Kupffer细胞与肝细胞损害程度密切相关,CD68是Kupffer细胞表面标志物,可反映Kupffer细胞的活化水平。本研究结果表明,SCFAs可显著减低SCI后肝脏TNFα和CD68 mRNA水平,抑制肝脏内巨噬细胞活化和降低炎症细胞因子水平,发挥保护肝脏组织的作用。
肝脏作为脂肪代谢的重要器官,在脂类的消化、吸收、分解等代谢过程中均起重要作用。脂代谢异常与炎症关系密切,肝脏特异性免疫细胞浸润与促炎细胞因子表达可促进脂肪代谢性疾病的发生发展[14]。本研究结果显示,SCI后,小鼠肝脏比重和血清TG水平下调(P<0.05)。而临床数据报道,76%的SCI患者会出现至少一项脂质代谢参数异常,如TG、CHO、低密度脂蛋白胆固醇(LDL-C)等异常升高[15-16]。本研究中,SCI后脂质代谢参数并没有异常升高,可能与损伤的严重程度或观察期长短有关。本研究结果显示,SCFAs干预后,血清TG水平、脂肪酸合成代谢相关基因SREBP1和ACC mRNA水平升高,表明SCFAs可能通过上调SREBP1和ACC mRNA水平影响肝脏的脂代谢。这可能因为SCFAs干预缓解了肝脏免疫炎症反应,通过调节脂肪代谢相关基因的表达从而使脂代谢趋于正常,从而促进体重增加。
血清ALT是肝脏中一种丰富的代谢酶,常被用作检测肝脏损伤的指标。肝脏细胞受损导致ALT在循环中累积,血清ALT升高通常意味着肝脏受损[17]。本研究发现,SCI后4周血清ALT水平显著升高,这表明随着肝脏局部病理反应变成慢性疾病过程,肝脏逐渐失去了减轻损伤和实施修复的能力。而SCFAs干预后通过其抗炎和调节脂代谢的作用,减轻肝细胞的损害程度,显著降低ALT水平。研究数据提示,SCFAs可改善SCI后肝功能指标,对肝脏损伤有一定的保护作用。肝脏在全身炎症反应的播散过程中起到了至关重要的作用,改善SCI后肝脏功能对减轻其临床并发症、改善预后具有重要意义。
本研究尚有一些不足之处,研究周期较短,未对SCI后SCFAs干预效果进行长期观察;后续研究将长期观察SCFAs对SCI肝脏的保护效果,深入探讨其对SCI后其他并发症的调节作用。
研究表明,SCFAs在中枢神经系统疾病治疗中也发挥重要作用[18-21]。在大脑中动脉远端永久性闭塞动脉模型中,SCFAs给药能够抑制小胶质细胞活化并减少其数量,显著降低脑中淋巴细胞侵袭,促进神经功能恢复[18]。在多发性硬化的患者中补充SCFAs,可显著升高IL-10水平,降低IL-17和γ干扰素水平,逆转Treg细胞与Th17细胞数量的不平衡,降低全身性免疫反应,改善疾病的症状[19]。
综上所述,SCFAs可改善脊髓损伤引起的肝脏损伤,对肝脏具有保护作用,可能有利于神经功能的修复。

